CTD格式申报资料撰写格式(制剂)带实例
CTD格式申报资料目录、化学药品申报资料项目(附件二格式)(5篇范例)

CTD格式申报资料目录、化学药品申报资料项目(附件二格式)(5篇范例)第一篇:CTD格式申报资料目录、化学药品申报资料项目(附件二格式)附件:原料药CTD格式申报资料目录管理信息资料:审查意见表/受理通知书(进口申请);药品注册现场核查报告;药品注册现场检查报告;药品注册检验报告申请表;药品研制情况申报表;药品注册现场检查申请表综述资料(文件夹名)1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
信息汇总表(文件夹名)信息汇总表资料药学资料(文件夹名)1.基本信息(3.2.S.1)生产信息(3.2.S.2)3.特性鉴定(3.2.S.3)4.原料药的质量控制(3.2.S.4)5.对照品(3.2.S.5)6.包装材料和容器(3.2.S.6)7.稳定性(3.2.S.7)药理毒理研究资料(文件夹名)16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
19.急性毒性试验资料及文献资料。
20.长期毒性试验资料及文献资料。
21.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。
22.复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。
23.致突变试验资料及文献资料。
24.生殖毒性试验资料及文献资料。
25.致癌试验资料及文献资料。
26.依赖性试验资料及文献资料。
27.非临床药代动力学试验资料及文献资料。
临床试验资料(文件夹名)案。
30.临床研究者手册。
31.知情同意书样稿、伦理委员会批准件。
32.临床试验报告。
二、制剂CTD格式申报资料电子提交目录管理信息资料:审查意见表/受理通知书(进口申请);药品注册现场核查报告;药品注册现场检查报告;药品注册检验报告申请表;药品研制情况申报表;药品注册现场检查申请表综述资料(文件夹名)1.药品名称。
ctd格式申报资料中原料药及制剂的稳定性案例分析

2、稳定性研究案例分析 3.2.P.7 稳定性 3.2.P.7.1 稳定性总结 3.2.P.7.2 上市稳定性承诺和稳定性方案 3.2.P.7.3 稳定性数据
精选课件
3.2.P.7 .1 稳定性总结
精选课件
(2)研究内容
精选课件
(3)研究结论
内包材 贮藏条件
铝塑 密封,常温(10-30℃)保存
符合规定
应为标示量的 93.0%~105.0%
*1:12、24、36月时检测
精选课件
三、稳定性研究技术要求
1、稳定性研究技术指导原则(修订征求意见 稿) 2、稳定性研究需关注的问题
精选课件
1、稳定性研究技术指导原则(修订征求意见 稿) ➢修订背景 ➢修订指导思想 ➢修订的主要内容 ➢明晰几个注册申报相关的概念
稳定性试验批次、批量及注册申报要求 修订前—3批、一定规模,能代表规模生产条件 的产品质量
—处方、工艺与生产规模一致 —口服固体制剂如片剂、胶囊应为10000 个制剂单位左右,大体积如包装制剂(如静脉输 液等)的批量至少应为稳定性试验所需总量的10 倍,特殊品种、特殊剂型所需的数量,视具体情 况而定 批量的代表性、与商业化生产产品质量的一致性 ?
有效期
24个月
对说明书中相关内容的提示 无
精选课件
点评(申报资料p193-200): —稳定性试验样品的批量较小(800片、3.5万 片) —长期试验 仅有12个月数据,未对试验结果 进行分析评估,以支持24个月的有效期
精选课件
3.2.P.7 .2上市稳定性承诺和稳定性方案 (申报资料p192)
精选课件
长期试验条件: 修订前—25℃±2℃/60%RH±10%RH 修订后—25℃±2℃/60%RH±5%RH和/或 30℃±2℃/65%RH±5%RH 冷冻保存制剂的加速试验 修订前—冷冻保存药品可不进行加速试验 修订后—对-20℃±5℃贮藏的制剂,仍应对1批样品在 略高的温度下(如:5℃±3℃或25℃±2℃)进行放 置适当时间的试验,以了解短期偏离说明书/标签上的 贮藏条件对该制剂质量的影响
ctd格式申报资料模板

——重视对参比品的研究,确立研究目标
返回
美国对普通口服制剂 工艺申报综述资料的要求
• 药物生产过程中的单元操作有哪些? • 批次的一致性怎样? • 批次处方是否能正确反映药物产品的组成?如 果不能,差异在哪里?原因是什么? • 确保每个步骤成功的在线测试和控制的要素有 哪些? • 商业化规模与展示批次的规模相差有多大?仪 器是否采用相同的设计和操作原则?
单元 操作
设备
挤出制粒混合 仪
研究 阶段
2 kg 一万片
申请 批次
48 kg 23万片
拟生产 批次
480 kg 230万片
湿法制粒 高剪切制粒仪 PMA 10 PMA 300
PMA 1800
湿法过筛
干燥 碾压 压片
冲击碾压仪
FS 75
FS 200
MP 4 FS 200 Beta
FS 200
MP 6 FS 200 Beta
China 3 0.1%
0.95%
0.92% 0.1% 0.47%
0.95%
1.49%
返回
• 具体实例:
某进口的仿制药,仿制国外已上市的抗感染复
方粉针剂。
对原发厂产品进行了全面细致的分析:复方的
组成、辅料及用量、规格、粒度分布、有关物
质种类及含量、稀释液的种类、配制后溶液的 性状及贮存条件、包装瓶与胶塞、有效期等。
2.关键点
• 各资料的基本要求 综述资料 应系统全面、重点突出,综合所作的研 究工作证明药品的质量确实是稳定、 可 控的 申报资料 为综述资料提供充足的文献与试验依据, 包括具体的文献复印件及其译文、试验的 实施过程及数据、图表与照片等
综述中关键点(1)
• 原料药
ctd申报资料格式

ctd申报资料格式篇一:CTD格式申报资料范本药品注册分类:化学药品六类注册申请分类:仿制药品注册申请药品名称:苯磺酸氨氯地平片(XXg、XXg)资料项目名称:药学研究CTD格式申报资料研究机构名称:XXX制药有限公司研究机构地址:XXXXXXXXX 研究机构主要研究者:XXX 研究机构电话:XXX 注册申请联系人姓名:XXX 原始资料的保存地点:XXX制药有限公司注册申请机构联系电话:XXXXXXXXX药品注册申请人:XXX制药有限公司苯磺酸氨氯地平片申报资料(药学部分)目录3。
2。
P。
1 剂型及产品组成。
..。
.。
....。
.。
.。
.。
.。
.。
.。
.。
...。
.。
.。
...。
.3 3。
2.P.2 产品开发。
.。
.。
...。
....。
.。
..。
.。
.。
.。
.。
.。
.。
..。
43。
2。
P。
2。
1 处方组成。
..。
...。
.......。
.。
..。
...。
.。
..。
.. 43。
2。
P.2。
1。
1 原料药。
.。
....。
..。
.。
..。
.。
....。
.。
..。
.。
.。
.。
.。
.。
4 3。
2。
P。
2。
1。
2 辅料 ..。
.。
...。
..。
.。
.。
.。
.。
..。
.。
..。
..。
.。
..。
5 3.2。
P.2.2 制剂研究。
.。
.。
...。
.。
..。
...。
.。
.。
.。
...。
..。
53。
2.P.2.2.1 处方开发过程 ..。
.。
.。
...。
.。
.。
.。
.。
..。
.。
..。
...。
5 3。
2.P。
2.3 生产工艺的开发。
....。
.。
..。
..。
..。
....。
.。
.。
.。
...20 3。
2。
P。
2.4 包装材料/容器。
...。
..。
.。
.。
.。
.。
.。
..。
.。
.。
.。
23 2。
3.P.2.5 相容性 .。
...。
.。
.。
.。
...。
.。
..。
..。
..。
.。
.。
.。
...。
23 3.2。
P。
3 生产。
.。
....。
..。
.。
.....。
..。
.。
...。
...。
.。
..233。
ctd格式申报资料模板

三、总结
• 满足临床治疗与患者需求是药品研发立题 的主要依据。 • 质量源于设计:药品研发的质量决定了药 品的质量。 • 申报资料是注册时证明药品安全有效、质 量可控的重要依据。 • CTD格式的申报资料充分体现了药品研发 的系统性,对指导研发、注册申报,提高 审评的质量与效率均有重要意义。
国内外质量标准杂质检查项对比
质控:分析方法的验证与对照品的标定
稳定性:样品情况、结果的表述
综述中关键点(2)
• 制剂 处方工艺:研发过程、变化情况及批次 汇总表(代表性批次 ) 质量控制 :放行标准、有关物质方法学 验证应针对已知杂质、列明产品中可能 含有的杂质、对照品的标定 稳定性:上市后的承诺和方案、使用中 产品稳定性、相容性试验
单元 操作
设备
挤出制粒混合 仪
研究 阶段
2 kg 一万片
申请 批次
48 kg 23万片
拟生产 批次
480 kg 230万片
湿法制粒 高剪切制粒仪 PMA 10 PMA 300
PMA 1800
湿法过筛
干燥 碾压 压片
冲击碾压仪
FS 75
FS 200
MP 4 FS 200 Beta
FS 200
MP 6 FS 200 Beta
(二)重点解读
1.资料结构与特点 2.关键点
1.资料结构与特点
• 资料结构 主要研究信息汇总表(原料药、制剂) 相当于CTD第二部分的综述资料 申报资料撰写要求(原料药、制剂) 相当于CTD第三部分的研究资料 • 特点 与国外CTD基本一致(编码与资料) 综述与申报资料相互映证(包括编码)、互为 补充 适合电子提交,与审评报告结合能够方便审评, 提高效率、保证质量
ctd格式申报资料模板

(1)FDA对仿制药申报资料的要求
• 基于问题的审评模式 • 模板实例 • 该模式的特点 汇总了仿制药研发的各关键点与关键问题 • 采用该模式的益处 对申办人:指导研发、规范申报资料 对审评者:保证审评质量、提高效率
•
国内申报情况(均不含补充资料) 仿制药 新药 进口药 全部 2003 2887 5428 996 9324 2004 6664 6440 971 14115 2005 9723 6403 718 19368 2006 7050 4264 588 14636 2007 2336 2017 790 7364 2008 2039 2265 839 8617 2009 1104 906 614 6428
26
China 3 0.1%
0.95%
0.92% 0.1% 0.47%
0.95%
1.49%
返回
• 具体实例:
某进口的仿制药,仿制国外已上市的抗感染复
方粉针剂。
对原发厂产品进行了全面细致的分析:复方的
组成、辅料及用量、规格、粒度分布、有关物
质种类及含量、稀释液的种类、配制后溶液的 性状及贮存条件、包装瓶与胶塞、有效期等。
单元 操作
设备
挤出制粒混合 仪
研究 阶段
2 kg 一万片
申请 批次
48 kg 23万片
拟生产 批次
480 kg 230万片
湿法制粒 高剪切制粒仪 PMA 10 PMA 300
PMA 1800
湿法过筛
干燥 碾压 压片
冲击碾压仪
FS 75
FS 200
MP 4 FS 200 Beta
FS 200
MP 6 FS 200 Beta
药物制剂CTD申报资料(4、52类)模板
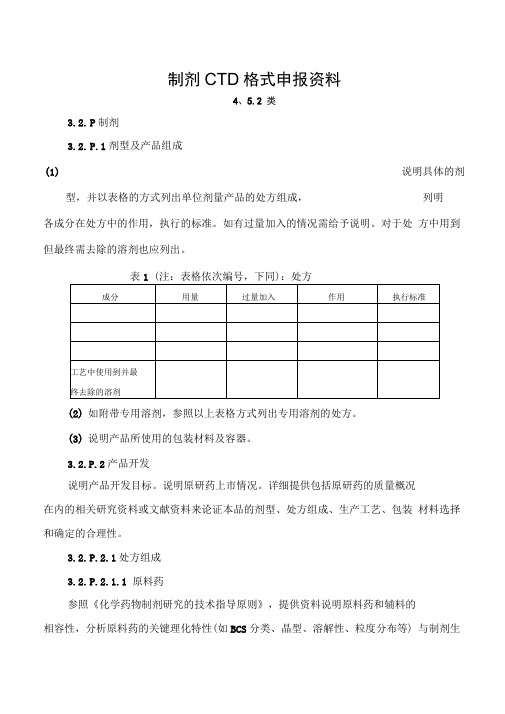
制剂CTD格式申报资料4、5.2 类3.2.P制剂3.2.P.1剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
表1 (注:表格依次编号,下同):处方(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
3.2.P.2产品开发说明产品开发目标。
说明原研药上市情况。
详细提供包括原研药的质量概况在内的相关研究资料或文献资料来论证本品的剂型、处方组成、生产工艺、包装材料选择和确定的合理性。
3.2.P.2.1处方组成3.2.P.2.1.1 原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等) 与制剂生产及制剂性能的相关性,并提供相关的研究资料与文献。
3.2.P.2.1.2 辅料说明辅料是否适合所用的给药途径结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性,提供相关的研究资料与文献。
3.2.P.2.2 制剂研究3.2.P.2.2.1处方开发过程参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)、辅料种类和用量选择的依据、分析辅料用量是否在常规用量范围内,以及自制样品与原研药的质量特性对比研究结果(需说明原研药的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应提供过量投料的必要性和合理性的相关研究资料。
3.2.P.2.2.2制剂相关特性对与制剂性能相关的理化性质,如pH、离子强度、溶出度、再分散性、复溶、粒径分布、聚合、多晶型、流变学等进行分析。
某片CTD格式申报资料

某片CTD格式申报资料3.2.P.1 剂型及产品组成本品为薄膜包衣片,规格为10mg、20mg,处方中含有的辅料为乳糖、微晶纤维素102、碳酸钙、交联羧甲基纤维素钠、聚山梨酯80、羟丙基甲基纤维素、硬脂酸镁、欧巴代胃溶型包衣,本品采用PVC铝塑泡罩包装,单位剂量产品的处方组成如下表。
成分 10mg规格用量 20mg规格用量作用执行标准【1】API 活性成分企标乳糖填充剂微晶纤维素102 填充剂、崩解剂碳酸钙填充剂、pH调节剂交联羧甲基纤维素钠崩解剂聚山梨酯80 助溶剂羟丙基甲基纤维素粘合剂硬脂酸镁润滑剂欧巴代包衣材料(2)水溶剂(2)乙醇溶剂【注1】原料药同时申报,为申报生产企业标准。
【注2】制剂终产品没有出现,干燥期间除去。
【注3】无过量投量。
3.2.P.2 产品开发3.2.P.2.1 处方组成3.2.P.2.1.1 原料药主药理化性质本品为(化学名)。
按无水物计算,含API(CHCaFNO)应为98.0%,66682410102.0%。
性状及溶解度:本品为白色或类白色结晶性颗粒;无臭,味苦。
本品在甲醇pthe right to recovery of principal and interest and costs; Waiver of recourse against the party of individual credit rights; Behavior of other claims against the Bank. The Agency shall, in accordance with the Bank's records management systems requirements, regulate the collection, safekeeping of personal credit file, pay attention to the following risks: customers based on incomplete information; Review and approval 中易溶,在乙醇或丙酮中微溶,在水中极微溶解,在氯仿、乙醚中几乎不溶或不溶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CTD格式申报资料撰写格式(制剂)3.2.P.1 剂型及产品组成3.2.P.2 产品开发3.2.P.2.1 处方组成3.2.P.2.1.1 原料药3.2.P.2.1.2 辅料3.2.P.2.2 制剂3.2.P.2.2.1 处方开发过程3.2.P.2.2.2 制剂相关特性3.2.P.2.3 生产工艺的开发3.2.P.2.4 包装材料/容器3.2.P.2.5 相容性3.2.P.3 生产3.2.P.3.1 生产商3.2.P.3.2 批处方3.2.P.3.3 生产工艺和工艺控制3.2.P.3.4 关键步骤和中间体的控制3.2.P.3.5 工艺验证和评价3.2.P.4 原辅料的控制3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准3.2.P.5.2 分析方法3.2.P.5.3 分析方法的验证3.2.P.5.4 批检验报告3.2.P.5.5 杂质分析3.2.P.5.6 质量标准制定依据3.2.P.6 对照品3.2.P.7 稳定性3.2.P.7.1 稳定性总结3.2.P.7.2 上市后的稳定性研究方案及承诺3.2.P.7.3 稳定性数据二、申报资料正文及撰写要求3.2.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
Eg:3.2.P.2 产品开发提供相关的研究资料或文献资料来论证剂型、处方组成、生产工艺、包装材料选择和确定的合理性,具体为:3.2.P.2.1 处方组成3.2.P.2.1.1 原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析与制剂生产及制剂性能相关的原料药的关键理化特性(如晶型、溶解性、粒度分布、吸湿性等)。
Eg:格列苯脲的粒度研究3.2.P.2.1.2 辅料说明辅料种类和用量选择的依据,分析辅料用量是否在常规用量范围内,是否适合所用的给药途径,(符合药用要求,注射剂辅料应符合注射液要求;不予主药发生不良相互作用;根据剂型选择必要的辅料)并结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性。
3.2.P.2.2 制剂研究3.2.P.2.2.1 处方开发过程参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)以及与对照药品的质量特性对比研究结果(需说明对照药品的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应说明并分析过量投料的必要性和合理性。
(说明其合理性和必要性,并提供支持性资料,一般需经过重复批次验证---一般不推荐过量投药)&关注-----处方设计思路与预期达到的目标-----处方筛选优化及处方确定,与对照药品质量进行研究※基于前期对药物/辅料考察针对性设计,系统设计各种处方进行筛选研究※制剂基本性能评价/稳定性评价考察指标为影响质量与稳定性的关键项目,关注制剂的个性化指标的考察※确定影响制剂质量的关键因素3.2.P.2.2.2 制剂相关特性 ICH Q8对与制剂性能相关的理化性质,如pH,离子强度,溶出度,再分散性,复溶、粒径分布、聚合、多晶型、流变学等进行分析。
提供自研产品与对照药品在处方开发过程中进行的质量特性对比研究结果,例如有关物质等。
如为口服固体制剂,需提供详细的自研产品与对照药品在不同溶出条件下的溶出曲线比较研究结果,推荐采用f2相似因子的比较方式。
3.2.P.2.3 生产工艺的开发简述生产工艺的选择和优化过程,重点描述工艺研究的主要变更(包括批量、设备、工艺参数等的变化)及相关的支持性验证研究。
关注:※结合剂型特点、药物及辅料理化性质、拟达到的质量指标设计和选择工艺。
Eg:如遇湿、热不稳定,工艺应避免水分、热的影响※制剂工艺设计和选择应充分考虑工业化放大生产的可行性※注意考察工艺各环节对产品质量的影响,确定制备工艺关键环节,建立相应的质控参数工艺变更:--技术转移/产地转移--设备变更/参数变更汇总研发过程中代表性批次(应包括但不限于临床研究批、中试放大批、生产现场检查批、工艺验证批等)的样品情况,包括:批号、生产时间及地点、批规模、用途(如用于稳定性试验,用于生物等效性试验等)、分析结果(例如有关物质、溶出度以及其他主要质量指标)。
示例如下:批分析汇总3.2.P.2.4 包装材料/容器(1)包材类型、来源及相关证明文件:注1:关于包材类型,需写明结构材料、规格等。
例如,五层共挤膜输液袋,规格为内层:改性乙烯/丙烯聚合物,第二层:聚乙烯,第三层:聚乙烯,第四层:乙烯甲基丙烯酸酯聚合物,第五层:多酯共聚物;聚丙烯输液瓶,规格为250ml;铝塑泡罩包装,组成为:3.2.PVC/铝、3.2.PVC/3.2.PE/3.2.PVDC/铝、3.2.PVC/3.2.PVDC/铝;复合膜袋包装,组成为:聚酯/铝/聚乙烯复合膜袋、聚酯/低密度聚乙烯复合膜袋。
注2:表中的配件一栏应包括所有使用的直接接触药品的包材配件。
如:塑料输液容器用组合盖、塑料输液容器用接口等。
提供包材的检验报告(可来自包材生产商或供应商)。
(2)阐述包材的选择依据。
(3)描述针对所选用包材进行的支持性研究。
在常规制剂稳定性考察基础上,需考虑必要的相容性研究,特别是含有有机溶剂的液体制剂或半固体制剂。
一方面可以根据迁移试验结果,考察包装材料中的成分(尤其是包材的添加剂成分)是否会渗出至药品中,引起产品质量的变化;另一方面可以根据吸附试验结果,考察是否会由于包材的吸附/渗出而导致药品浓度的改变、产生沉淀等,从而引起安全性担忧。
3.2.P.2.5 相容性提供研究资料说明制剂和附带溶剂或者给药装置的相容性。
3.2.P.3 生产3.2.P.3.1生产商生产商的名称(一定要写全称)、地址、电话、传真以及生产场所的地址、电话、传真等。
3.2.P.3.2批处方以表格的方式列出生产规模产品的批处方组成,列明各成份执行的标准。
如有过量加入的情况需给予说明并论证合理性。
对于处方中用到但最终需去除的溶剂也应列出。
3.2.P.3.3 生产工艺和工艺控制(1)工艺流程图:以单元操作为依据,提供完整、直观、简洁的工艺流程图,其中应涵盖工艺步骤,各物料的加入顺序,指出关键步骤以及进行中间体检测的环节。
(2)工艺描述:以注册批为代表, 按单元操作过程描述工艺(包括包装步骤),明确操作流程、工艺参数和范围。
在描述各单元操作时,应结合不同剂型的特点关注各关键步骤与参数。
如大输液品种的原辅料的预处理、直接接触药品的内包装材料等的清洗、灭菌、去热原等;原辅料的投料量(投料比),配液的方式、温度和时间,各环节溶液的pH 值范围;活性炭的处理、用量,吸附时浓度、温度、搅拌或混合方式、速度和时间;初滤及精滤的滤材种类和孔径、过滤方式、滤液的温度与流速;中间体质控的检测项目及限度,药液允许的放置时间;灌装时药液的流速,压塞的压力;灭菌温度、灭菌时间和目标F0值。
生产工艺表述的详略程度应能使本专业的技术人员根据申报的生产工艺可以完整地重复生产过程,并制得符合标准的产品。
Eg:(3)主要的生产设备:如输液制剂生产中的灭菌柜型号、生产厂、关键技术参数;轧盖机类型、生产厂、关键技术参数;过滤滤器的种类和孔径;配液、灌装容器规格等。
(4)拟定的大生产规模:例如对于口服制剂而言,大生产规模不得超过注册批生产规模的十倍。
3.2.P.3.4 关键步骤和中间体的控制列出所有关键步骤及其工艺参数控制范围。
提供研究结果支持关键步骤确定的合理性以及工艺参数控制范围的合理性。
列出中间体的质量控制标准,包括项目、方法和限度,并提供必要的方法学验证资料。
3.2.P.3.5 工艺验证和评价对无菌制剂和采用特殊工艺的制剂提供工艺验证资料,包括工艺验证方案和验证报告,工艺必须在预定的参数范围内进行。
工艺验证内容包括:批号;批量;设备的选择和评估;工艺条件/工艺参数及工艺参数的可接受范围;分析方法;抽样方法及计划;工艺步骤的评估;可能影响产品质量的工艺步骤及可接受的操作范围等。
研究中可采取挑战试验(参数接近可接受限度)验证工艺的可行性。
其余制剂可提交上述资料,也可在申报时仅提供工艺验证方案和批生产记录样稿,但应同时提交上市后对前三批商业生产批进行验证的承诺书。
验证方案、验证报告、批生产纪录等应有编号及版本号,且应由合适人员(例如QA、QC、质量及生产负责人等)签署。
3.2.P.4 原辅料的控制提供原辅料的来源、相关证明文件以及执行标准。
如所用原辅料系在已上市原辅料基础上根据制剂给药途径的需要精制而得,例如精制为注射给药途径用,需提供精制工艺选择依据、详细的精制工艺及其验证资料、精制前后的质量对比研究资料、精制产品的注射用内控标准及其起草依据。
如制剂生产商对原料药、辅料制定了内控标准,应分别提供制剂生产商的内控标准以及原料药/辅料生产商的质量标准。
提供原料药、辅料生产商的检验报告以及制剂生产商对所用原料药、辅料的检验报告。
3.2.P.5 制剂的质量控制3.2.P.5.1质量标准按下述表格方式提供质量标准。
如具有放行标准和货架期标准,应分别进行说明。
Eg:某滴眼液的质量标准3.2.P.5.2 分析方法列明质量标准中各项目的检查方法。
包括项目、检查方法,具体实验操作,如供试品、对照品、流动相、系统适应性溶液等的配置方法,色谱条件,如色谱柱(型号)、柱长、内径、填料粒径、柱温、流速、检测器、检测波长、运行时间、系统适用性、进样体积、计算公式等。
列明研究但未定入质量标准中项目的检查方法。
例1:项目:杂质检查(3.2.P.5.2.X)检查方法:HPLC法试验条件:C18(型号,长25cm,内径4.6mm,填料粒径5µm)UV检测器(检测波长220nm)柱温:50℃流动相:含三乙胺pH磷酸缓冲液/乙腈/四氢呋喃(9:6:1)流速:1ml/min运行时间:40min具体试验操作:整个实验过程的sop取本品(约相当于活性成分12mg),加乙酸乙酯:正己烷(3:1)20ml,振荡10min,离心;取上清液10ml,减压挥干溶剂;残留物加入流动相5ml溶解得供试品溶液。
精密量取供试品溶液1.0ml置于100ml 量瓶,加流动相稀释至刻度,摇匀,作为对照溶液。
精密量取对照溶液20µl注入液相色谱仪,调节检测灵敏度,使主成分的峰高约为记录仪满刻度的10~20%;在风别量取供试品溶液和对照溶液个20µl,分别注入液相色谱仪,色谱图记录至40min;对照溶液中主峰面积At,供试品溶液中各杂质的峰面积Ai均通过自动积分法测定,以各杂质峰面积与对照溶液主峰面积的比值计算得出各杂质的含量,总杂质为各杂质的和。
