广东省医疗机构基本用药供应目录管理指南
广东省基本医疗保险用药管理暂行办法

广东省基本医疗保险用药管理暂行办法(征求意见稿)第一章总则第一条为保障我省参保人员基本用药需求,提升基本医疗保险用药科学化、精细化管理水平,提高基本医疗保险基金使用效益,推进治理体系和治理能力现代化,依据《中华人民共和国社会保险法》等法律法规和《中共中央国务院关于深化医疗保障制度改革的意见》(中发〔2020〕5号)、《基本医疗保险用药管理暂行办法》(国家医疗保障局令第1号),制定本暂行办法。
第二条广东省范围内各级医疗保障部门对基本医疗保险用药范围的确定、调整,以及基本医疗保险用药的支付、管理和监督等,适用本办法。
第三条根据国家的规定,广东省基本医疗保险用药范围通过制定《广东省基本医疗保险药品目录》(以下简称《药品目录》)进行管理,符合《药品目录》的药品费用,按照国家、省的规定由基本医疗保险基金支付。
《药品目录》实行通用名管理,《药品目录》内药品的同通用名药品自动属于基本医疗保险基金支付范围。
第四条基本医疗保险用药管理坚持以人民为中心的发展思想,切实保障参保人员合理的用药需求;坚持“保基本”的功能定位,既尽力而为,又量力而行,用药保障水平与基本医疗保险基金和参保人承受能力相适应;坚持分级管理,明确各层级职责和权限;坚持专家评审,适应临床技术进步,实现科学、规范、精细、动态管理;坚持中西药并重,充分发挥中药和西药各自优势。
第五条《药品目录》由凡例、西药、中成药、协议期内的国家谈判药品、中药饮片、医院制剂六部分组成。
广东省医疗保障行政部门按国家规定增补的药品单列。
为维护临床用药安全和提高基本医疗保险基金使用效益,《国家基本医疗保险药品目录》内药品限定医保支付条件的,从其规定。
第六条广东省医疗保障行政部门负责广东省内的基本医疗保险用药管理,制定本省基本医疗保险用药管理政策措施,负责《药品目录》的监督实施等工作。
广东省医疗保障行政部门以国家《基本医疗保险药品目录》为基础,按照国家规定的调整权限和程序将符合条件的民族药、医院制剂、中药饮片纳入广东省医保支付范围,按规定向国家医疗保障行政部门备案后实施。
广东省2024年版基本药物增补品种目录及说明

广东省2024年版基本药物增补品种书目及说明一、书目的构成《增补品种书目》中的药品包括化学药品和生物制品、中成药2部分。
二、书目的编排除在“备注”一栏标有“注释”的药品外,化学药品和生物制品、中成药按药品品种编号,药品编号的先后次序无特殊的涵义。
三、书目的分类化学药品和生物制品主要依据临床药理学分类,共120 个品种;中成药主要依据功能分类,共124 个品种。
临床各科医师依据病情用药,不受《增补品种书目》分类的限制。
四、书目中品种的名称除在“备注”一栏标有“注释”的药品外,化学药品和生物制品名称采纳中文通用名称和英文国际非专利药名称(InternationalNonproprietary Names,INN)中表达的化学成分的部分,剂型单列。
除个别药品明确酸根和盐基外,其他主要化学成分部分与《增补品种书目》中的名称一样且剂型相同,而不同酸根或不同盐基的化学药品,均属于《增补品种书目》的药品;中成药采纳药品通用名称。
五、书目中品种的剂型化学药品和生物制品剂型在《中华人民共和国药典》(2024 年版)“制剂通则”规定的基础上进行归类处理,未归类的剂型以《增补品种书目》标注的为准。
化学药品和生物制品中的口服常释剂型包括口服一般片剂、肠溶片、分散片,硬胶囊、肠溶胶囊、软胶囊(胶丸);缓释控释剂型包括缓释片、控释片,缓释胶囊、控释胶囊;外用软膏剂型包括软膏剂、乳膏剂;注射剂包括注射液、注射用无菌粉末、注射用浓溶液。
剂型编排的先后次序无特殊的涵义。
中成药的剂型不单列,以“药品名称”栏中标注的为准。
六、对备注栏的说明(一)化学药品和生物制品注释1:书目第1 号“阿莫西林”,限儿童及吞咽困难者。
注释2:书目第3 号“哌拉西林舒巴坦”,限重度感染者。
注释3:书目第22号“缓解感冒症状的复方OTC制剂”详见下表:注释4:书目第38 号“厄贝沙坦”,限对血管惊慌素转换酶抑制剂治疗不能耐受的患者。
注释5:书目第39 号“缬沙坦”,限对血管惊慌素转换酶抑制剂治疗不能耐受的患者。
2020年《广东省基本医疗保险、工伤保险和生育保险药品目录(版)》-凡例

凡例《广东省基本医疗保险、工伤保险和生育保险药品目录》(2019年版)(简称《药品目录》)是基本医疗保险和生育保险基金支付药品费用的标准。
临床医师根据病情开具处方、参保人员购买与使用药品不受《药品目录》的限制。
工伤保险基金支付药品费用范围参照本目录执行。
凡例是对《药品目录》中药品的分类与编号、名称与剂型、备注等内容的解释和说明,是《药品目录》的组成部分,其内容与目录正文具有同等政策约束力。
一、目录构成(一)《药品目录》西药部分、中成药部分、协议期内谈判药品部分、中药饮片部分和医院制剂部分所列药品为基本医疗保险、工伤保险和生育保险基金准予支付费用的药品。
(二)《药品目录》共有西药和中成药2934个,其中西药部分1425个,中成药部分1461个(含民族药97个),协议期内谈判药品部分48个(含西药43个、中成药5个)。
西药、中成药和协议期内谈判药品分甲乙类管理,西药甲类药品398个,中成药甲类药品242个,其余为乙类药品。
协议期内谈判药品按照乙类药品支付。
(三)中药饮片部分共有药品1157个,按照乙类药品支付。
(四)医院制剂部分1411个(含西药238个,中成药1173个),按照乙类药品支付。
(五)《药品目录》包括限工伤保险基金准予支付费用的品种14个;限生育保险基金准予支付费用的品种5个。
工伤保险和生育保险支付药品费用时不区分甲、乙类。
二、编排与分类(六)药品分类上西药品种主要依据解剖-治疗-化学分类(ATC),中成药主要依据功能主治分类,中药饮片按中文笔画数排序。
临床具有多种治疗用途的药品,选择其主要治疗用途分类。
临床医师依据病情用药,不受《药品目录》分类的限制。
(七)西药、中成药、协议期内谈判药品分别按药品品种编号。
同一品种只编一个号,重复出现时标注“★”,并在括号内标注该品种编号。
药品排列顺序及编号的先后次序无特别含义。
三、名称与剂型(八)除在“备注”一栏标有“◇”的药品外,西药名称采用中文通用名,未包括命名中的盐基、酸根部分,剂型单列。
广东省基本医疗保险门诊统筹用药范围
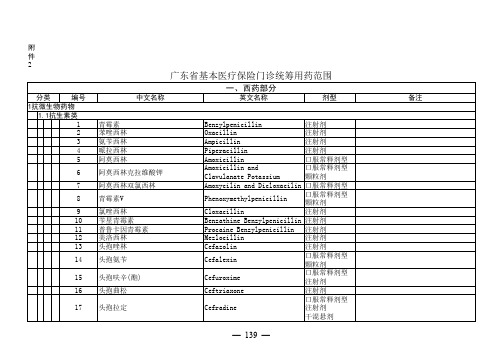
附件2
复方倍他米松
编号中文名称英文名称剂型备注分类
374吲达帕胺Indapamide 口服常释剂型缓释控释剂型
375硝苯地平Nifedipine 口服常释剂型缓释控释剂型
376维拉帕米Verapamil 口服常释剂型缓释控释剂型注射剂
377尼群地平Nitrendipine口服常释剂型378氨氯地平Amlodipine口服常释剂型
379地尔硫 Diltiazem 口服常释剂型缓释控释剂型注射剂
380非洛地平Felodipine 口服常释剂型缓释控释剂型
381拉西地平Lacidipine口服常释剂型382贝尼地平Benidipine口服常释剂型383普萘洛尔Propranolol口服常释剂型384阿替洛尔Atenolol口服常释剂型
385美托洛尔Metoprolol 口服常释剂型缓释控释剂型注射剂
386比索洛尔Bisoprolol口服常释剂型387索他洛尔Sotalol口服常释剂型388酚妥拉明Phentolamine注射剂
389哌唑嗪Prazosin口服常释剂型
390利血平Reserpine 口服常释剂型注射剂
391酚苄明Phenoxybenzamine 口服常释剂型注射剂
392甲基多巴Methyldopa口服常释剂型393可乐定Clonidine口服常释剂型
鱼肝油酸钠。
广东省医疗机构基本用药供应目录管理指南

广东省医疗机构基本用药供应目录管理指南根据《医疗机构药事管理规定》(卫医政发[2 011] 11号)、《处方管理办法》(卫生部[2007]第53号令)、《医疗机构药品集中采购工作规范》(卫规财发[2010] 64号)、《广东省医疗机构药品阳光采购实施方案》(粤纠医药办[2009]3号)及《广东省医疗机构药品阳光采购医疗机构药品遴选实施办法(试行)》(粤纠医药办[2009]9号)等药物政策法规的要求,为加强我省医疗机构基本用药供应目录的规范管理,建立透明和受到监督的药品遴选和定期调整、动态管理制度,优化新药引进、品种增补及替换、淘汰机制,确保药品购销行为的合法性和规范性,特提出如下贯彻意见,请遵照执行。
一、建立基本用药供应目录管理机构基本用药供应目录管理是指医疗机构应当根据临床需要,建立基本用药供应目录的遴选和定期调整、动态管理制度,包括对供应目录的周期性调整及新药引进、品种增补和替换、淘汰制度。
在基本用药供应目录使用周期中,在保持目录相对稳定的基础上,由药事管理与药物治疗学委员会和纪检监察部门监控药品临床使用情况,监测、评价药物治疗的疗效,分析、评估用药安全性,并进一步根据监测评价的结果、相关政策及临床科室和药学部门的建议,实行基本用药供应目录的定期调整和动态管理。
原则上每一个药品采购周期对目录进行一次全面审核和调整。
医疗机构药事管理与药物治疗学委员会主要由具有高级专业技术职务任职资格的药学、临床医学、临床微生物学、护理学、医院感染管理等相关专业高级技术职务任职资格的人员,及药学、医务、护理等部门负责人组成,负责本机构基本用药供应目录的遴选和管理工作。
其日常工作由药学部门负责。
医疗机构药事管理与药物治疗学委员会的职责是:1、贯彻执行医疗卫生及药事管理等有关法律、法规和规章。
审核制定本机构药事管理和药学工作规章制度,并监督实施;2、根据国家及省《基本药物目录》、《处方管理办法》、《中国国家处方集》、《药品采购供应质量管理规范》等,制订本机构《药品处方集》、《基本用药供应目录》(含抗菌药物供应目录);3、建立新药引进和药品遴选制度,审核本机构临床科室的新药申请,调整药品品种或者配送企业或供应商,审核医院制剂申报等事宜;4、建立规范的药品使用和管理制度。
广东省基本医疗保险、工伤保险和生育保险药品目录门诊部分
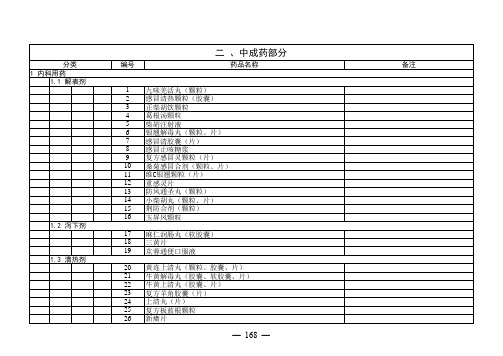
编号药品名称备注分类
143活心丸
144冠心苏合丸(胶囊、软胶囊)
145速效救心丸
146地奥心血康胶囊(软胶囊)
147银杏叶口服制剂同《药品目录》中成药部分第496号★(147)银杏叶注射制剂同《药品目录》中成药部分★(496)号148银杏酮酯分散片(滴丸)
149杏灵滴丸
150通心络胶囊
151灯盏花素片
152毛冬青胶囊
153星瑙灵片
154脑栓通胶囊
155脑络通胶囊
156脑栓康复胶囊
157大黄 虫丸(胶囊)
158复方鳖甲软肝片
159心脑联通胶囊
160脑心通胶囊
161前列倍喜胶囊
1.12 理气剂
162丹栀逍遥丸
163逍遥丸(颗粒)
164柴胡舒肝丸
165加味逍遥丸
166木香顺气颗粒
167四逆散
168越鞠丸
169气滞胃痛颗粒(片)
170胃苏颗粒
171胃乃安胶囊。
自己整理的广东基药目录汇总

Noradrenaline Isoprenaline Metaraminol Dopamine Dobutamine Simvastatin Fenofibrate
Bromhexine Ambroxol Chymotrypsin Carbocisteine Pentoxyverine Compound Liquorice
Amantadine Benzhexol Levodopa Neostigmine Neostigmine Bromide Carbamazepine Sodium Valproate Phenytoin Sodium Phenobarbital
(四)脑血管病用药及降颅压药 61 尼莫地平 Nimodipine 62 麦角胺咖啡因 Ergotamine and Caffeine
97 去甲肾上腺素 98 异丙肾上腺素 99 间羟胺 100 多巴胺 101 多巴酚丁胺 (六)调脂及抗动脉粥样硬化药 102 辛伐他汀 省35 非诺贝特 八、呼吸系统用药 (一)祛痰药 103 溴己新 104 氨溴索 省44 糜蛋白酶 省45 羧甲司坦 (二)镇咳药 105 喷托维林 106 复方甘草 (三)平喘药 107 沙丁胺醇 108 氨茶碱 109 茶碱 省40 茶碱麻黄碱 省41 异丙托溴铵 省42 沙丁胺醇 省43 复方茶碱 九、消化系统用药 (一)抗酸药及抗溃疡病药 110 复方氢氧化铝
(二)抗焦虑药 71 艾司唑仑 (三)抗抑郁药 72 阿米替林 73 多塞平 七、心血管系统用药 (一)抗心绞痛药 74 75 硝酸甘油 硝酸异山梨酯
Nitroglycerin Isosorbide Dinitrate Nifedipine Nitroglycerin Isosorbide Mononitrate
《广东省基本医疗保险、工伤保险和生育保险药品目录(2019年版)》-凡例

凡例《广东省基本医疗保险、工伤保险和生育保险药品目录》(2019年版)(简称《药品目录》)是基本医疗保险和生育保险基金支付药品费用的标准。
临床医师根据病情开具处方、参保人员购买与使用药品不受《药品目录》的限制。
工伤保险基金支付药品费用范围参照本目录执行。
凡例是对《药品目录》中药品的分类与编号、名称与剂型、备注等内容的解释和说明,是《药品目录》的组成部分,其内容与目录正文具有同等政策约束力。
一、目录构成(一)《药品目录》西药部分、中成药部分、协议期内谈判药品部分、中药饮片部分和医院制剂部分所列药品为基本医疗保险、工伤保险和生育保险基金准予支付费用的药品。
(二)《药品目录》共有西药和中成药2934个,其中西药部分1425个,中成药部分1461个(含民族药97个),协议期内谈判药品部分48个(含西药43个、中成药5个)。
西药、中成药和协议期内谈判药品分甲乙类管理,西药甲类药品398个,中成药甲类药品242个,其余为乙类药品。
协议期内谈判药品按照乙类药品支付。
(三)中药饮片部分共有药品1157个,按照乙类药品支付。
(四)医院制剂部分1411个(含西药238个,中成药1173个),按照乙类药品支付。
(五)《药品目录》包括限工伤保险基金准予支付费用的品种14个;限生育保险基金准予支付费用的品种5个。
工伤保险和生育保险支付药品费用时不区分甲、乙类。
二、编排与分类(六)药品分类上西药品种主要依据解剖-治疗-化学分类(ATC),中成药主要依据功能主治分类,中药饮片按中文笔画数排序。
临床具有多种治疗用途的药品,选择其主要治疗用途分类。
临床医师依据病情用药,不受《药品目录》分类的限制。
(七)西药、中成药、协议期内谈判药品分别按药品品种编号。
同一品种只编一个号,重复出现时标注“★”,并在括号内标注该品种编号。
药品排列顺序及编号的先后次序无特别含义。
三、名称与剂型(八)除在“备注”一栏标有“◇”的药品外,西药名称采用中文通用名,未包括命名中的盐基、酸根部分,剂型单列。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
广东省医疗机构基本用药供应目录管理指南根据《医疗机构药事管理规定》(卫医政发[2 011] 11号)、《处方管理办法》(卫生部[2007]第53号令)、《医疗机构药品集中采购工作规范》(卫规财发[2010] 64号)、《广东省医疗机构药品阳光采购实施方案》(粤纠医药办[2009]3号)及《广东省医疗机构药品阳光采购医疗机构药品遴选实施办法(试行)》(粤纠医药办[2009]9号)等药物政策法规的要求,为加强我省医疗机构基本用药供应目录的规范管理,建立透明和受到监督的药品遴选和定期调整、动态管理制度,优化新药引进、品种增补及替换、淘汰机制,确保药品购销行为的合法性和规范性,特提出如下贯彻意见,请遵照执行。
一、建立基本用药供应目录管理机构基本用药供应目录管理是指医疗机构应当根据临床需要,建立基本用药供应目录的遴选和定期调整、动态管理制度,包括对供应目录的周期性调整及新药引进、品种增补和替换、淘汰制度。
在基本用药供应目录使用周期中,在保持目录相对稳定的基础上,由药事管理与药物治疗学委员会和纪检监察部门监控药品临床使用情况,监测、评价药物治疗的疗效,分析、评估用药安全性,并进一步根据监测评价的结果、相关政策及临床科室和药学部门的建议,实行基本用药供应目录的定期调整和动态管理。
原则上每一个药品采购周期对目录进行一次全面审核和调整。
医疗机构药事管理与药物治疗学委员会主要由具有高级专业技术职务任职资格的药学、临床医学、临床微生物学、护理学、医院感染管理等相关专业高级技术职务任职资格的人员,及药学、医务、护理等部门负责人组成,负责本机构基本用药供应目录的遴选和管理工作。
其日常工作由药学部门负责。
医疗机构药事管理与药物治疗学委员会的职责是:1、贯彻执行医疗卫生及药事管理等有关法律、法规和规章。
审核制定本机构药事管理和药学工作规章制度,并监督实施;2、根据国家及省《基本药物目录》、《处方管理办法》、《中国国家处方集》、《药品采购供应质量管理规范》等,制订本机构《药品处方集》、《基本用药供应目录》(含抗菌药物供应目录);3、建立新药引进和药品遴选制度,审核本机构临床科室的新药申请,调整药品品种或者配送企业或供应商,审核医院制剂申报等事宜;4、建立规范的药品使用和管理制度。
按照国家药物政策和法律、法规,建立规章制度和技术操作规程,监督、指导麻醉药品、精神药品、医疗用毒性药品及放射性药品和高危药品的临床使用与规范管理;5、推动建立本机构的药物治疗相关的临床诊疗指南和药物临床应用指南。
根据本机构基本用药目录和国家药物政策及各类药钧临床应用指导原则,组织制定并监督实施本机构“药物临床应用管理办法”、“抗菌药物临床应用指南”、“糖皮质激素类药物临床应用指南”、“中成药临床应用指南”等。
建立抗菌药物临床使用分级管理制度。
6、建立临床用药安全监管制度。
建立临床用药监测、处方点评制度,实行药品用量动态监测和超常预警制度,对本机构药物临床使用的安全性、有效性和经济性进行监测、分析和评价,提出干预和改进措施,指导临床合理用药;7、建立药物不良反应监测报告制度,分析、评估用药风险和药物不良反应、药品损害事件,提供咨询与指导;8、对医务人员进行有关药事管理法律法规、规章制度和合理用药知识教育培训,向公众宣传安全用药知识。
二、建立基本用药供应目录遴选制度(一)建立基本用药供应目录遴选专家库在医院药事管理与药物治疗学委员会名下成立基本用药供应目录遴选专家库,负责药品目录的遴选、审核,以及新药引进、品种增补和替换、淘汰的评审工作。
基本用药目录遴选专家库原则上由副高以上职称,长期在医疗一线工作的药学(含药理学)、临床医学、临床检验、临床微生物、医院感染管理、护理学等专业人员组成,三级综合医院150人以上,专科医院和二级综合医院50人以上,一级医院和社区卫生服务中心、乡镇卫生院的专家库人数由当地卫生行政部门确定。
二级以上医院应根据临床专科或系统(心血管、呼吸、肾脏、脑神经、消化和肝脏、骨骼肌肉、眼耳鼻喉)用药,儿童、孕产妇用药及感染性疾病用药等成立各“专科用药小组”,对专科用药目录的遴选、审核、使用、新药引迸、增补、品种更换或淘汰等提出建议,制订临床用药指引。
(二)成立药品采购监督委员会负责对医疗机构基本用药供应目录的遴选、审核、新药引进、药品采购全过程实施监督管理。
药品采购监督委员会由纪检监察、财务、审计、医学、药学等相关人员组成,三级综合医院30人以上,其它医院原则上10人以上。
当医疗机构遴选基本用药供应目录或新药引进评审时,抽派药品采购监督委员会的代表参加,负责对基本用药供应目录遴选及新药引进全过程进行监督。
药品采购监督委员会成员与基本用药目录遴选专家库人员原则上不交叉重复。
(三)遴选专家参加遴选和审核的专家应在医疗机构基本用药供应目录遴选专家库中以随机方式临时抽取产生,按药品类别或“专科用药小组”分别遴选。
三级综合医院每次参加基本用药供应目录遴选的专家应当在75人以上,每专业组的专家人数不少于15人;专科医院和二级综合医院每次参加遴选的专家应当在25人以上,每专业组的专家人数不少于10人。
其他医院每组的专家人数不少于11人。
被抽中的遴选专家按照组别,必须在统一时间、统一地点集中投票,不得分散进行。
遴选会议开始后,除大会集中、统一的药品临床应用情况报告和公开讨论,投票过程药品遴选专家不能交流与具体品种有关的任何内容。
药品采购监督委员会成员全程参与监督。
(四)基奉用药供应目录的遴选原则1、医疗机构要建立基本用药供应目录,保证临床用药安全有效。
2、各医疗机构要按照防治必需、安全有效、价格合理、使用方便、临床首选的原则,结合本机构的诊疗科目、用药特点,合理确定基本用药供应目录中药品品种、剂型和数量,做到品种齐全,比例恰当。
3、各医疗机构建立目录遴选、周期性审核调整、新药引进、品种增补和替换、淘汰的原则、范围、方法和程序,并形成制度和规范。
4、基本用药供应目录的品规数应按规定控制在合理范围:三级综合医院原则上不超过1500种,三级专科医院原则上不超过1200种,二级综合医院原则上不超过1 000种,二级专科医院原则上不超过800种,其他医疗机构原则上不超过600种。
5、医疗机构基本用药供应目录的调整应严格执行卫生部令第53号《处方管理办法》中第四章第16条的规定:“同一通用名称药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1—2种。
因特殊诊疗需要使用其他剂型和剂量规格药品的情况除外”。
医疗机构抗菌药物供应目录(包括抗菌药物的品种、剂型和规格)按照国家和省卫生厅有关政策规范制订。
6、医院的药品遴选工作,原则上从广东省药品集中采购挂网目录中遴选,优先选择国家和省市医保药品目录和基本药物目录中药品。
7、医疗机构的基本用药应当由药学部门统一采购供应,临床上不得使用非药学部门采购供应的药物。
三、建立基本用药目录定期调整和动态管理制度各医疗机构应建立新药引进、品种增补和替换、淘汰的原则和规范。
(一)药品增补和新药引进1、药品增补指的是医疗机构根据临床需要,增加基本用药供应目录以外的药品。
新药引进指的是医院引进没有使用过的药品,包括通用名、剂型和规格等,且具有临床无可替代性。
2、医疗机构要建立规范的新药引进、品种增补制度,建立公开、透明的工作流程或指引,提供方便的申请表格下载,定期召开药事管理与药物治疗学委员会会议。
3、确定药品增补和新药引进评审原则:(1)符合本医疗机构关于药品增补和新药引进的原则要求;(2)最大限度满足临床用药需求;(3)严格执行《处方管理办法》的有关规定,新药引进原则上不超过“一品两规”。
如有特殊临床需求,须经过医疗机构药事管理与药物治疗学委员会讨论决定增补。
有多种剂型和规格时,优先考虑临床常用剂型和规格,兼顾特殊人群用药(老人、孕妇、儿童)安全性;(4)同等情况下,优先考虑已进入基本药物目录、医保目录的产品。
涉及同类或同种药品的比较,应综合考虑药品安全质量、坐产企业规模、价格、品牌等因素。
4、药品增补和新药引进程序。
(1)各药品生产、流通企业、临床科室或个人可以根据临床需要向医疗机构药事管理部门提交申请,并提交增补药品和引进新药的资料,包括新药证书、生产批件、质量标准、价格批文和药品挂网信息、药品说明书、药品介绍、生产经营企业证照等资料(参见附录1)。
药学部门应接受所有新药申请。
(2)所有药品增补或新药申请必须征询医疗机构临床科室意见。
临床科室主任组织集体讨论,填写《新药申请表》(参见附录2),同时附科室讨论的集体签名及廉洁承诺书。
(3)药事管理部门或其临床药学科应客观、公正地评估所有新药申请,要根据临床科室提供的新药申请、入围情况、在用同类品种情况、循证医学和药物经济学等资料编写“新药申请评估报告”。
(4)药事管理与药物治疗学委员会召开有关会议,讨论所有新药申请资料,审核《新药申请表》和药学部门的“新药申请评估报告”,集体决定哪些申请提请新药引进评审专家会议审议。
(5)药事管理与药物治疗学委员会组织召开新药引进评审专家会议。
与会专家从药品遴选专家库中随机抽取,每次会议不少于15名。
讨论并对申请目录中的新药逐一进行实名制投票。
赞成票至少超过有效票数50%(不含50%)者视为该药通过最后审议,决定可纳入医疗机构基本用药供应目录。
会议实名制投票,讨论结果一式两份,集体签名,由监察部门和医疗机构药事管理和药物治疗学委员会秘书处分别保存。
(6)通过审议的药品由药学部整理,报医疗机构药事管理和药物治疗学委员会主任委员审批签字后纳入医疗机构基本用药供应目录。
5、审议通过的药品由药学部门限期执行采购,并交付所有药房使用。
药学部门必须按照《药品采购供应质量管理规范》,采取有效措施,保持药品的连续供应,保障临床用药。
6、遴选结果必须予以公开,公开形式由各医疗机构根据实际情况自行选择。
(二)品种替换药品生产厂家或经销商因各种原因不能向医疗机构正常供应基本用药目录中的药品时,原则上不得替换,特别是本机构现有基本用药供应目录已有同类或相类似作用的品种、中成药和辅助性药物泡括能量及营养成分补充药物、免疫增强剂、脑循环与促智药、活血化瘀类药物、抗肿瘤辅助药等)。
医疗机构确因临床需要,需替换不能正常供应的基本用药目录中药品的厂家、剂型或包装规格时,由药事管理部门提出申请,列出所有可供货的候选品种,注明是否入围等情况,由药事管理与药物治疗学委员会主任书面批准后方可临时购买。
基本用药目录中药品恢复供应时,应停止替换。
品种替换必须报医院药事管理与治疗学委员会审核。
长期替换必须经新药引进评审专家会议投票决定。
替换基本用药目录中正常供应的在用药品的厂家、剂型或包装规格时,按药品增补和新药引进程序执行。
