微生物检验原始记录(平板计数法)
平板菌落计数法水中微生物的检测

2、由于细菌易吸附玻璃器皿表面,菌液加入后应 尽快倒培养基,立即摇匀;
3、倾注平板时的培养基温度冷却至45℃左右。 4、计数时,30―300个菌落的稀释度计算每毫升
的菌数最为合适 5、同一稀释度的三个重复的菌数不能相差很悬殊
菌落计数方法及原则:
1)若只有一个稀释度的平均菌落数在30-300范围 时,则将该菌落数乘以稀释倍数报告之。
2)若有两个稀释度,其生长的菌落数均在 30~300之间,则视二者之比值来决定,若 其比值小于2应报告两者的平均数。若大于 或等于2则报告其中较小的菌落总数。
3)若所有稀释度的平均菌落数均大于300, 则应按稀释度最高的平均菌落数乘以稀释 倍数报告之
水中细菌总数的测定
——平板菌落计数法
一、细菌总数测定的意义
水中细菌总数往往同水中有机物污染的程度呈 正相关,它是评价水质污染程度重要指标之一
细菌总数:指水样在一定条件下培养后,1mL水样 所含菌落的总数。
我国生活饮用水标准(GB5749-85)规定,细 菌总数不得超过100个/ml
含细菌10-100个/ml的水体为极清洁
代表性:多采几个部位,液体样品需经过震摇,以 获得均匀稀释液。
2 水样的10倍稀释
第一步 稀释 水样 第二步: 接种平板
注意:稀释 度的选择
平板混合分离法: 将菌液分离样品摇匀,用无菌移液管取1 ml的
菌液移至无菌培养皿中,然后将融化,凉至45℃ 左右的培养基,在每个培养皿内各倒入约15 ml, 摇匀,凝固,制成平板。
4)若所有稀释度的平均菌落数均小于30, 则应以按稀释度最低的平均菌落数乘以稀 释倍数报告之
微生物学 实验三 平板菌落计数法

微生物学实验三平板菌落计数法微生物学实验三平板菌落计数法微生物学实验三平板菌落计数法实验三平板菌落计数学习菌种的平板菌落计数的基本原理和方法。
平板菌落计数法就是将试样样品经适度吸收之后,其中的微生物充份集中成单个细胞,挑一定量的吸收样液注射至平板上,经过培育,由每个单细胞生长产卵而构成肉眼可知的菌落,即为一个单菌落应当代表原样品中的一个单细胞。
统计数据菌落数,根据其吸收倍数和采样注射量即可折算出来样品中的含菌数。
但是,由于试样样品往往难于全然集中成单个细胞,所以,孵出的一个单菌落也可能将源自样品中的2~3或更多个细胞。
因此平板菌落计数的结果往往相对较低,为了确切地阐释平板菌落计数的结果,现在已女性主义采用菌落形成单位(colony-formingunits,cfu)而不以绝对菌落数去则表示样品的活菌含量。
平板菌落计数法虽然操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是该计数方法的最大优点是可以获得活菌的信息,所以被广泛用于生物制品检验(如活菌制剂),以及食品、饮料和水(包括水源水)等的含菌指数或污染程度的检测。
1.菌种:大肠杆菌菌悬液。
2.培养基:lb培养基。
3.仪器或其他用具:1ml无菌液体,无菌平皿,器皿4.5ml无菌水的试管,试管架,恒温培养箱等。
取无菌平皿9套,分别用记号笔标明10、10、10(稀释度)各3套,另-1-2-3-4-5挑6支盛存有4.5ml无菌水的试管,依次标是10、10、10、10、10、用1ml无菌吸管吸取1ml已充分混匀的大肠杆菌菌悬液(待测样品),精确地放-10.5ml至10的试管中,此即为10倍吸收。
将多余的菌液送回原菌液中。
-6-4-5-6将10试管置试管振荡器上振荡,使菌液充分混匀。
另取一支1ml吸管插入10试管中来回吹吸菌悬液三次,进一步将菌体分散、混匀。
吹吸菌液时不要太猛太快,吸时吸管伸入管底,吹时离开液面,以免将吸管中的过滤棉花浸湿或使试管内液体外溢。
11金黄色葡萄球菌Baird-Parker平板计数法
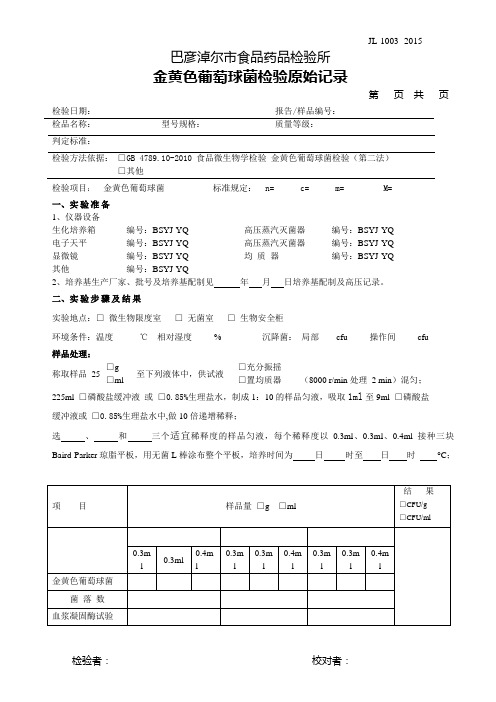
第页共页检验日期:报告/样品编号:检品名称:型号规格:质量等级:判定标准:检验方法依据:□GB 4789.10-2010 食品微生物学检验金黄色葡萄球菌检验(第二法)□其他检验项目:金黄色葡萄球菌标准规定:n= c= m= M=一、实验准备1、仪器设备生化培养箱编号:BSYJ-YQ- 高压蒸汽灭菌器编号:BSYJ-YQ-电子天平编号:BSYJ-YQ- 高压蒸汽灭菌器编号:BSYJ-YQ-显微镜编号:BSYJ-YQ- 均质器编号:BSYJ-YQ-其他编号:BSYJ-YQ-2、培养基生产厂家、批号及培养基配制见年月日培养基配制及高压记录。
二、实验步骤及结果实验地点:□微生物限度室□无菌室□生物安全柜环境条件:温度℃相对湿度% 沉降菌:局部cfu 操作间cfu样品处理:称取样品25□g至下列液体中,供试液□充分振摇(8000 r/min处理 2 min)混匀;□ml □置均质器225ml □磷酸盐缓冲液或□0.85%生理盐水,制成1:10的样品匀液,吸取1ml至9ml □磷酸盐缓冲液或□0.85%生理盐水中,做10倍递增稀释;选、和三个适宜稀释度的样品匀液,每个稀释度以0.3ml、0.3ml、0.4ml接种三块Baird-Parker琼脂平板,用无菌L棒涂布整个平板,培养时间为日时至日时°C;第页共页结果计算公式:T = A B / C dT——样品中金黄色葡萄球菌菌落数;A——某一稀释度典型菌落的总数;B——某一稀释度血浆凝固酶阳性的菌落数;C——某一稀释度用于血浆凝固酶试验的菌落数;d——稀释因子。
结果: n= c= 结论:。
速冻肉制品检验熟品
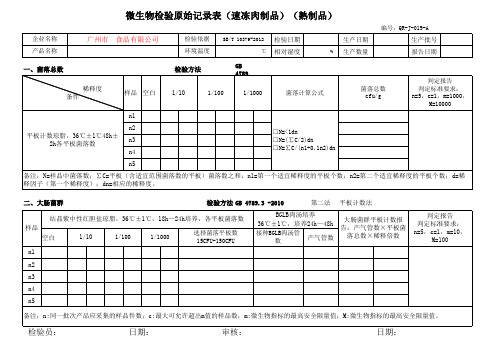
结晶紫中性红胆盐琼脂,36℃±1℃,18h—24h培养,各平板菌落数 样品 空白 n1 n2 n3 n4 n5 1/10
1/100 1/1000 选择菌落平板数 15CFU-150CFU
BGLB肉汤培养 36℃±1℃,培养24h—48h
微生物检验原始记录表(速冻肉制品)(熟制品)
编号:QR-J-019-A
企业名称 产品名称
广州市
食品有限公司
检验依据 环境温度
SB/T 10379-2012 ℃
检验日期 相对湿度
%
ห้องสมุดไป่ตู้
生产日期 生产数量
生产批号
报告日期
一、菌落总数 稀释度 条件
检验方法
GB 4789.2 -2010 菌落总数 cfu/g 判定报告 判定标准要求: n=5,c=1,m=1000, M=10000
样品 空白
1/10
1/100
1/1000
菌落计算公式
n1 n2 平板计数琼脂,36℃±1℃48h± 2h各平板菌落数 n3 n4 n5 备注:N=样品中菌落数;∑C=平板(含适宜范围菌落数的平板)菌落数之和;n1=第一个适宜稀释度的平板个数;n2=第二个适宜稀释度的平板个数;d=稀 释因子(第一个稀释度);dn=相应的稀释度。 二、大肠菌群 检验方法 GB 4789.3 -2010 第二法 平板计数法 判定报告 判定标准要求: n=5,c=1,m=10, M=100
接种BGLB肉汤管 数
大肠菌群平板计数报 告:产气管数×平板菌 落总数×稀释倍数 产气管数
备注:n:同一批次产品应采集的样品件数;c:最大可允许超出m值的样品数;m:微生物指标的最高安全限量值;M:微生物指标的最高安全限量值。
实验四微生物平板菌落计数法

实验四微生物平板菌落计数法一、实验目的学习并掌握平板菌落计数的基本原理和方法。
二、实验原理平板菌落计数法是将待测样品经适当稀释之后,其中的微生物充分分散成单个细胞,取一定量的稀释样液接种到平板上,经过培养,由每个单细胞生长繁殖而形成肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可能来自样品中的2~3或更多个细胞。
因此平板菌落计数的结果往往偏低,为了清楚地阐述平板菌落计数的结果,现在已倾向使用菌落形成单位(cfu)而不以绝对菌落数来表示样品的活菌含量。
平板菌落计数法虽然操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是该计数方法的最大优点是可以获得活菌的信息,所以被广泛用于生物制品检验(如活菌制剂),以及食品、饮料和水(包括水源水)等的含菌指数或污染程度的检测。
三、实验器材1 .菌种:酵母菌。
2 .培养基:YEB培养基。
3 .仪器或其他用具: 1ml 无菌吸管,无菌平皿,盛有无菌水的试管,试管架,恒温培养箱等。
四、实验步骤1 .编号取无菌平皿 9 套,分别用记号笔标明 10-4、 10-5、 10-6(稀释度)各 2 套,另取 6 支盛有无菌水的试管,依次标是 10-1、 10-2、 10-3、 10-4、 10-5、10-6。
2 .稀释用 1ml 无菌吸管吸取 1ml 已充分混匀的大肠杆菌菌悬液(待测样品),精确地放至 10-1的试管中,此即为 10 倍稀释。
将多余的菌液放回原菌液中。
将 10-1试管置试管振荡器上振荡,使菌液充分混匀。
另取一支 1ml 吸管插入 10-1试管中来回吹吸菌悬液三次,进一步将菌体分散、混匀。
吹吸菌液时不要太猛太快,吸时吸管伸入管底,吹时离开液面,以免将吸管中的过滤棉花浸湿或使试管内液体外溢。
用此吸管吸取 10-1菌液 1ml ,精确地放至 10-2试管中,此即为 100 倍稀释。
微生物检测原始记录

微生物检测原始记录一、目的本文档旨在规定微生物检测的原始记录格式和内容,以确保检测过程和结果的准确性和可追溯性。
二、记录格式1、记录纸张:使用A4纸,横向排列,页边距至少留有2cm。
2、记录标题:在页面顶部居中书写“微生物检测原始记录”。
3、日期和实验室名称:在页面右下角书写检测日期和实验室名称。
4、检测样品信息:在页面中部或适当位置填写样品信息,包括样品名称、编号、来源、处理方式等。
5、检测项目和指标:在页面中部或适当位置列出检测项目和指标,如菌落总数、大肠杆菌、沙门氏菌等。
6、检测方法和仪器:在页面中部或适当位置描述检测所采用的方法和使用的仪器设备。
7、检测结果记录:在页面中部或适当位置详细记录每个检测项目的实验数据,并确保数据准确、清晰、可追溯。
8、结论和建议:在页面底部或适当位置总结检测结果,并给出相应建议或处理意见。
9、检测人员签名:在页面右下角或适当位置由检测人员签名,以示负责。
10、备注:根据需要添加其他相关信息,如样品异常情况说明、引用标准、注意事项等。
三、记录内容1、样品信息:样品名称、编号、来源(如生产批次、产地等)、处理方式(如取样、前处理等)。
2、检测项目和指标:根据实际需要确定检测项目和指标,如菌落总数、大肠杆菌、沙门氏菌等微生物指标,以及可能的化学指标等。
3、检测方法:描述微生物检测所采用的方法,如国标法、第三方检测方法等。
同时应注明所用方法的版本号和发布机构。
4、仪器设备:列出在检测过程中使用的所有仪器设备的名称、型号、编号和使用状态等信息。
5、实验数据记录:详细记录每个检测项目的实验数据,包括观察结果、计数结果、吸光度值等。
数据应准确、清晰、可追溯,并附上必要的图表和曲线图。
6、结论和建议:根据检测结果给出相应的结论和建议,如是否符合标准要求,是否需要进一步处理或跟进等。
7、其他信息:根据需要添加其他相关信息,如样品异常情况说明、引用标准、注意事项等。
8、检测人员签名:由检测人员签名,以示负责。
微生物的平板菌落计数法

<实验十三微生物的平板菌落计数法>一、实验目的学习微生物的平板计数法。
二、原理概述微生物的稀释平板计数是根据在固体培养基上所形成的一个菌落,即是由一个单细胞繁殖而成,且肉眼可见的子细胞群体这一生理及培养特征进行的。
也就是说一个菌落即代表一个单细胞。
计数时,首先将待测样品制成均匀的一系列不同稀释液,并尽量使样品中的微生物细胞分散开来,使成单个细胞存在( 否则一个菌落就不只是代表一个菌 ) ,再取一定稀释度、一定量的稀释液接种到平板中,使其均匀分布于平板中的培养基内。
经培养后,由单个细胞生长繁殖形成菌落,统计菌落数目,即可计算出样品中的含菌数。
此法所计算的菌数是培养基上长出来的菌落数,故又称活菌计数,一般用于某些成品检定 ( 如食品等 ) 、生物制品检定、土壤含菌量测定及食品、水源的污染程度的检定。
三、实验器材1 、待测样品、所需各类培养基2 、天平、称样瓶、记号笔、容量瓶、无菌生理盐水、 1ml 和 5ml 无菌移液管、无菌平板、无菌试管四、操作步骤和内容1 、样品稀释液的制备准确称取待测样品 10g 或 10ml ,放入装有 90ml 无菌水并放有小玻璃珠的 250mL 三角瓶中,用手或置摇床上振荡 20min ,使微生物细胞分散,静置约 20-30s ,即成 10 -1 稀释液;再用 1ml 无菌吸管,吸取 10 -1 稀释液 1ml 移入装有 9ml 无菌水的试管中,吹吸 3 次,让菌液混合均匀,即成 10 -2 稀释液;再换一支无菌吸管吸取 10 -2 菌液 1mL 移入装有 9ml 无菌水试管中,即成 10 -3 稀释液;以此类推,一定要每次更换吸管,连续稀释,制成 10 -4 、 10 -5 、 10 -6 、 10 -7 、 10 -8 等一系列稀释度的菌液,供平板计数使用 ( 如图 13 - 1) 。
图 13 - 1 平板计数法中样品的稀释和稀释液的取样用稀释平板计数时,待测菌稀释度的选择应根据样品确定。
实验四微生物平板菌落计数法

实验四微生物平板菌落计数法一、实验目的学习并掌握平板菌落计数的基本原理和方法。
二、实验原理平板菌落计数法是将待测样品经适当稀释之后,其中的微生物充分分散成单个细胞,取一定量的稀释样液接种到平板上,经过培养,由每个单细胞生长繁殖而形成肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可能来自样品中的2〜3或更多个细胞。
因此平板菌落计数的结果往往偏低,为了清楚地阐述平板菌落计数的结果,现在已倾向使用菌落形成单位(cfu )而不以绝对菌落数来表示样品的活菌含量。
平板菌落计数法虽然操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是该计数方法的最大优点是可以获得活菌的信息,所以被广泛用于生物制品检验(如活菌制剂),以及食品、饮料和水(包括水源水)等的含菌指数或污染程度的检测。
三、实验器材1 .菌种:酵母菌。
2 .培养基:YEB 培养基。
3 .仪器或其他用具:1ml 无菌吸管,无菌平皿,盛有4.5ml 无菌水的试管,试管架,恒温培养箱等。
四、实验步骤1 .编号取无菌平皿9 套,分别用记号笔标明10 -4、10-5、10 -6(稀释度)各2 套,另取6 支盛有4.5ml 无菌水的试管,依次标是10-1、10-2、10-3、10-4、10-5、10-6。
2 .稀释用1ml 无菌吸管吸取1ml 已充分混匀的大肠杆菌菌悬液(待测样品),精确地放0.5ml 至10 -1的试管中,此即为10 倍稀释。
将多余的菌液放回原菌液中。
将 10 -1 试管置试管振荡器上振荡,使菌液充分混匀。
另取一支 1ml 吸管插入 10 -1 试 管中来回吹吸菌悬液三次,进一步将菌体分散、混匀。
吹吸菌液时不要太猛太快,吸时吸 管伸入管底,吹时离开液面,以免将吸管中的过滤棉花浸湿或使试管内液体外溢。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编号 A B 一、菌落总数(CFU/g) 稀释度 10 10
-1
产品名称
生产日期
检验日期
检验方法:GB 4789.2 A-3 A-4 A-5 B-1 B-2 B-3 B-4 B-5
平板计数琼脂(PCA),36℃±1℃培养48h±2h A-1 A-2
-2
空白 稀释液 计算 方法 结果 二、大肠菌群(CFU/g) 稀释度 10 10
检验方法:GB 4789.3 平板计数法 A-3 A-4 A-5 B-1 B-2 B-3 B-4 B-5
结晶紫中性红胆盐琼脂(VRBA),36℃±1ห้องสมุดไป่ตู้培养18h~24h A-1 A-2
-2
空白 稀释液 煌绿乳糖胆盐肉汤(BGLB),36℃±1℃培养24h~48h
+表示 产气 -表示 不产气
计算方法: N = 阳性试管比例 * 平板菌落数 * 稀释倍数 结果 检验员: 日期: 审核: 日期:
-1
若有两个连续稀释度的平板菌落数 在适宜计数范围内时,按公式 N= ∑C /( n1 + 0.1n2 )d 计算, 否则参见GB4789.2第7.1条
N——样品中菌落数 Σ C——平板(含适宜范围菌落数的平板)菌落数之和 n1——第一稀释度(低稀释倍数)平板个数 n2——第二稀释度(高稀释倍数)平板个数 d——稀释因子(第一稀释度)
