化合物的标准热力学数据
乙二醇物性数据

乙二醇物性数据乙二醇是一种常用的有机化合物,化学式为C2H6O2,也被称为1,2-乙二醇或者乙二醇。
乙二醇具有许多重要的物性,包括物理性质、化学性质和热力学性质。
下面将详细介绍乙二醇的物性数据。
1. 物理性质:- 外观:乙二醇是一种无色、粘稠的液体。
- 气味:乙二醇具有轻微的甜味。
- 熔点:乙二醇的熔点约为-13℃。
- 沸点:乙二醇的沸点约为197℃。
- 密度:乙二醇的密度约为1.113 g/cm³。
- 折射率:乙二醇的折射率约为1.431。
- 溶解性:乙二醇可溶于水、醇类、醚类和酮类溶剂。
2. 化学性质:- 氧化性:乙二醇在氧气存在下可以被氧化为乙醛和乙酸。
- 还原性:乙二醇可以被还原为乙醇。
- 酸碱性:乙二醇是一种中性物质,不具有酸碱性。
- 可燃性:乙二醇是可燃物质,其燃烧产生二氧化碳和水。
3. 热力学性质:- 热容:乙二醇的热容约为2.51 J/g·K。
- 热导率:乙二醇的热导率约为0.25 W/m·K。
- 蒸发潜热:乙二醇的蒸发潜热约为245 kJ/mol。
- 燃烧热:乙二醇的燃烧热约为1363 kJ/mol。
- 热膨胀系数:乙二醇的热膨胀系数约为0.0006 1/℃。
4. 安全性:- 乙二醇具有一定的毒性,长期暴露或者高浓度接触可能对健康造成危害。
- 乙二醇具有刺激性,接触皮肤和眼睛可能引起刺激和炎症。
- 乙二醇具有易燃性,应避免与明火和高温接触。
以上是关于乙二醇物性数据的详细介绍。
乙二醇是一种广泛应用于化工、医药、塑料等领域的化合物,了解其物性数据对于正确使用和处理乙二醇至关重要。
在使用乙二醇时,务必遵守相关的安全操作规程,确保人身安全和环境安全。
化学反应的热力学分析和计算

化学反应的热力学分析和计算热力学是研究物质在能量变化下的行为的科学。
在化学反应中,热力学可以用来分析和计算反应的热效应、熵变和自由能变化,从而帮助我们理解和预测化学反应的发生性质和程度。
本文将介绍化学反应的热力学分析和计算的基本原理和方法。
一、热力学基本概念热力学研究的基本量有能量、熵和自由能。
能量是一切物质存在和发展的基本要素,它可以分为内能、焓和吉布斯自由能。
熵是度量物质无序程度的物理量,描述了物质变化的趋势。
自由能是系统可用能量的度量,反应是否发生和反应的进行方向都与自由能变化密切相关。
二、热力学定律热力学定律是热力学理论的基石,它们是根据大量实验事实总结出来的。
热力学定律包括零th定律、第一定律和第二定律。
零th定律:如果两个系统与第三个系统分别处于热平衡,那么两个系统之间也处于热平衡。
第一定律:能量守恒定律,能量不会凭空消失或产生,只会从一种形式转化为另一种形式。
第二定律:自然界的某些过程是可逆的,而大多数过程是不可逆的;任何一个不可逆过程,总是使世界的熵增加。
三、热力学函数和状态函数热力学函数是描述系统状态的函数,包括内能、焓、熵和自由能。
热力学函数与物质的状态有关,与过程的路径无关。
内能是系统的全部能量之和,在常压下的焓等于内能加上对外界的功。
焓是热力学函数的基本概念,等于内能加上系统对外界做功。
熵是一个用来衡量体系无序程度的物理量,是热力学系统基本状态函数。
自由能是用来揭示体系变化趋势和判断反应可逆性的物理量,是描述宏观热力学状态和变化趋势的基本概念。
四、热力学分析和计算方法热力学分析和计算可以通过实验和理论推导来获得。
实验方法包括测量和计算反应的热效应和熵变。
理论方法包括推导和计算自由能变化、反应平衡常数和温度等相关物理量。
1. 实验测量热力学实验可以通过测量反应过程中释放或吸收的能量来获得热效应。
常见的实验方法包括恒温箱、热量计和卡诺循环等。
熵变的测量可以通过测量物质状态的变化来获得。
化合物氧化能力强弱的判断

化合物的氧化能力强弱可以通过以下几个方面来判断:
1. 标准电极电势(Standard Reduction Potential):
- 标准条件下,可以比较不同氧化剂在氧化还原反应中的电极电势。
标准电极电势越高,该氧化剂的氧化性越强。
2. 化学反应:
- 通过观察化合物在化学反应中作为氧化剂的表现,分析其能否将其他物质氧化至较高氧化态。
如果一个化合物能够容易地氧化其它物质,那么它的氧化性强。
3. 反应条件:
- 在相似条件下,若多个氧化剂作用于同一还原剂时,能较快进行反应并生成更稳定氧化产物的氧化剂,其氧化性较强。
4. 元素周期表位置:
- 同周期从左到右,非金属元素形成的化合物通常氧化性逐渐增强;同主族从上到下,非金属元素形成的化合物氧化性逐渐减弱。
5. 物质活动顺序:
- 对于一些常见金属离子的氧化能力,可以根据金属活动性顺序进行大致判断,例如金属活动性顺序可以反映金属阳离子作为氧化剂的能力。
6. 酸碱性与氧化性关系:
- 非金属最高价氧化物对应的水化物酸性强弱,一般情况下可以说明中心元素的氧化性强弱。
如高氯酸是无机酸中最强的,说明氯的氧化性相对较强。
7. 热力学数据:
ΔG值(吉布斯自由能变化)也可以间接反映氧化还原反应的可能性和氧化剂的强度。
当ΔG为负时,反应自发进行,此时氧化剂的氧化能力强。
综合以上因素,可以全面评估和比较不同化合物的氧化性强弱。
化合物物性查询网站

1.物性数据(/data.xls)该数据库是浏览型数据库,含有470多种纯组分的物性数据,如分子量、冰点、沸点、临界温度、临界压力、临界体积、临界压缩、无中心参数、液体密度、偶极矩、气相热容、液相热容、液体粘度、反应标准热、蒸气压、蒸发热等。
2.热力学性质(/~jrm/thermot.html)该站点可查294种组分的热力学性质,还可以根据Peng Robinson状态方程计算纯组分或混合物的性质:包括气液相图、液体与气体密度、焓、热容、临界值、分子量等数据。
3.标准参考数据库化学网上工具书(/chemistry/)该数据库是一种检索型数据库,检索方法非常简单,可通过化学物质名称、分子式、部分分子式、CAS 登记号、结构或部分结构、离子能性质、振动与电子能、分子量和作用进行检索,可检索到的数据包括分子式、分子量、化学结构、别名、CAS登记号、气相热化学数据、凝聚相热化学数据、液态常压热容、固态常压热容、相变数据、汽化焓、升华焓、燃烧焓、燃烧熵、各种反应的热化学数据、溶解数据、气相离子能数据、气相红外光谱、质谱、紫外/可见光谱、振动/电子能及其参考文献。
4.美国标准技术研究所物理网上工具书(/)该站点包括物性常数、原子光谱数据、分子光谱数据、离子化数据、χ-射线、γ-射线数据、放射性计量数据、核物理数据及其它数据库。
5.sigma-aldrich手册(/saw ... +Bulk?EditDocument)该数据库是一种可检索数据库,可通过产品名称、全文、分子式、CAS登记号等进行检索,检索的结果包括产品名称、登记号、分子式、分子量、贮存温度、纯度、安全数据等。
6.美国国立医学图书馆毒性化学物质数据(HSDB)/servlets/simple-search?1.5.0可通过化学物质名称/别名、CAS登记号、化学物质名称的一部分进行检索,检索结果包括化学物质名称、登记号、同义词、分子式、RTECS号、运输方式、所含杂质等数据。
有机化合物标准热力学数据
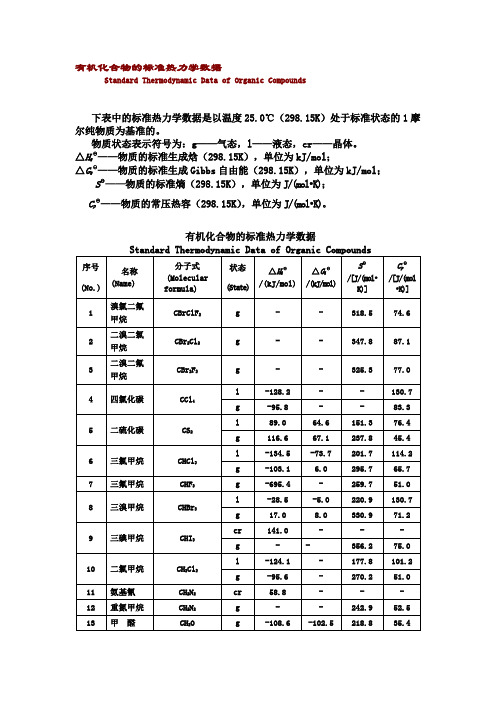
SΘ——物质的标准熵(298.15K),单位为J/(mol•K);
CpΘ——物质的常压热容(298.15K),单位为J/(mol•K)。
有机化合物的标准热力学数据
Standard Thermodynamic Data of Organic Compounds
43.6
53
乙醛
C2H4O
l
-191.8
-127.6
160.2
89.0
g
-166.2
-132.8
263.7
55.3
54
环氧乙烷
C2H4O
l
-77.8
-11.8
153.9
88.0
g
-52.6
-13.0
242.5
47.9
55
乙酸
C2H4O
l
-484.5
-389.9
159.8
123.3
g
-432.8
-374.5
282.5
66.5
56
甲酸甲酯
C2H4O
l
-386.1
-
-
119.1
g
-355.5
-
285.3
64.4
57
溴乙烷
C2H5Br
l
-90.1
-25.8
198.7
100.8
g
-61.9
-23.9
286.7
64.5
58
氯乙烷
C2H5Cl
l
-136.5
-59.3
190.8
104.3
g
-112.2
factsage7.5教程-输入化合物的热力学数据(Cp(T), H298, S298, etc.)以建立私有的化合物数据库

Values of DH° s,298.15 and S° s,298.15 were obtained from the graph (see previous slide)
Compound 4.4
Add a compound to the database: extended properties, V
Before you can start entering compound data in a private database you must first create the database file with the basic information.
A directory must be chosen and a file name be given, a nick name must be defined and a short database description may be entered.
The Compound module
• Click on Compound in the main FactSage window to activate this module.
Compound 2
Create a private Compound database
MgCl2 is taken as an example. The data for this compound are summarized in slide 4.3. All entries are made using the values in this figure. The two different variants of entering data are demonstrated:
化合物的生成–分解反应及热力学分析

化合物的⽣成–分解反应及热⼒学分析第七章化合物的⽣成–分解反应7.1 ⽣成-分解反应的基本概念⼀、化合物的⽣成–分解反应分解反应:化合物被加热到⼀定温度时或在⼀定真空条件下分解为⼀种更简单的化合物(或⾦属)和⽓体的⼀种过程:AB(s, l) = A(s, l) + B(g)AB — 碳酸盐、氧化物、硫化物或氯化物;A — 相应的氧化物、⾦属或低价的氧化物、硫化物和氯化物;B — 相应的⼆氧化碳、氧、硫或氯。
⽣成反应:分解反应的逆过程⼆、常见的化合物的⽣成–分解反应2Fe3O4 = 6FeO+O2↑H2WO4 = WO3 + H2O↑2FeS2 = 2FeS + S2↑CaCO3 = CaO + CO2↑2CuCl2 = 2CuCl + Cl2↑2CO2 = 2CO + O2↑三、研究⽣成–分解反应的意义了解各种化合物的分解条件;⽐较各种化合物在相同条件下稳定性的⾼低由⽣成–分解反应的热⼒学数据求出各种氧化–还原反应的热⼒学数据。
7.2 化合物⽣成反应的热⼒学分析7.2.1 化合物的标准摩尔⽣成吉布斯⾃由能⼀、化合物的⽣成–分解反应⼀、标准摩尔⽣成吉布斯⾃由能 —— △fGθ定义在给定温度及标准压强(pθ=101.325kPa)下,由标准态的单质反应⽣成1mol标准态下的该化合物时,该⽣成反应的标准吉布斯⾃由能变化【例题】FeO的标准摩尔⽣成吉布斯⾃由能的计算1000K时,Fe的标准摩尔吉布斯⾃由能:–49.9 KJ·mol–1O2的标准摩尔吉布斯⾃由能:–220.62 KJ·mol–1FeO的标准摩尔吉布斯⾃由能:–359.48 kJ·mol–1 1000K时,FeO的标准摩尔⽣成吉布斯⾃由能:△fGθ = –359.48 + 220.62/2 + 49.9= –199.27 kJ·mol-1⼆、△fGθ与温度的关系—— △fGθ-T 关系式 (捷姆⾦-许华兹曼速算式)三、化合物标准摩尔⽣成吉布斯⾃由能数据的获得1、查找有关⼿册2、利⽤不同温度下反应物和⽣成物的标准摩尔吉布斯⾃由能值进⾏计算。
化学化工物性数据手册 无机卷中数据

化学化工物性数据手册无机卷中数据引言概述:化学化工物性数据手册是一种重要的工具,用于提供无机化学物质的相关数据。
无机卷中的数据是指无机化合物的物理和化学性质的详细描述。
本文将详细介绍化学化工物性数据手册无机卷中的数据,包括物理性质、化学性质、热力学性质、电化学性质和毒理学性质。
一、物理性质:1.1 密度:物质的密度是指单位体积的质量,通常以克/立方厘米或千克/立方米表示。
数据手册中提供了无机化合物的密度值,以帮助科学家和工程师进行实验设计和工艺开发。
1.2 熔点和沸点:熔点是指物质从固态转变为液态的温度,沸点是指物质从液态转变为气态的温度。
数据手册中列出了无机化合物的熔点和沸点,这对于合成和分离纯化过程的控制非常重要。
1.3 溶解性:溶解性是指物质在特定温度和压力下在溶剂中的溶解程度。
数据手册提供了无机化合物在不同溶剂中的溶解度数据,这对于溶解度计算和溶液的配制非常有用。
二、化学性质:2.1 酸碱性:酸碱性是指物质在水中的离子化程度,通常以pH值表示。
数据手册中提供了无机化合物的酸碱性数据,这对于酸碱中和反应和pH调节非常重要。
2.2 氧化还原性:氧化还原性是指物质在化学反应中的电子转移能力。
数据手册中提供了无机化合物的氧化还原电位和氧化还原反应的条件,这对于电化学反应和电池设计非常有用。
2.3 反应性:反应性是指物质与其他物质发生化学反应的倾向性。
数据手册中提供了无机化合物的反应类型和反应条件,这对于化学合成和反应工程的设计非常重要。
三、热力学性质:3.1 热容和焓:热容是指物质在吸热或放热过程中温度变化的响应能力,焓是指物质在恒定压力下吸热或放热的能力。
数据手册中提供了无机化合物的热容和焓值,这对于热力学计算和热力学过程的分析非常重要。
3.2 热导率:热导率是指物质传导热量的能力。
数据手册中提供了无机化合物的热导率值,这对于热传导计算和热传导过程的控制非常有用。
3.3 相变热:相变热是指物质在相变过程中吸热或放热的能力。
