各种酸在水中的电离常数
【知识解析】电离常数

电离常数1 概念在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。
对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数叫做电离平衡常数,简称电离常数。
弱酸、弱碱的电离常数通常分别用K a 、K b 表示。
2 表示方法ABA ++B -K =()()()A B AB c c c +-⋅(1)一元弱酸、一元弱碱的电离常数 CH 3COOHCH 3COO -+H +()()()3a 3CH COO H CH COOH c c K c -+⋅=NH 3·H 2ONH + 4+OH -()()()4b 32NH OH NH H O c c K c +-⋅⋅=(2)多元弱酸、多元弱碱的电离常数多元弱酸的电离分步进行,各步的电离常数通常分别用K a1、K a2、K a3等来表示。
如: H 3PO 4H ++24H PO -()()()24a134H PO H H PO c c K c -+⋅=24H PO -H ++HPO 2- 4 ()()()24a224HPO H H PO c c K c -+-⋅=HPO 2- 4H ++PO 3- 4 ()()()34a324PO H HPOc c K c -+-⋅=一般多元弱酸各步电离常数的大小为K a1>>K a2>>K a3,因此,多元弱酸的酸性主要由第一步电离决定(八字口诀:分步进行,一步定性)。
多元弱碱的电离比较复杂,因此,一般不讨论多元弱碱的一级电离常数、二级电离常数等。
3 影响因素影响因素————⎧⎨⎩内因(决定因素)弱电解质本身的性质外因温度(随温度升高而增大)同化学平衡常数一样,对于同一弱电解质的稀溶液来说,电离常数只与温度有关,而不受粒子浓度的影响。
由于电解质的电离过程吸热,故电离常数随着温度的升高而增大。
4 意义教材P59·实验3-2 CH3COOH的K a和H2CO3的K a1的大小比较如图3-1-4所示,向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L Na2CO3溶液实验操作图3-1-4实验现象有气泡产生反应生成了CO2,化学方程式为2CH3COOH+Na2CO3===2CH3COONa+H2O+解释CO2↑实验结论CH3COOH的酸性比H2CO3的强,K a(CH3COOH)>K a1(H2CO3)总结:(1)相同温度下,等浓度的弱酸(或弱碱)的电离常数[对于多元弱酸(或弱碱)来说,通常只考虑第一步电离的电离常数]越大,其酸性(或碱性)越强;同样,相同温度下,弱酸(或弱碱)的酸性(或碱性)越强,其电离常数或第一步电离的电离常数越大。
常见酸的电离平衡常数比较

常见酸的电离平衡常数比较酸的电离平衡常数是描述酸在溶液中电离程度的重要参数。
它反映了酸分子与水分子之间的相互作用强弱,通过衡量酸的强弱程度来判断酸的电离程度。
常见酸的电离平衡常数各不相同,下面我们将对几种常见酸的电离平衡常数进行比较。
我们来看一下硫酸(H2SO4)的电离平衡常数。
硫酸是一种强酸,其电离平衡常数非常大,约为10的三次方。
这意味着硫酸在水中几乎完全电离,生成大量的氢离子(H+)和硫酸根离子(SO4^2-)。
因此,硫酸溶液呈酸性。
与之相比,乙酸(CH3COOH)的电离平衡常数较小,约为10的负六次方。
乙酸是一种弱酸,其在水中只有部分电离,生成少量的氢离子(H+)和乙酸根离子(CH3COO-)。
因此,乙酸溶液呈弱酸性。
另一个常见的酸是盐酸(HCl),其电离平衡常数约为10的负一次方。
盐酸是一种强酸,但其电离平衡常数相对较小,这是因为盐酸在水中完全电离,生成大量的氢离子(H+)和氯离子(Cl-)。
虽然电离程度很高,但由于盐酸的浓度较低,所以电离平衡常数较小。
除了硫酸、乙酸和盐酸,还有一种常见的酸是碳酸(H2CO3)。
然而,碳酸是一种相对较弱的酸,其电离平衡常数约为10的负四次方。
碳酸在水中只有部分电离,生成少量的氢离子(H+)和碳酸根离子(CO3^2-)。
由于碳酸的电离程度较低,碳酸溶液呈弱酸性。
还有一种常见的酸是硝酸(HNO3)。
硝酸是一种强酸,其电离平衡常数约为10的负一次方。
硝酸在水中完全电离,生成大量的氢离子(H+)和硝酸根离子(NO3-)。
因此,硝酸溶液呈酸性。
常见酸的电离平衡常数各不相同,与酸的强弱有关。
强酸的电离平衡常数较大,几乎完全电离,生成大量的氢离子和相应的酸根离子;而弱酸的电离平衡常数较小,只有部分电离。
了解酸的电离平衡常数有助于我们理解酸的性质和溶液的酸碱性质,对于化学实验和工业生产中的酸碱反应也有重要的指导意义。
酸碱的电离常数解离常数
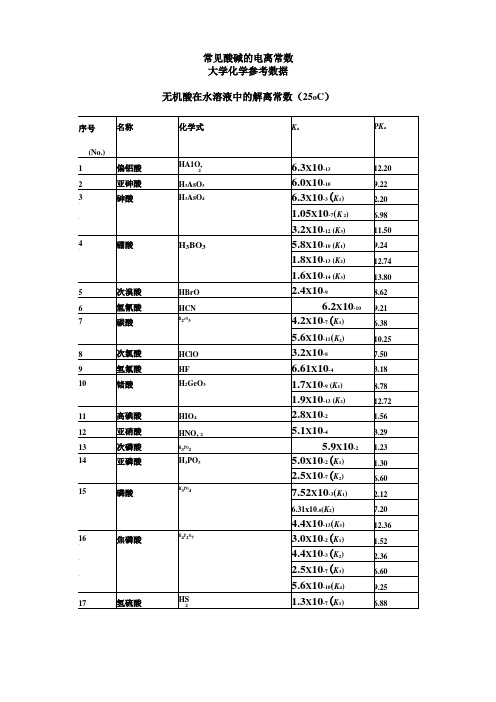
20
苯胺
C风NH
652
3.98x10-10
9.40
21
苄胺
c7H9N
2.24x10-5
4.65
22
环己胺
C6H11NH2
4.37x10-4
3.36
23
吡啶
C5H5N
1.48x10-9
8.83
24
六亚甲基四胺
(CH2)6N4
1.35x10-9
8.87
25
2-氯酚
C6H5ClO
3.55x10-6
20
3-丁烯酸
ch2=chch2cooh
2.1x10-5
4.68
21
异丁烯酸
CH2=C(CH2)COOH
2.2x10-5
4.66
22
1
反丁烯二酸(富马酸)
hococh=chcooh
9.3x10-4(K1)
3.03
3.6x10-5(K2)
4.44
23
顺丁烯二酸(马来酸)
hococh=chcooh
1.2x10-2(K1)
2.96
4.0x10-6(K2)
5.40
50
间苯二甲酸
(m)c6H,《OOH%
2.4x10-4(K1)
3.62
2.5x10-5(K2)
4.60
51
对苯二甲酸
(p)c6H4(cOOH)2
2.9x10-4(K1)
3.54
3.5x10-5(K2)
4.46
52
1
1
1,3,5-苯三甲酸
c6H3(cO0H)3
7.6x10-3(K1)
常见酸碱的电离常数
电离常数酸碱强弱

电离常数酸碱强弱
电离常数是描述溶液中酸或碱的强弱的物理量。
一个酸的电离常数(Ka)越大,说明它在溶液中越强,并且越完全地离解成离子;反之,一个碱的电离常数(Kb)越大,说明它在溶液中越强,并且越完全地离解成离子。
一般来说,电离常数的值越大,酸或碱的强度越强。
以下是一些常见的酸和碱的电离常数(以25摄氏度为例):
强酸:
- 氯化氢(HCl):Ka = 1.3×10^6
- 硫酸(H2SO4):Ka1 = 9.2×10^3,Ka2 = 1.0×10^-2
弱酸:
- 乙酸(CH3COOH):Ka = 1.8×10^-5
- 硼酸(H3BO3):Ka = 5.8×10^-10
强碱:
- 氢氧化钠(NaOH):Kb = 6.3×10^-6
- 氢氧化钾(KOH):Kb = 3.2×10^-7
弱碱:
- 氨(NH3):Kb = 1.8×10^-5
- 碳酸氢铵(NH4HCO3):Kb = 2.5×10^-9
需要注意的是,电离常数的值并不仅仅取决于酸或碱的分子性质,还与溶液浓度和温度有关。
另外,这里提到的只是一些常
见物质的电离常数,实际上还有很多其他酸和碱也具有不同的电离常数。
常见酸碱的电离常数(解离常数)
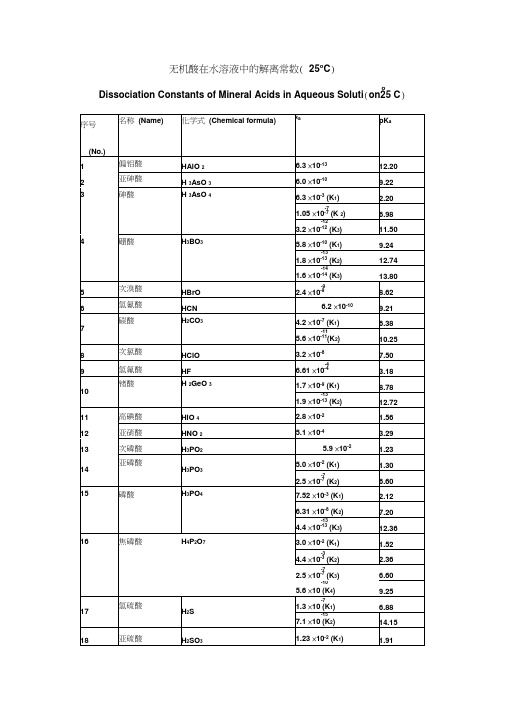
pKb
1
氢氧化铝
Al(OH)3
-9
1.38×10-9(K3)
8.86
2
氢氧化银
AgOH
-4
1.10×10-4
3.96
3
氢氧化钙
Ca(OH)2
-3
3.72×10-3
2.43
-2
3.98×10-2
1.40
4
氨水
NH3+H2O
-5
1.78×10-5
4.75
5
肼(联氨)
N2H4+H2O
-7
9.55×10-7(K1)
18
己胺
H(CH2)6NH2
-4
4.37×10-4
3.36
19
辛胺
H(CH2)8NH2
-4
4.47×10-4
3.35
20
苯胺
C6H5NH2
-10
3.98×10
9.40
21
苄胺
C7H9N
-5
2.24×10
4.65
22
环己胺
C6H11NH2
-4
4.37×10-4
3.36
23
吡啶
C5H5N
-9
1.48×10-9
5
乙二胺
H2N(CH2)2NH2
-5
8.51×10-5(K1)
4.07
-8
7.08×10-8(K2)
7.15
6
二甲胺
(CH3)2NH
-4
5.89×10-4
3.23
7
三甲胺
(CH3)3N
-5
6.31×10-5
4.20
常见弱酸弱碱的电离平衡常数
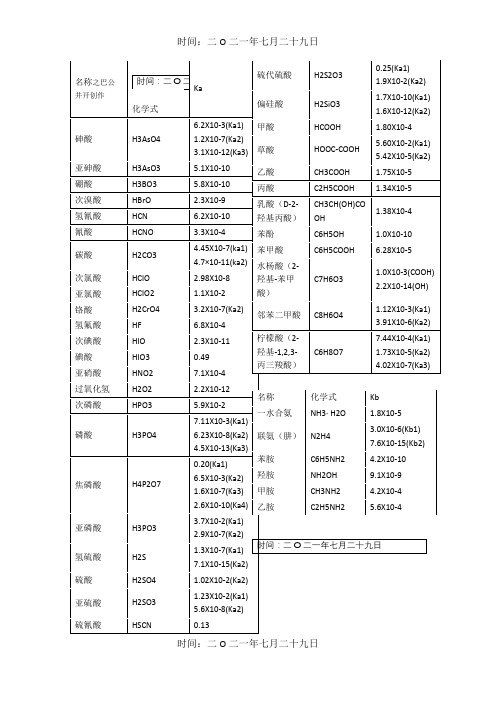
H2S
1.3X10-7(Ka1)
7.1X10-15(Ka2)
硫酸
H2SO4
1.02X10-2(Ka2)
亚硫酸
H2SO3
1.23X10-2(Ka1)
5.6X10-8(Ka2)
硫氰酸
HSCN
0.13
硫代硫酸
H2S2O3
0.25(Ka1)
1.9X10-2(Ka2)
偏硅酸
H2SiO3
1.7X10-10(Ka1)
1.6X10-12(Ka2)
甲酸
HCOOH
1.80X10-4
草酸
HOOC-COOH
5.60X10-2(Ka1)
5.42X10-5(Ka2)
乙酸
CH3COOH
1.75X10-5
丙酸
C2H5COOH
1.34X10-5
乳酸(D-2-羟基丙酸)
CH3CH(OH)COOH
1.38X10-4
苯酚
C6H5OH
1.0X10-10
苯甲酸
C6H5COOH
6.28X10-5
水杨酸(2-羟基-苯甲酸)
C7H6O3
1.0X10-3(COOH)
2.2X10-14(OH)
邻苯二甲酸
C8H6O4
1.12X10-3(Ka1)
3.91X10-6(Ka2)
柠檬酸(2-羟基-1,2,3-丙三羧酸)
C6H8O7
7.44X10-4(Ka1)
1.73X10-5(Ka2)
名称化学式ka62x103ka112x107ka231x1012ka3h3aso351x1010硼酸58x1010次溴酸hbro23x109氢氰酸hcn62x1010氰酸hcno33x104碳酸445x107ka1471011ka2次氯酸hclo298x108亚氯酸hclo11x10232x107ka2氢氟酸hf68x104次碘酸hio23x1011碘酸hio3049亚硝酸hno71x104过氧化氢h2o222x1012次磷酸hpo59x102磷酸h3po711x103ka1623x108ka245x1013ka3焦磷酸h4p2o7020ka165x103ka216x107ka326x1010ka4亚磷酸37x102ka129x107ka2氢硫酸h2s13x107ka171x1015ka2硫酸h2so102x102ka2亚硫酸123x102ka156x108ka2硫氰酸hscn013硫代硫酸025ka119x102ka2偏硅酸h2sio317x1010ka116x1012ka2甲酸hcooh180x104草酸hooccooh560x102ka1542x105ka2乙酸ch3cooh175x105丙酸c2h5cooh134x105乳酸d2基丙酸ch3chohcooh138x104苯酚c6h5oh10x1010苯甲酸c6h5cooh628x105水杨酸基苯甲酸c7h6o310x103cooh22x1014oh邻苯二甲酸c8h6o4112x103ka1391x106ka2柠檬酸744x104ka1173x105ka2402x107ka3名称化学式kb一水合氨nh3h2o18x105n2h430x106kb176x1015kb2苯胺c6h5nh242x1010nh2oh91x109ch3nh242x104乙胺c2h5nh256x104
常见酸的电离平衡常数表(3篇)

第1篇一、引言酸是化学中一类重要的物质,它们在水溶液中能够释放出氢离子(H+)。
酸的电离平衡常数(Ka)是衡量酸强弱的一个重要指标,它反映了酸在水溶液中电离的程度。
本文将列举一些常见酸的电离平衡常数,以便于读者查阅和参考。
二、强酸的电离平衡常数1. 盐酸(HCl)Ka = 1.3×10^62. 硫酸(H2SO4)Ka1 = 1.99×10^3Ka2 = 2.0×10^-23. 硝酸(HNO3)Ka = 4.0×10^34. 氢溴酸(HBr)Ka = 1.0×10^95. 氢碘酸(HI)Ka = 1.0×10^10三、中等强度的酸的电离平衡常数1. 乙酸(CH3COOH)Ka = 1.8×10^-52. 乳酸(C3H6O3)Ka = 4.3×10^-53. 丙酸(C2H5COOH)Ka = 1.4×10^-54. 苹果酸(C4H6O5)Ka = 1.7×10^-45. 乳酸(C3H6O3)Ka = 4.3×10^-5四、弱酸的电离平衡常数1. 氢氟酸(HF)Ka = 6.6×10^-42. 氢氰酸(HCN)Ka = 4.9×10^-103. 氢亚硫酸(H2SO3)Ka1 = 1.6×10^-2Ka2 = 1.3×10^-74. 氢亚磷酸(H3PO3)Ka1 = 7.5×10^-3Ka2 = 6.2×10^-8Ka3 = 4.6×10^-135. 氢硫酸(H2S)Ka1 = 1.0×10^-7Ka2 = 1.3×10^-13五、非常弱的酸的电离平衡常数1. 氨水(NH3)Ka = 1.8×10^-52. 氢硫化氢(H2S)Ka = 1.0×10^-73. 氢亚硫酸(H2SO3)Ka = 1.6×10^-24. 氢亚磷酸(H3PO3)Ka = 7.5×10^-35. 氢氰酸(HCN)Ka = 4.9×10^-10六、总结本文列举了常见酸的电离平衡常数,包括强酸、中等强度酸、弱酸和非常弱的酸。
常见酸碱的电离常数

6.0×10-10
9.22
3
砷酸
H3AsO4
6.3×10-3(K1)
2.20
1.05×10-7(K2)
6.98
3.2×10-12(K3)
11.50
4
硼酸
H3BO3
5.8×10-10(K1)
9.24
1.8×10-13(K2)
12.74
1.6×10-14(K3)
13.80
5
次溴酸
HBrO
2.4×10-9
4.19
35
二苯胺
(C6H5)2NH
7.94×10-14
13.1
36
联苯胺
H2NC6H4C6H4NH2
5.01×10-10(K1)
9.30
4.27×10-11(K2)
10.37
有机酸在水溶液中的解离常数(25oC)
Dissociation Constants of Organic Acids in Aqueous Solution(25oC)
2.0×10-5
4.70
28
3-戊烯酸
CH3CH═CHCH2COOH
3.0×10-5
4.52
29
4-戊烯酸
CH2═CHCH2CH2COOH
2.10×10-5
4.677
30
戊二酸
HOCO(CH2)3COOH
1.7×10-4(K1)
3.77
8.3×10-7(K2)
6.08
31
谷氨酸
HOCOCH2CH2CH(NH2)COOH
4.74
35
(E)-3-己烯酸
CH3CH2CH═CHCH2COOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K1 K2
25
正戊酸
CH3(CH2)3COOH
26
异戊酸
(CH3)2CHCH2COOH
27
2—戊烯酸
CH3CH2CH=CHCOOH
28
3—戊烯酸
CH3CH=CH2CHCOOH
29
4—戊烯酸
CH2=CHCH2CH2COOH
30
戊二酸
HOOC(CH2)3COOH
K1 K2
K1
31
谷氨酸
HOOCCH2CH2CH(NH2)COOH K2
水杨酸
C6H4(OH)COOH
K1 K2
46 邻硝基苯甲酸
(o)NO2C6H4COOH
47 间硝基苯甲酸
(m)NO2C6H4COOH
48 对硝基苯甲酸
(p)NO2C6H4COOH
49
邻苯二甲酸
(o)C6H4(COOH)2
K1 K2
50
间苯二甲酸
(m)C6H4(COOH)2
K1 K2
51
对苯二甲酸
(p)C6H4(COOH)2
H2CO3
K1 K2
HClOபைடு நூலகம்
HF
H2GeO3
K1 K2
HIO4
HNO2
H3PO2
H3PO3
K1 K2
K1
H3PO4
K2
K3
K1
H4P2O7
K2 K3
K4
H2S
K1 K2
H2SO3
K1 K2
H2SO4
K1 K2
H2S2O3
K1 K2
21
氢硒酸
22
亚硒酸
23
硒酸
24
硅酸
25
亚碲酸
1
甲酸
2
乙酸
3
乙醇酸
4
K3
32
正己酸
CH3(CH2)4COOH
33
异己酸
(CH3)2CH(CH2)3COOHl
34 (E)—2—己烯酸
CH3(CH2)2CH=CHCOOH
35 (E)—3—己烯酸
CH3(CH2)CH=CH CH2COOH
36
己二酸
HOOCCH2CH2CH2CH2COOH K1
37
柠檬酸
HOOCCH2C(OH)(COOH)CH2COO H
1.4×10—5 1.67×10—5 2.0×10—5 3.0×10—5 2.1×10—5 1.7×10—4 8.3×10—7 7.4×10—3 4.9×10—5 4.4×10—10 1.39×10—5 1.43×10—5 1.8×10—5 1.9×10—5 3.8×10—5 7.4×10—5 1.7×10—5 4.0×10—7 1.1×10—10 3.6×10—10 1.6×10—13 3.6×10—10 8.71×10—12 1.1×10—10 5.1×10—1 1.4×10—4 6.3×10—5 1.05×10—3 4.17×10—13 6.6×10—3 3.5×10—4 3.6×10—4 1.1×10—3 4.0×10—6 2.4×10—4 2.5×10—5 2.9×10—4 3.5×10—5
HC≡CCOOH
HOCH2CHOHCOOH CH3COCOOH
CH3CHNH2COOH CH2NH2CH2COOH CH3(CH2)2COOH
(CH3)2CHCOOH CH2=CHCH2COOH CH2=C(CH2)COOH HOOCCH=CHCOOH
HOOCCH=CHCOOH
K1
K2
HOOCCH(OH)CH(OH)COOH
1.2×10—2
5.9×10—7 1.04×10—3 4.55×10—5
3.89 11 2.57 6.6 —3.0 1.92 9.77 11.8 2.57 7.74 3.75 4.76 3.83 1.27 4.27 9.78 2.86 1.3 0.7 4.87
4.26
3.86 2.85 5.66 1.89 3.64 2.49 9.87 10.36 4.82 4.85 4.68 4.66 3.03 1.92 6.23 2.98 4.34
K1 K2 K3
38
苯酚
C6H5OH
39
邻苯二酚
(o)C6H4(OH)2
K1 K2
40
间苯二酚
(m)C6H4(OH)2
K1 K2
41
对苯二酚
(p)C6H4(OH)2
42 2,4,6—三硝基苯酚
2,4,6—(NO2)3C6H2OH
43
葡萄糖酸
CH2OH(CHOH)4COOH
44
苯甲酸
C6H5COOH
45
序号 1 2
3
名称 偏铝酸 亚砷酸
砷酸
4
硼酸
5
次溴酸
6
氢氰酸
7
碳酸
8
次氯酸
9
氢氟酸
10
锗酸
11
高碘酸
12
亚硝酸
13
次磷酸
14
亚磷酸
15
磷酸
16
焦磷酸
17
氢硫酸
18
亚硫酸
19
硫酸
20
硫代硫酸
各种酸在水中的电离常数
化学式
Ka
HAlO2
H3AsO3
K1
H3AsO4
K2
K3
K1
H3BO3
K2
K3
HBrO
HCN
K1 K2
K1
52 1,3,5—苯三甲酸
C6H3(COOH)3
K2
K3
K1
K2
53
苯基六羧酸
C6(COOH)6
K3 K4
K5
K6
54
癸二酸
HOOC(CH2)8COOH
K1 K2
55
乙二胺四乙酸
(EDTA) CH2—N(CH2COOH)2 | CH2 K1
—N(CH2COOH)2
K2
Ka
6.3×10—13 6.0×10—10 6.3×10—3 1.05×10—7 3.2×10—12 5.8×10—10 1.8×10—13 1.6×10—14 2.4×10—9 6.2×10—10 4.2×10—7 5.6×10—11 3.2×10—8 6.61×10—4 1.7×10—9 1.9×10—13 2.8×10—2 5.1×10—4 5.9×10—2 5.0×10—2 2.5×10—7 7.52×10—3 6.31×10—8 4.4×10—13 3.0×10—2 4.4×10—3 2.5×10—7 5.6×10—10 1.3×10—7 7.1×10—15 1.23×10—2 6.6×10—8
4.86 4.78 4.7 4.52 4.677 3.77 6.08 2.13 4.31 9.358 4.86 4.85 4.74 4.72 4.42 3.13 4.76 6.4 9.96 9.45 12.8 9.3 11.06 9.96 0.29 3.86 4.2 2.98 12.38 2.18 3.46 3.44 2.96 5.4 3.62 4.6 3.54 4.46
H2SeO4
K1 K2
H2SiO3
K1 K2
H2TeO3
K1 K2
HCOOH
CH3COOH
CH2(OH)COOH
(COOH)2
K1 K2
CH2(NH2)COOH
CH2CICOOH
CHCl2COOH
CCl3COOH
CH3CH2COOH
CH2=CHCOOH
CH3CHOHCOOH
HOOCCH2COOH
K1 K2
5.0×10—2 2.0×10—1
1.35×10—5
5.5×10—5
1.4×10—4
1.4×10—3 2.2×10—6 1.29×10—2 2.29×10—4 3.2×10—3 1.35×10—10 4.4×10—11 1.52×10—5 1.41×10—5 2.1×10—5 2.2×10—5 9.3×10—4
1.3×10—4 1.0×10—11 2.7×10—3 2.5×10—7
1×103 1.2×10—2 1.7×10—10 1.6×10—12 2.7×10—3 1.8×10—8 1.8×10—4 1.74×10—5 1.48×10—4 5.4×10—2 5.4×10—5 1.7×10—10
1.4×10—3
7.6×10—3 7.9×10—5 6.6×10—6 2.1×10—1 6.2×10—3 3.0×10—4 8.1×10—6 4.8×10—7 3.2×10—8 2.6×10—5 2.6×10—6 1.0×10—2
2.14×10—3
2.12 4.1 5.18 0.68 2.21 3.52 5.09 6.32 7.49 4.59 5.59 2 2.67
1.3×103 1.02×10—2 2.52×10—1 1.9×10—2
pKa 12.2 9.22 2.2 6.98 11.5 9.24 12.74 13.8 8.62 9.21 6.38 10.25 7.5 3.18 8.78 12.72 1.56 3.29 1.23 1.3 6.6 2.12 7.2 12.36 1.52 2.36 6.6 9.25 6.88 14.15 1.91 7.18 —3.0 1.99 0.6 1.72
草酸
5
甘氨酸
6
一氯乙酸
7
二氯乙酸
8
三氯乙酸
9
丙酸
10
丙烯酸
11 乳酸(丙醇酸)
12
丙二酸
13
2—丙炔酸
14
甘油酸
15
丙酮酸
16
α—丙胺酸
17
