新药研发和设计的过程培训课件
合集下载
新药的开发过程课件

对策
新药的研发需要投入大量的人力、物力和财力,同时还需要承 担研发失败的风险,导致新药研发成本居高不下。
新药在临床试验中需要严格控制变量,确保试验结果的可靠性, 但受试者招募、试验设计等因素也会增加临床试验的难度。
由于知识产权保护不力,导致新药的仿制和侵权行为严重,对 新药的研发和上市造成了一定的冲击。
药代动力学研究
研究药物在动物体内的吸 收、分布、代谢和排泄过 程,为制定给药方案提供 依据。
临床试验阶段
Ⅰ期临床试验
评估药物在健康志愿者或 少量患者中的安全性、耐 受性和药代动力学特征。
Ⅱ期临床试验
评估药物在目标患者中的 疗效和安全性,为后续试 验提供依据。
Ⅲ期临床试验
大规模临床试验,进一步 评估药物的疗效、安全性 和不良反应,确定最佳给 药方案。
VS
提交至药品审评中心
申请人将整理好的药物注册申请资料提交 至国家食品药品监督管理局的药品审评中 心,由其对申请资料进行形式审查。
药物评审与审批流程
初步审查
药品审评中心对申请资料进行初 步审查,主要关注药物研发的合 法性、规范性以及数据的可靠性。
药学评审
药学专家对药物的有效性、安全 性以及质量可控性等方面进行评 审,同时对药物的生产工艺、质
将有更多的细胞药物进入临床试验阶段。
我国新药研发的前景与展望
政策支持
我国政府已经出台了一系列政策来支持新药的研发和上市,这将为 我国新药的研发提供更加良好的环境。
科研实力提升
我国科研实力的不断提升将为新药的研发提供更加坚实的基础,预 计未来我国将有更多的创新药物问世。
市场需求
随着人们健康意识的提高和疾病谱的变化,新药的需求量将会不断增 加,这将为新药的研发和上市提供更加广阔的市场前景。
新药的研发需要投入大量的人力、物力和财力,同时还需要承 担研发失败的风险,导致新药研发成本居高不下。
新药在临床试验中需要严格控制变量,确保试验结果的可靠性, 但受试者招募、试验设计等因素也会增加临床试验的难度。
由于知识产权保护不力,导致新药的仿制和侵权行为严重,对 新药的研发和上市造成了一定的冲击。
药代动力学研究
研究药物在动物体内的吸 收、分布、代谢和排泄过 程,为制定给药方案提供 依据。
临床试验阶段
Ⅰ期临床试验
评估药物在健康志愿者或 少量患者中的安全性、耐 受性和药代动力学特征。
Ⅱ期临床试验
评估药物在目标患者中的 疗效和安全性,为后续试 验提供依据。
Ⅲ期临床试验
大规模临床试验,进一步 评估药物的疗效、安全性 和不良反应,确定最佳给 药方案。
VS
提交至药品审评中心
申请人将整理好的药物注册申请资料提交 至国家食品药品监督管理局的药品审评中 心,由其对申请资料进行形式审查。
药物评审与审批流程
初步审查
药品审评中心对申请资料进行初 步审查,主要关注药物研发的合 法性、规范性以及数据的可靠性。
药学评审
药学专家对药物的有效性、安全 性以及质量可控性等方面进行评 审,同时对药物的生产工艺、质
将有更多的细胞药物进入临床试验阶段。
我国新药研发的前景与展望
政策支持
我国政府已经出台了一系列政策来支持新药的研发和上市,这将为 我国新药的研发提供更加良好的环境。
科研实力提升
我国科研实力的不断提升将为新药的研发提供更加坚实的基础,预 计未来我国将有更多的创新药物问世。
市场需求
随着人们健康意识的提高和疾病谱的变化,新药的需求量将会不断增 加,这将为新药的研发和上市提供更加广阔的市场前景。
新药研发PPT幻灯片课件

• 在体内通过酶解而重新释放出母体化合物发挥作用。
31
3. 孪药设计
• 孪药,是指将两个相同或不同的先导化合物或药物经共价键连 接缀合成的新分子,在体内代谢生成以上两分子药物而产生协 同作用,增强活性或产生新的药理活性,或者提高作用的选择 性。
• 如果在体内可代谢为原来的构成成分,也被看作是前体药物。 • 常应用拼合原理。
入地研究中。 11
随机与逐一筛选 及意外发现先导化合物
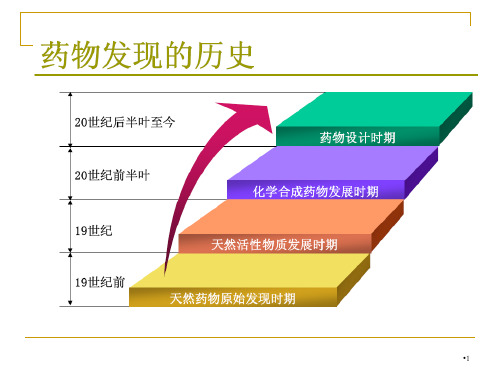
随机与逐一筛选及意外发现曾是获得先导化合 物的最大来源,目前仍为一个可靠来源。其方式为 对从特有或稀有植物、海洋生物、微生物代谢产物 以及低等动植物体内分离天然生物活性成分,对有 机化工产品及其中间体进行普筛,虽然有相当大的 盲目性,但却可以得到新结构类型或新作用特点的 先导化合物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,从动植物和微生物体 内分离鉴定具有生物活性物质,仍然是先导物甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
10
实例分析
青蒿素(Artemisin分in析e):是这从是黄利用天然植物发掘先 花蒿植物(ACrH3temis导ia物,an开nu发le药)分物的一个典型H例子CH。3 天 H离对氯3C 的恶喹O含性耐OO有 疟 药O 过原株氧虫具CH键作有3 的用抑然 疟 明 内倍快制青作 : 酯半,作蒿用 过 经萜特用素复 氧 硼内别,发 键 氢的酯 是对缺率 还 化,对人点较原钠是高成还H3。醚原生C 物构键成OH利效,半OO用关活缩O 系性醛度低研丧仍和究失保HH 抗表。持 体型毒的R为=还性抗-原H很 疟O青低先蒿R,导素因化而合活 或 性成物性 酯 明为,, 化 显新利半 成 提结用缩 青 高构 对醛 蒿 ,类其的酰药羟酯物基等动甲化力醚合学青化物性蒿O成,质素蒿生也甲物有CH醚活所3 进抗为行疟R=蒿结药-甲C构 。H醚3改造开发改 但了善青很,蒿多这素有作些效化为的合抗物疟先均已导发化展合物成药仍物在,深
31
3. 孪药设计
• 孪药,是指将两个相同或不同的先导化合物或药物经共价键连 接缀合成的新分子,在体内代谢生成以上两分子药物而产生协 同作用,增强活性或产生新的药理活性,或者提高作用的选择 性。
• 如果在体内可代谢为原来的构成成分,也被看作是前体药物。 • 常应用拼合原理。
入地研究中。 11
随机与逐一筛选 及意外发现先导化合物
随机与逐一筛选及意外发现曾是获得先导化合 物的最大来源,目前仍为一个可靠来源。其方式为 对从特有或稀有植物、海洋生物、微生物代谢产物 以及低等动植物体内分离天然生物活性成分,对有 机化工产品及其中间体进行普筛,虽然有相当大的 盲目性,但却可以得到新结构类型或新作用特点的 先导化合物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,从动植物和微生物体 内分离鉴定具有生物活性物质,仍然是先导物甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
10
实例分析
青蒿素(Artemisin分in析e):是这从是黄利用天然植物发掘先 花蒿植物(ACrH3temis导ia物,an开nu发le药)分物的一个典型H例子CH。3 天 H离对氯3C 的恶喹O含性耐OO有 疟 药O 过原株氧虫具CH键作有3 的用抑然 疟 明 内倍快制青作 : 酯半,作蒿用 过 经萜特用素复 氧 硼内别,发 键 氢的酯 是对缺率 还 化,对人点较原钠是高成还H3。醚原生C 物构键成OH利效,半OO用关活缩O 系性醛度低研丧仍和究失保HH 抗表。持 体型毒的R为=还性抗-原H很 疟O青低先蒿R,导素因化而合活 或 性成物性 酯 明为,, 化 显新利半 成 提结用缩 青 高构 对醛 蒿 ,类其的酰药羟酯物基等动甲化力醚合学青化物性蒿O成,质素蒿生也甲物有CH醚活所3 进抗为行疟R=蒿结药-甲C构 。H醚3改造开发改 但了善青很,蒿多这素有作些效化为的合抗物疟先均已导发化展合物成药仍物在,深
新药研发与设计的过程【共28张PPT】

产品,它不包括现存化合物的新型盐类、前药、代 谢物和酯类,也不包括组合产品
一.新药研发的概述
头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩大和增强。
• 我国共开发40多个一类新药 当今世界药品研发正逐步成为制药企业的核心竞争力
在II期临床试验期间,最终的剂型被选择和开发作III期临床使用并代表了提交FDA上市申请的处方。 各行业研发支出占销售额的比例
2006 2008F
四.国内新药研发情况
成功药物
临床试验药
动物试验药 活性物质
国际通行研发模式
*
资料来源:
中国通行研发模式
28
合成
体外活性筛选 特异性疾病动物模型筛
• 分子改造
– 头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩 大和增强。
1.新化合物实体的发现
新结构药物发现日趋困难
过去的10年中,有20个新的抗菌药物批准上 市, 其中结构修饰类18个,全新结构的2个
喹喏酮类:7个
结构修饰的类
β-内酰胺类:7个 大环内酯类:2个 四环类:1个
理学家、统计学家等参与共同完成。
生物学特性——药理学
• 评价化学物质的生物活性和确定药物作用 机理。
• 体外细胞培养和酶系统
– 离体动物组织试验 – 整体动物试验(啮齿动物和非啮齿动物)
生物学特性——药理学
体外筛选: ■体外细胞培养和酶系统 ■离体动物组织试验
生物学特性——毒理学1
生殖研究——包–括:急抚养性和交毒配行性为、研胚胎究早期—、早—产和单产后剂发育量、多和代影/响或和致多畸性剂。 量短期给药。给药剂量向一 定范围增加,以确定试验化合物不产生毒性的最大剂量、发生 I期临床试验期间,对于口服给药,直接应用仅含活性药物无其他药用辅料的胶囊剂。
一.新药研发的概述
头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩大和增强。
• 我国共开发40多个一类新药 当今世界药品研发正逐步成为制药企业的核心竞争力
在II期临床试验期间,最终的剂型被选择和开发作III期临床使用并代表了提交FDA上市申请的处方。 各行业研发支出占销售额的比例
2006 2008F
四.国内新药研发情况
成功药物
临床试验药
动物试验药 活性物质
国际通行研发模式
*
资料来源:
中国通行研发模式
28
合成
体外活性筛选 特异性疾病动物模型筛
• 分子改造
– 头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩 大和增强。
1.新化合物实体的发现
新结构药物发现日趋困难
过去的10年中,有20个新的抗菌药物批准上 市, 其中结构修饰类18个,全新结构的2个
喹喏酮类:7个
结构修饰的类
β-内酰胺类:7个 大环内酯类:2个 四环类:1个
理学家、统计学家等参与共同完成。
生物学特性——药理学
• 评价化学物质的生物活性和确定药物作用 机理。
• 体外细胞培养和酶系统
– 离体动物组织试验 – 整体动物试验(啮齿动物和非啮齿动物)
生物学特性——药理学
体外筛选: ■体外细胞培养和酶系统 ■离体动物组织试验
生物学特性——毒理学1
生殖研究——包–括:急抚养性和交毒配行性为、研胚胎究早期—、早—产和单产后剂发育量、多和代影/响或和致多畸性剂。 量短期给药。给药剂量向一 定范围增加,以确定试验化合物不产生毒性的最大剂量、发生 I期临床试验期间,对于口服给药,直接应用仅含活性药物无其他药用辅料的胶囊剂。
新药设计和开发培训课件
• 近年来,受体的亚型及新受体不断被发现和克隆表达,有关 它们的生化、生理、药理性质也相继被阐明,为新药的设计 和研究提供了更准确的靶点和理论基础和降低药物毒副作用 作出了很大的贡献。
– 现已知道,肾上腺能受体有a1、a2、bl、b2、b3亚型,多巴胺 受体有Dl、D2、D3、D4、D5亚型,阿片受体有m、k、s、d、 e亚型等。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
1. 以受体为靶点
• 药物与受体结合才能产生药效。理想的药物必须具有高度的 选择性和特异性。
– 选择性要求药物对某种病理状态产生稳定的功效。 – 特异性是指药物对疾病的某一生理、生化过程有特定的作用,
此即要求药物仅与疾病治疗相关联的受体或受体亚型产生结 合。
• 孤儿受体(orphan receptor)是近年来提出的一种新概念,是 指其编码基因与某一类受体家族成员的编码有同源性,但目 前在体内还没有发现其相应的配基。孤儿受体的发现以及应 用逆向分子药理学(reverse molecular pharmacology)建立孤儿 受体筛选新药的模型,为新药开发提供了更多的有效手段。
一、药物作用的生物靶点
• 能够与药物分子结合并产生药理效应的生物大分子现 通称为药物作用的生物靶点。
• 这些靶点的种类主要有受体、酶、离子通道和核酸, 存在于机体靶器官细胞膜上或细胞浆内。
• 就目前上市的药物来说,以受体为作用靶点的药物约 占52%;以酶为作用靶点的药物约占22%;以离子通道 为作用靶点的药物约占6%;以核酸为作用靶点的药物 约占3%;其余17%药物的作用靶点尚不清楚。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
发现新药的途径…
– 现已知道,肾上腺能受体有a1、a2、bl、b2、b3亚型,多巴胺 受体有Dl、D2、D3、D4、D5亚型,阿片受体有m、k、s、d、 e亚型等。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
1. 以受体为靶点
• 药物与受体结合才能产生药效。理想的药物必须具有高度的 选择性和特异性。
– 选择性要求药物对某种病理状态产生稳定的功效。 – 特异性是指药物对疾病的某一生理、生化过程有特定的作用,
此即要求药物仅与疾病治疗相关联的受体或受体亚型产生结 合。
• 孤儿受体(orphan receptor)是近年来提出的一种新概念,是 指其编码基因与某一类受体家族成员的编码有同源性,但目 前在体内还没有发现其相应的配基。孤儿受体的发现以及应 用逆向分子药理学(reverse molecular pharmacology)建立孤儿 受体筛选新药的模型,为新药开发提供了更多的有效手段。
一、药物作用的生物靶点
• 能够与药物分子结合并产生药理效应的生物大分子现 通称为药物作用的生物靶点。
• 这些靶点的种类主要有受体、酶、离子通道和核酸, 存在于机体靶器官细胞膜上或细胞浆内。
• 就目前上市的药物来说,以受体为作用靶点的药物约 占52%;以酶为作用靶点的药物约占22%;以离子通道 为作用靶点的药物约占6%;以核酸为作用靶点的药物 约占3%;其余17%药物的作用靶点尚不清楚。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
发现新药的途径…
《新药研发的流程》课件

上市后监测
即使药物已经上市,监管机构仍需对其安全性和有效性进行持续 监测,以确保公众安全。
06
新药上市后监测与监管
上市后安全性监测
监测目的
评估药品在上市后的安全性,发现新的不良反应或潜在风险,保 障公众用药安全。
监测方法
通过收集药品使用后的不良事件报告、临床研究、流行病学调查等 多种方式进行监测。
药物合成工艺研究
优化药物的合成工艺,提高药物的产量和纯度。
药物稳定性研究
评估药物在不同环境下的稳定性,确保药物的有效期和储存条件。
药效学研究
药效学实验设计
根据药物的作用机制和靶点,设计药效学实验, 验证药物的疗效。
药效学评价
通过动物模型和体外实验等方法,对药物的药效 进行评价。
药效学比较研究
比较不同药物的药效,为新药的研发提供参考。
目的
新药研发的目的是为了发现和开发新的药物,以治疗疾病、改善患者生活质量 。
新药研发的重要性
满足医疗需求
随着疾病种类的不断增加和医疗技术的不断进步,对新药的 需求也不断增长。新药研发能够满足医疗需求,为患者提供 更有效、更安全的治疗手段。
推动经济发展
新药研发是一个高投入、高风险、高回报的产业,对经济发 展具有重要推动作用。同时,新药研发还能够带动相关产业 的发展,如生物技术、医疗器械等。
药代动力学研究
药物吸收、分布、代谢和排泄研究
01
了解药物在体内的吸收、分布、代谢和排泄过程,为药物的剂
型选择和给药方案提供依据。
药代动力学参数测定
02
通过实验测定药物在体内的药代动力学参数,如半衰期、清除
率等。
药代动力学模型建立
03
建立药代动力学模型,预测药物在不同个体内的表现。
即使药物已经上市,监管机构仍需对其安全性和有效性进行持续 监测,以确保公众安全。
06
新药上市后监测与监管
上市后安全性监测
监测目的
评估药品在上市后的安全性,发现新的不良反应或潜在风险,保 障公众用药安全。
监测方法
通过收集药品使用后的不良事件报告、临床研究、流行病学调查等 多种方式进行监测。
药物合成工艺研究
优化药物的合成工艺,提高药物的产量和纯度。
药物稳定性研究
评估药物在不同环境下的稳定性,确保药物的有效期和储存条件。
药效学研究
药效学实验设计
根据药物的作用机制和靶点,设计药效学实验, 验证药物的疗效。
药效学评价
通过动物模型和体外实验等方法,对药物的药效 进行评价。
药效学比较研究
比较不同药物的药效,为新药的研发提供参考。
目的
新药研发的目的是为了发现和开发新的药物,以治疗疾病、改善患者生活质量 。
新药研发的重要性
满足医疗需求
随着疾病种类的不断增加和医疗技术的不断进步,对新药的 需求也不断增长。新药研发能够满足医疗需求,为患者提供 更有效、更安全的治疗手段。
推动经济发展
新药研发是一个高投入、高风险、高回报的产业,对经济发 展具有重要推动作用。同时,新药研发还能够带动相关产业 的发展,如生物技术、医疗器械等。
药代动力学研究
药物吸收、分布、代谢和排泄研究
01
了解药物在体内的吸收、分布、代谢和排泄过程,为药物的剂
型选择和给药方案提供依据。
药代动力学参数测定
02
通过实验测定药物在体内的药代动力学参数,如半衰期、清除
率等。
药代动力学模型建立
03
建立药代动力学模型,预测药物在不同个体内的表现。
新药研发流程 PPT .ppt

量的化合物实体(药物)用以临床前试验、临床研究、小规模和大规模制剂制备 等等,每一步必须进行质量控制和验证。 生物学特性研发及方案确立 – 药理学 – 药代动力学 – 毒理学 处方研究 – 物化性质 – 最初的处方设计
很多动物实验
三、新药研究申请 (Investigational New Drug Application, IND)
新药研发流程
药物从最初的实验室研究到最终摆 放到药柜销售平均需要花费12年的 时间。进行临床前试验的5000种 化合物中只有5种能进入到后续的 临床试验,而仅其中的1种化合物 可以得到最终的上市批准。总的来 说新药的研发分为两个阶段:研究 和开发。这两个阶段是相继发生有 互相联系的。区分两个阶段的标志 是候选药物的确定,即在确定候选 药物之前为研究阶段,确定之后的 工作为开发阶段。所谓候选药物是 指拟进行系统的临床前试验并进入 临床研究的活性化合物。
提取 长春花——长春碱,长春新碱 太平洋红豆杉树——紫杉醇 动物——胰岛素、激素、天花疫苗 有机 分子设计——合成——体外活性 合成 筛选——特异性疾病动物模型筛
选
分改 造子
头孢菌素——从第一代发展到第四代其 抗菌范围和抗菌活性不断增强和扩大
临床前研究
化学或生物实体的工艺研发及产品制备
开发出符合新药申报要求的化合物实体制备工艺研发,并按照该工的 发现。所谓先导化合物 (leading compound),也称新 化学实体(new chemical entity, NCE),是指通过各种途径和方法 得到的具有某种生物活性或药理活 性的化合物。
进活先 以性导 及物化 药质合 物的物 合挖主 成掘要 心、有 中现如 间有下 体药几 的物个 筛不来 选良源 等作: 。用对 的天 改然
很多动物实验
三、新药研究申请 (Investigational New Drug Application, IND)
新药研发流程
药物从最初的实验室研究到最终摆 放到药柜销售平均需要花费12年的 时间。进行临床前试验的5000种 化合物中只有5种能进入到后续的 临床试验,而仅其中的1种化合物 可以得到最终的上市批准。总的来 说新药的研发分为两个阶段:研究 和开发。这两个阶段是相继发生有 互相联系的。区分两个阶段的标志 是候选药物的确定,即在确定候选 药物之前为研究阶段,确定之后的 工作为开发阶段。所谓候选药物是 指拟进行系统的临床前试验并进入 临床研究的活性化合物。
提取 长春花——长春碱,长春新碱 太平洋红豆杉树——紫杉醇 动物——胰岛素、激素、天花疫苗 有机 分子设计——合成——体外活性 合成 筛选——特异性疾病动物模型筛
选
分改 造子
头孢菌素——从第一代发展到第四代其 抗菌范围和抗菌活性不断增强和扩大
临床前研究
化学或生物实体的工艺研发及产品制备
开发出符合新药申报要求的化合物实体制备工艺研发,并按照该工的 发现。所谓先导化合物 (leading compound),也称新 化学实体(new chemical entity, NCE),是指通过各种途径和方法 得到的具有某种生物活性或药理活 性的化合物。
进活先 以性导 及物化 药质合 物的物 合挖主 成掘要 心、有 中现如 间有下 体药几 的物个 筛不来 选良源 等作: 。用对 的天 改然
新药研发的过程PPT演示课件
5)毒理学等研究。
•5
4)新药临床研究与应用
以人为研究对象(患者和健康人),
考察和评价新药对特定目标疾病的治疗和预防作用。
Ⅰ期临床试验:评价药物的安全性及研究药物的药代动力学。
Ⅱ期临床试验:初步评价药物的有效性。
Ⅲ期临床试验:确定药物的有效性和不良反应。
Ⅳ期临床试验:申请人自主进行的应用研究阶段。
Ⅳ期临床试验目的是考察在广泛使用的条件下药物的疗效和
不良反应,评价新药在普通或特征人群中使用的利益与风险
关系,改进给药剂量。2004年默克公司的万络和辉瑞公司的
塞来考昔,抗关节炎药物被公司自动收回。
•6
•7
•8
•9•10•11Fra bibliotek•12
•13
•14
•15
•1
新药研发的过程
1)先导化合物的发现
2)先导化合物的优化
3)新药临床前研究
4)新药临床研究与应用
•2
一、先导化合物的发现
1、传统方法:随机筛选/偶然发现;天然来源/合成物的随
机筛选与意外发现;药理筛选与意外发现等等。
2、现代方法——合理药物设计法
1)组合化学与高通量筛选。
2)基于性质的药物设计:五倍率、骨架迁越。
结构类型化学物。
2)先导化合物结构优化
对先导化合物做进一步的结构
进行修饰和改造 ,提高活性和
特异性,改善药代动力学特性,
衍生出选择性高、安全性好、
活性大 性大的新的药物。
•4
3)新药临床前研究
需要做普通的、全面的、必需的试验
研究内容包括:
1)药物的理化性质
2)药理学、
3)药效动力学
4)药代动力学
•5
4)新药临床研究与应用
以人为研究对象(患者和健康人),
考察和评价新药对特定目标疾病的治疗和预防作用。
Ⅰ期临床试验:评价药物的安全性及研究药物的药代动力学。
Ⅱ期临床试验:初步评价药物的有效性。
Ⅲ期临床试验:确定药物的有效性和不良反应。
Ⅳ期临床试验:申请人自主进行的应用研究阶段。
Ⅳ期临床试验目的是考察在广泛使用的条件下药物的疗效和
不良反应,评价新药在普通或特征人群中使用的利益与风险
关系,改进给药剂量。2004年默克公司的万络和辉瑞公司的
塞来考昔,抗关节炎药物被公司自动收回。
•6
•7
•8
•9•10•11Fra bibliotek•12
•13
•14
•15
•1
新药研发的过程
1)先导化合物的发现
2)先导化合物的优化
3)新药临床前研究
4)新药临床研究与应用
•2
一、先导化合物的发现
1、传统方法:随机筛选/偶然发现;天然来源/合成物的随
机筛选与意外发现;药理筛选与意外发现等等。
2、现代方法——合理药物设计法
1)组合化学与高通量筛选。
2)基于性质的药物设计:五倍率、骨架迁越。
结构类型化学物。
2)先导化合物结构优化
对先导化合物做进一步的结构
进行修饰和改造 ,提高活性和
特异性,改善药代动力学特性,
衍生出选择性高、安全性好、
活性大 性大的新的药物。
•4
3)新药临床前研究
需要做普通的、全面的、必需的试验
研究内容包括:
1)药物的理化性质
2)药理学、
3)药效动力学
4)药代动力学
新药研究与开发的过程 PPT课件

22、复方制剂中多种成份药效、毒性、药代动力学相互 影响的试验资料及文献资料。
23、致突变试验资料及文献资料。 24、生殖毒性试验资料及文献资料。 25、致癌试验资料及文献资料。 26、依赖性试验资料及文献资料。 27、动物药代动力学试验资料及文献资料。
4.2临床前研究
(四)临床研究资料 28、国内外相关的临床研究资料综述。 29、临床研究计划及研究方案(草案)。 30、临床研究者手册(草案)。
美元
谢谢
南京医科大学药学院李飞 025-86863175 kldlf@
1998年销售量居前20位的仿制药销售总额 为70亿美元,还不及销售量居前20位的注 册新药销售总和的十分之一
一个重磅炸弹级新药可以实现年销售5亿美 元。如洛赛克,非洛地平。
一个新药开发成功可以使公司的股票价格 一日翻番。如:辉瑞的伟哥。
六.新药开发特点
国外每开发成功一个新药 ●高投入 费用:3~5亿美元 ●周期长 时间:10-15年 ●高风险 成功率在1/10000左右 ●高回报 一个重磅炸弹产品年销售可5亿
化合物,工艺,制剂,适应症 例外:链霉素 5.成功率:5%
4.2临床前研究
研究内容:药物的合成工艺、提取方法、 理化性质及纯度、剂型选择、处方筛选、 制备工艺、检验方法、质量指标、稳定性, 药理、毒理、动物药代动力学等。
目的 1.通过动物试验确定安全、有效。 2.确定生产工艺,质量可控
4.2临床前研究
(三)药理毒理研究资料 16、药理毒理研究资料综述。 17、主要药效学试验资料及文献资料。 18、一般药理研究的试验资料及文献资料。 19、急性毒性试验资料及文献资料。 20、长期毒性试验资料及文献资料。 21、过敏性(局部、全身和光敏毒性)、溶血性和局部
23、致突变试验资料及文献资料。 24、生殖毒性试验资料及文献资料。 25、致癌试验资料及文献资料。 26、依赖性试验资料及文献资料。 27、动物药代动力学试验资料及文献资料。
4.2临床前研究
(四)临床研究资料 28、国内外相关的临床研究资料综述。 29、临床研究计划及研究方案(草案)。 30、临床研究者手册(草案)。
美元
谢谢
南京医科大学药学院李飞 025-86863175 kldlf@
1998年销售量居前20位的仿制药销售总额 为70亿美元,还不及销售量居前20位的注 册新药销售总和的十分之一
一个重磅炸弹级新药可以实现年销售5亿美 元。如洛赛克,非洛地平。
一个新药开发成功可以使公司的股票价格 一日翻番。如:辉瑞的伟哥。
六.新药开发特点
国外每开发成功一个新药 ●高投入 费用:3~5亿美元 ●周期长 时间:10-15年 ●高风险 成功率在1/10000左右 ●高回报 一个重磅炸弹产品年销售可5亿
化合物,工艺,制剂,适应症 例外:链霉素 5.成功率:5%
4.2临床前研究
研究内容:药物的合成工艺、提取方法、 理化性质及纯度、剂型选择、处方筛选、 制备工艺、检验方法、质量指标、稳定性, 药理、毒理、动物药代动力学等。
目的 1.通过动物试验确定安全、有效。 2.确定生产工艺,质量可控
4.2临床前研究
(三)药理毒理研究资料 16、药理毒理研究资料综述。 17、主要药效学试验资料及文献资料。 18、一般药理研究的试验资料及文献资料。 19、急性毒性试验资料及文献资料。 20、长期毒性试验资料及文献资料。 21、过敏性(局部、全身和光敏毒性)、溶血性和局部
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
– 生殖研究——包括:抚养和交配行为、胚胎早 期、早产和产后发育、多代影响和致畸性。
– 基因毒性或诱导研究——测定试验化合物是否 引起基因突变或引起微粒体或DNA的损伤。
3/1/2021
新药研发和设计的过程
15
药理毒理动物试验
■急性毒性和长期毒性试验
听说,辣椒吃多了也 会死人,到底吃多少 会死呢?我来试试吧, 不过别忘了追认我为
3/1/2021
新药研发和设计的过程
18
3、新药临床研究申请
• 递交申请(临床研究方案) • FDA审核
3/1/2021
新药研发和设计的过程
19
4、临床试验
• 临床试验的分期
病例数
时间
I期临床 20~100
几个月
目的 安全性为主
成功完成比 例(%)
45
II期临床 III期临床
达托霉素:
环脂肽类微 生物发酵
3/1/2021
新药研发和设计的过程
9
2、临床前研究
• 2.1 化学合成
提供足够量的化合物(药物)作为临床前试验、临床研究、小 规模和大规模制剂制备,每一步必须进行质量控制和验证。
• 2.2 生物学特性
– 药理学 – 毒理学 – 药物代谢
• 2.3 处方前研究
– 物化性质
在已有药物 基础上做一
定创新
新药研发和设计的过程
5
二.新药研发的一般过程
1. 新化合物实体的发现 2. 临床前研究 3. 申请临床试验 4. 临床试验+临床前研究补充 5. 新药申请 6. 上市及监控
3/1/2021
新药研发和设计的过程
6
1.新化合物实体的发现
• 提取
– 植物:长春花——长春碱、长春新碱
3
一.新药研发的概述
新药研发特点: 费用大,投入高,时间长
5000个
250个
10个
1个
药物发现
临床前研究 (5-6年)
临床研究 (5-7年)
上市
花费10亿元美金
3/1/2021
新药研发和设计的过程
4
一.新药研发的概述
药品产 业的价 值链
3*/1/2021 资料来源:
专利药 仿创药 非专利药 普通原料药
内容提要
新药研发的概述
新药研发的一般过程
国内外新药研发的情况
国内新药研发情况
3/1/2021
ห้องสมุดไป่ตู้
新药研发和设计的过程
1
一.何新为新药药?研发的概述
当今世界药品研发正逐步成为制药企业 的核心竞争力
• 真正意义上的新药指拥有全球专利或在全世界都 没有上市过的新化学实体(NCE) 新药.
• 新化学实体(NCE): 指以前没有用于人体治疗并注定可用作处方药
性质和药理学。 – 药物从体内消除的比例及消除的速率和途径
3/1/2021
新药研发和设计的过程
17
2.3 处方前研究
• 物化性质 – 溶解度 – 分配系数 – 溶解速率 – 物理形态 – 稳定性
• 拟定最初处方 I期临床试验期间,对于口服给药,直接应用仅含活性药物无其他药
用辅料的胶囊剂。II期临床试验的处方通常含少量有药用辅料。在II期临 床试验期间,最终的剂型被选择和开发作III期临床使用并代表了提交 FDA上市申请的处方。
3/1/2021
喹喏酮类:7个
结构修饰的类
β-内酰胺类:7个 大环内酯类:2个 四环类:1个
链阳性菌素类:1个
新药研发和设计的过程
R7
7 8
D
9 10
OH
R6'
R6
H
6
C
11
O
R5
N(CH3)2
H
5
4
3
B
A
12 2
12
1
OH
OH
C8ONHR2
OH
O
1.新化合物实体的发现
全新结构 的药物
利奈唑酮: 恶唑烷酮类全 合成
– 最初的处方设计
3/1/2021
新药研发和设计的过程
10
2.2 生物学特性
• 目的: 判断一个化合物是否具有适当的安全性和足够的有效
性,使之继续成为一个有前景的新药,必须获得有关如何 吸收、在体内的整个分布、积蓄、代谢和排泄的情况以及 如作用于机体的细胞、组织和器官。
• 范围: 普通生物学家、微生物学家、分子生物学家、生物化
– 亚急性或亚慢性毒性研究——最少为2个星期给药、3个 或更多剂量水平和2个物种。
– 慢性毒性研究——用于人体一周或以上的药物,必须要 有90~180天的动物试验表明其安全性;若是用于慢性疾 病治疗,必须进行一年或更长的动物试验。
3/1/2021
新药研发和设计的过程
14
生物学特性——毒理学2
– 致癌性研究——当一个化合物具有足够的前景 进入人体临床试验时才进行。
烈士呦!!
3/1/2021
新药研发和设计的过程
16
生物学特性——药物代谢
• ADME • 方法:及时收集和分析尿液、血液和粪便样品及对动物解剖
后的组织和器官。
• 目的:
– 药物从各种途径给药后的吸收程度和速度,包括一种推荐为人体给出 药的途径
– 药物在体内的分布速度和药物滞留部位及持续的时间 – 药物在体内的代谢的速度、初级和次组位点及机理,以及代谢物化学
学家、遗传学家、药理学家、生理学家、药物动力学家、 病理学家、毒理学家、统计学家等参与共同完成。
3/1/2021
新药研发和设计的过程
11
生物学特性——药理学
• 评价化学物质的生物活性和确定药物作用 机理。
• 体外细胞培养和酶系统
– 离体动物组织试验 – 整体动物试验(啮齿动物和非啮齿动物)
3/1/2021
的产品,它不包括现存化合物的新型盐类、前药、 代谢物和酯类,也不包括组合产品
3/1/2021
新药研发和设计的过程
2
一.新药研发的概述
• 我国共开发40多个一类新药 我国自主研发、获得国际承认的创
新药物仅两个 上世纪50年代合成的二巯基丁二酸
钠、上世纪60年代开发的青蒿素。
3/1/2021
新药研发和设计的过程
新药研发和设计的过程
12
生物学特性——药理学
体外筛选: ■体外细胞培养和酶系统 ■离体动物组织试验
3/1/2021
新药研发和设计的过程
13
生物学特性——毒理学1
– 急性毒性研究——单剂量和/或多剂量短期给药。给药剂 量向一定范围增加,以确定试验化合物不产生毒性的最 大剂量、发生严重毒性的剂量水平及中等毒性剂量水平。
太平洋红豆杉树——紫杉醇
– 动物:胰岛素、激素、天花疫苗
• 有机合成
– 分子设计 合成 物模型筛选
体外活性筛选
特异性疾病动
• 分子改造
– 头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性
也不断扩大和增强。
3/1/2021
新药研发和设计的过程
7
1.新化合物实体的发现
新结构药物发现日趋困难
过去的10年中,有20个新的抗菌药物批 准上市, 其中结构修饰类18个,全新 结构的2个
– 基因毒性或诱导研究——测定试验化合物是否 引起基因突变或引起微粒体或DNA的损伤。
3/1/2021
新药研发和设计的过程
15
药理毒理动物试验
■急性毒性和长期毒性试验
听说,辣椒吃多了也 会死人,到底吃多少 会死呢?我来试试吧, 不过别忘了追认我为
3/1/2021
新药研发和设计的过程
18
3、新药临床研究申请
• 递交申请(临床研究方案) • FDA审核
3/1/2021
新药研发和设计的过程
19
4、临床试验
• 临床试验的分期
病例数
时间
I期临床 20~100
几个月
目的 安全性为主
成功完成比 例(%)
45
II期临床 III期临床
达托霉素:
环脂肽类微 生物发酵
3/1/2021
新药研发和设计的过程
9
2、临床前研究
• 2.1 化学合成
提供足够量的化合物(药物)作为临床前试验、临床研究、小 规模和大规模制剂制备,每一步必须进行质量控制和验证。
• 2.2 生物学特性
– 药理学 – 毒理学 – 药物代谢
• 2.3 处方前研究
– 物化性质
在已有药物 基础上做一
定创新
新药研发和设计的过程
5
二.新药研发的一般过程
1. 新化合物实体的发现 2. 临床前研究 3. 申请临床试验 4. 临床试验+临床前研究补充 5. 新药申请 6. 上市及监控
3/1/2021
新药研发和设计的过程
6
1.新化合物实体的发现
• 提取
– 植物:长春花——长春碱、长春新碱
3
一.新药研发的概述
新药研发特点: 费用大,投入高,时间长
5000个
250个
10个
1个
药物发现
临床前研究 (5-6年)
临床研究 (5-7年)
上市
花费10亿元美金
3/1/2021
新药研发和设计的过程
4
一.新药研发的概述
药品产 业的价 值链
3*/1/2021 资料来源:
专利药 仿创药 非专利药 普通原料药
内容提要
新药研发的概述
新药研发的一般过程
国内外新药研发的情况
国内新药研发情况
3/1/2021
ห้องสมุดไป่ตู้
新药研发和设计的过程
1
一.何新为新药药?研发的概述
当今世界药品研发正逐步成为制药企业 的核心竞争力
• 真正意义上的新药指拥有全球专利或在全世界都 没有上市过的新化学实体(NCE) 新药.
• 新化学实体(NCE): 指以前没有用于人体治疗并注定可用作处方药
性质和药理学。 – 药物从体内消除的比例及消除的速率和途径
3/1/2021
新药研发和设计的过程
17
2.3 处方前研究
• 物化性质 – 溶解度 – 分配系数 – 溶解速率 – 物理形态 – 稳定性
• 拟定最初处方 I期临床试验期间,对于口服给药,直接应用仅含活性药物无其他药
用辅料的胶囊剂。II期临床试验的处方通常含少量有药用辅料。在II期临 床试验期间,最终的剂型被选择和开发作III期临床使用并代表了提交 FDA上市申请的处方。
3/1/2021
喹喏酮类:7个
结构修饰的类
β-内酰胺类:7个 大环内酯类:2个 四环类:1个
链阳性菌素类:1个
新药研发和设计的过程
R7
7 8
D
9 10
OH
R6'
R6
H
6
C
11
O
R5
N(CH3)2
H
5
4
3
B
A
12 2
12
1
OH
OH
C8ONHR2
OH
O
1.新化合物实体的发现
全新结构 的药物
利奈唑酮: 恶唑烷酮类全 合成
– 最初的处方设计
3/1/2021
新药研发和设计的过程
10
2.2 生物学特性
• 目的: 判断一个化合物是否具有适当的安全性和足够的有效
性,使之继续成为一个有前景的新药,必须获得有关如何 吸收、在体内的整个分布、积蓄、代谢和排泄的情况以及 如作用于机体的细胞、组织和器官。
• 范围: 普通生物学家、微生物学家、分子生物学家、生物化
– 亚急性或亚慢性毒性研究——最少为2个星期给药、3个 或更多剂量水平和2个物种。
– 慢性毒性研究——用于人体一周或以上的药物,必须要 有90~180天的动物试验表明其安全性;若是用于慢性疾 病治疗,必须进行一年或更长的动物试验。
3/1/2021
新药研发和设计的过程
14
生物学特性——毒理学2
– 致癌性研究——当一个化合物具有足够的前景 进入人体临床试验时才进行。
烈士呦!!
3/1/2021
新药研发和设计的过程
16
生物学特性——药物代谢
• ADME • 方法:及时收集和分析尿液、血液和粪便样品及对动物解剖
后的组织和器官。
• 目的:
– 药物从各种途径给药后的吸收程度和速度,包括一种推荐为人体给出 药的途径
– 药物在体内的分布速度和药物滞留部位及持续的时间 – 药物在体内的代谢的速度、初级和次组位点及机理,以及代谢物化学
学家、遗传学家、药理学家、生理学家、药物动力学家、 病理学家、毒理学家、统计学家等参与共同完成。
3/1/2021
新药研发和设计的过程
11
生物学特性——药理学
• 评价化学物质的生物活性和确定药物作用 机理。
• 体外细胞培养和酶系统
– 离体动物组织试验 – 整体动物试验(啮齿动物和非啮齿动物)
3/1/2021
的产品,它不包括现存化合物的新型盐类、前药、 代谢物和酯类,也不包括组合产品
3/1/2021
新药研发和设计的过程
2
一.新药研发的概述
• 我国共开发40多个一类新药 我国自主研发、获得国际承认的创
新药物仅两个 上世纪50年代合成的二巯基丁二酸
钠、上世纪60年代开发的青蒿素。
3/1/2021
新药研发和设计的过程
新药研发和设计的过程
12
生物学特性——药理学
体外筛选: ■体外细胞培养和酶系统 ■离体动物组织试验
3/1/2021
新药研发和设计的过程
13
生物学特性——毒理学1
– 急性毒性研究——单剂量和/或多剂量短期给药。给药剂 量向一定范围增加,以确定试验化合物不产生毒性的最 大剂量、发生严重毒性的剂量水平及中等毒性剂量水平。
太平洋红豆杉树——紫杉醇
– 动物:胰岛素、激素、天花疫苗
• 有机合成
– 分子设计 合成 物模型筛选
体外活性筛选
特异性疾病动
• 分子改造
– 头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性
也不断扩大和增强。
3/1/2021
新药研发和设计的过程
7
1.新化合物实体的发现
新结构药物发现日趋困难
过去的10年中,有20个新的抗菌药物批 准上市, 其中结构修饰类18个,全新 结构的2个
