无机化学(上册):第9章 化学键与分子结构 习题答案
无机化学练习题(含答案)第9章配合物

无机化学练习题(含答案)第9章配合物第9章配合物9-1:区别下列概念(a)配体和配合物,(b)外轨型配合物和内轨型配合物,(c)高自旋配合物和低自旋配合物,(d)强场配体和弱场配体,(e)几何异构和光学异构,(f)活性配合物和惰性配合物,(g)生成常数和逐级生成常数,(h) 螯合效应和反位效应。
答:答:(a)配位实体中与中心原子或离子结合的分子或离子叫配位体,简称配体;给予体和接受体相结合的化学物种(配位个体)即为配合物。
更为广义的是路易斯酸与路易斯碱的加合物。
(b)从配合物的价键理论出发,凡配位原子的孤对电子填在中心原子或离子由外层d轨道杂化而成的杂化轨道上,形成配位键的配合物即为外轨配合物。
相反,填在由内层(n-1)d 轨道参与的杂化轨道上,即为内轨配合物。
(c)从配合物的晶体场理论出发,由于P 和Δ0 的相对大小,使得配合物中的电子可能有两种不同的排列组态,其中含有单电子数较多的配合物叫高自旋配合物,不存在单电子或含有单电子数少的配合物叫低自旋配合物。
(d)配体与中心金属配位时,由于配体所产生的分裂能不同,使得配体配位场强弱有如下顺序:I-<br-<cl-<f-<oh-<c2o42-<h2o<scn-<nh3<en<so32-<phen<no2-<cn,co。
序列前部的配位体(大体以h2o为界)称之为弱场配体,序列后部的配位体(大体以nh3为界)称之为强场配体。
< bdsfid="78" p=""></br-<cl-<f-<oh-<c2o42-<h2o<scn-<nh3<en<so32-<phen<no2-<cn,co。
序列前部的配位体(大体以h2o为界)称之为弱场配体,序列后部的配位体(大体以nh3为界)称之为强场配体。
(完整word版)《无机化学》(上)习题答案剖析

第1章 原子结构与元素周期律1-1在自然界中氢有三种同位素,氧也有三种同位素,问:总共有多少种含有不同核素的水分子?由于3H 太少,可忽略不计,问:不计3H 时天然水中共有多少种同位素异构水分子?解: 共有18种不同核素的水分子 共有9种不同核素的水分子1-2.答:出现两个峰1-3用质谱仪测得溴的两种天然同位素的相对原子质量和同位素丰度分别为 79Br 78。
9183 占 50。
54%,81Br 80。
9163 占 49。
46%,求溴的相对原子质量。
解:1-4铊的天然同位素203Tl 和205Tl 的核素质量分别为202.97u 和204。
97u ,已知铊的相对原子质量为204。
39,求铊的同位素丰度。
解: 设203Tl 的丰度为X ,205Tl 的丰度为1-X204。
39 = 202。
97X + 204.97(1-X) X= 29.00%1-5等质量的银制成氯化银和碘化银,测得质量比m (AgCl ):m(AgI )= 1:1。
63810,又测得银和氯的相对原子质量分别为107.868和35。
453,求碘的原子量.解: X= 126.911-8为什么有的元素原子量的有效数字的位数多达9位,而有的元素的原子量的有效数字的位数却少至3~4位?答:单核素元素只有一种同位素,因而它们的原子量十分准确。
而多核素元素原子量的准确性与它们同位素丰度的测量准确性有关(样品的来源、性质以及取样方式方法等)。
若同位素丰度涨落很大的元素,原子量就不可能取得很准确的数据.1—13.解:(1)r=c /λ=(3×108)/(633×10-9) = 4。
74×1014Hz 氦—氖激发是红光(2)r=c/λ=(3.0×108)/(435。
8×10-9) = 6。
88×1014Hz 汞灯发蓝光 (3)r=c/λ=(3.0×108)/(670.8×10—9) = 4.47×1014Hz 锂是紫红18)33(313131323=+⨯=⋅+⋅c c c c 9)21(313121322=+⨯=⋅+⋅c c c c 91.79%46.499163.80%54.509183.78)Br (=⨯+⨯=Ar X 107.86835.453107.86863810.11)AgI ()AgCl (++==m m1—14 Br 2分子分解为Br 原子需要的最低解离能为190kJ 。
《无机化学》习题解析和答案

1、教材《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章p区金属(4学时)第二十二章ds区元素(6学时)第二十三章d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质(chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
无机及分析化学第九章答案

第九章 习题解答1.离子键无饱和性和方向性,而离子晶体中每个离子有确定的配位数,二者有无矛盾? 答:二者无矛盾。
离子键无饱和性和方向性是由离子特征决定的。
只要里自带有不同的电荷就会有库伦作用,无论周围的空间有多少带有相异电荷的离子,都会产生库伦吸引力,这就决定了离子键的不饱和性,而电荷相异的离子在任意方向的这种作用依然存在。
即没有固定方向,不存在方向性。
而离子在离子晶体由于空间条件及离子本身大小的限制,使一个离子周围只能有确定数目的作用,即配位数一定。
但不论相邻的离子间库伦引力依然存在,故两者不矛盾。
2.下列双原子分子或离子,哪些可稳定存在?哪些不可能稳定存在?请将能稳定存在的双原子分子或离子按稳定性由大到小的顺序排列起来。
H 2 He 2 He 2+ Be 2 C 2 N 2 N 2+答: H 2 σ1s 2键级=122=- He 2 σ1s2σ1s *2键级=0222=- He 2+ σ1s2σ1s*1键级=5.0212=- Be 2 σ1s2σ1s*2σ2s 2σ2s *2键级=0244=-C 2 σ1s2σ1s*2σ2s2σ2s*2π2py 2π2pz 2键级=2248=-N 2 σ1s2σ1s*2σ2s2σ2s*2π2py 2π2pz 2σ2px 2键级=32410=-N 2+σ1s2σ1s*2σ2s2σ2s*2π2py 2π2pz 2σ2px 1键级=5.2249=-稳定存在的分子或离子:H 2 He 2+ C 2 N 2 N 2+ 不能稳定存在的分子或离子:He 2 Be 2 稳定性次序:N 2>N 2+>C 2>H 2>He 2+3.第二周期某元素的单质是双原子分子,键级为1是顺磁性物质。
(1)推断出它的原子序号; (2)写出分子轨道中的排布情况; 答:(1)原子序号5(2)B 2 σ1s 2σ1s *2σ2s 2σ2s *2π2py 1π2pz 14.在BCl 3和NCl 3分子中,中心原子的氧化数和配体数都相同,为什么二者的中心原子采取的杂化类型、分子构型却不同?答:BCl3与NCl3分子中,中心原子不同,中心原子的电子结构不同,使得两者的中心原子采用不同的杂化方式:B采用的是sp3杂化,每个杂化轨道的的夹角是120o,与Cl原子以3p x轨道形成3个σ键,分子呈平面三角形。
《无机化学》第九章分子结构课后习题参考答案

第九章分子结构课后习题参考答案2解:(1)Hg 原子的价电子构型是:5d 106s 2因中心原子Hg 采用sp 杂化,则分子为直线形。
(2)因中心原子Si 采用sp 3杂化,则分子构型为正四面体(3)因中心原子B 采用sp 2杂化,则分子构型为平面三角形(4)因中心原子N 采用sp 3杂化,有一对孤对占据杂化轨道,所以分子构型为三角锥形(5)因中心原子N 采用sp 2杂化,有一对孤对占据杂化轨道,所以分子构型为V 形(6)因中心原子Si 采用sp 3d 2杂化,所以分子构型为正八面体3解:(1)42414=⨯+=VP ,σ键数为4,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为正四面体。
用杂化轨道理论说明:因分子中共有四对成键,则需提供四条杂化轨道,所以Si 采用sp 3杂化形成四条sp 3杂化轨道供四对成键电子占据,分子构型为正四面体。
(2)224=+=VP ,σ键数为2,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为直线形。
杂化轨道理论:(3)32133⨯+=VP ,σ键数为3,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为平面三角形。
用杂化轨道理论说明:因分子中共有三对成键,则需提供三条杂化轨道,所以B 采用sp 2杂化形成三条sp 2杂化轨道供三对成键电子占据,分子构型为平面三角形。
(4)42135=⨯+=VP ,σ键数为3,有1对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为三角锥形。
杂化轨道理论:(5)42126=⨯+=VP ,σ键数为2,有2对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:(6)326=+=VP ,σ键数为2,有1对孤对电子对,则价电子对空间构型为平面三角形,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:4解:(1)521127=+⨯+=VP ,σ键数为2,有3对孤对电子存在,其价电子对空间构型为三角双锥,扣除孤电子对所占据的位置,其离子几何构型为直线形。
化学键和分子结构(习题及答案)

如: O2- > F- >Na+ > Mg2+ > Al3+ >Si4+
③ 离子的电子构型。 18电子构型、 9~17电子构型>8电子构型 ④ 复杂离子的变形性通常不大,且复杂离子中心原子氧 化数越高,变形性越小。 如: I->Br- >OH- > NO3- >F- >ClO49
2012-8-2
Supplement(transition of bonding type)
△subHm △subHm △fHm⊙
Chapter 3 Homework
KI(s)
U
1/2I2(g)
△disHm
I-(g) + I K(g) K+(g) △fHm⊙= △subHm(K)+I(K)+1/2 △subHm(I2) + 1/2△disHm(I2)+EA(I2)+U = -326.8(kJ· -1) mol
3
General Chemistry
三、计算题 已知KI的晶格能(U)为-631.9kJ∙mol-1,钾的升华热为 90.0kJ∙mol-1,钾的电离能为418.9 kJ∙mol-1,碘的升华热为62.4 kJ∙mol-1,碘的离解能为151 kJ∙mol-1,碘的电子亲合能为-310.5 kJ∙mol-1,求碘化钾的生成热(△fHm⊙)。 解: K(s) + 1/2I2(s)
8. 下列化合物中存在氢键的是( C )
A.HCl B.C2H5OC2H5 C.HNO3 D.CH3F
形成氢键要具备两个条件: ① 分子中必须有电负性较大而半径较小的元素(X=F、O、 N),并与H形成共价键; ② 分子中还必须有另外一个电负性大而半径小,有孤对电子的 原子(Y=F、O、N) 。
分子结构及其性质+Word版含答案
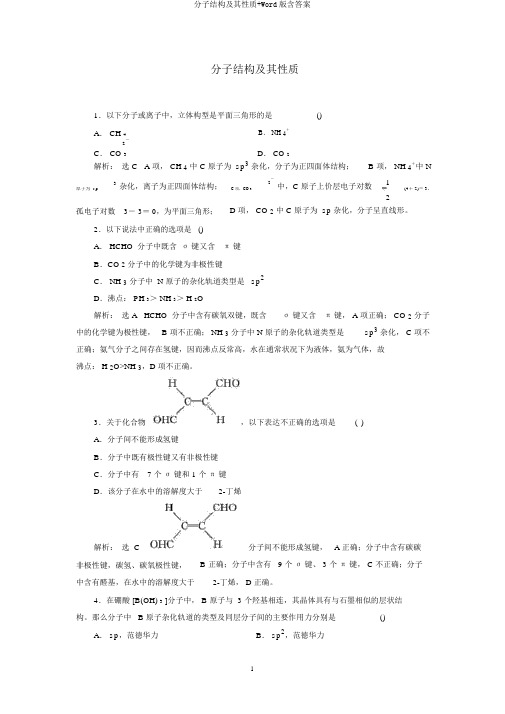
分子结构及其性质1.以下分子或离子中,立体构型是平面三角形的是()A. CH 4B. NH 4+2-D. CO 2C. CO 3解析:选 C A 项, CH 4中 C 原子为 sp3杂化,分子为正四面体结构; B 项, NH 4+中 N3杂化,离子为正四面体结构;2-中,C 原子上价层电子对数1原子为 sp C 项,CO 3(4+ 2)= 3,2孤电子对数3- 3= 0,为平面三角形; D 项, CO 2中 C 原子为 sp杂化,分子呈直线形。
2.以下说法中正确的选项是 ()A. HCHO 分子中既含σ键又含π键B.CO 2分子中的化学键为非极性键C. NH 3分子中 N 原子的杂化轨道类型是 sp2D.沸点: PH 3> NH 3> H 2O解析:选 A HCHO 分子中含有碳氧双键,既含σ键又含π键, A 项正确; CO 2分子中的化学键为极性键, B 项不正确; NH 3分子中 N 原子的杂化轨道类型是sp3杂化, C 项不正确;氨气分子之间存在氢键,因而沸点反常高,水在通常状况下为液体,氨为气体,故沸点: H 2O>NH 3,D 项不正确。
3.关于化合物,以下表达不正确的选项是()A.分子间不能形成氢键B.分子中既有极性键又有非极性键C.分子中有7 个σ键和 1 个π键D.该分子在水中的溶解度大于2-丁烯解析:选 C分子间不能形成氢键, A 正确;分子中含有碳碳非极性键,碳氢、碳氧极性键, B 正确;分子中含有 9 个σ键、 3 个π键, C 不正确;分子中含有醛基,在水中的溶解度大于2-丁烯, D 正确。
4.在硼酸 [B(OH) 3 ]分子中, B 原子与 3 个羟基相连,其晶体具有与石墨相似的层状结构。
那么分子中 B 原子杂化轨道的类型及同层分子间的主要作用力分别是() A. sp,范德华力B. sp2,范德华力23C . sp ,氢键D . sp ,氢键解析: 选 C 由石墨的晶体结构知C 原子为 sp 2 杂化,故 B 原子也为 sp 2 杂化,但由于B(OH) 3 中 B 原子与 3 个羟基相连, 羟基间能形成氢键, 故同层分子间的主要作用力为氢键。
大连理工大学无机化学教研室《无机化学》(第5版)(课后习题详解 分子结构)

9.2 课后习题详解1. 写出下列化合物分子的Lewis 结构式,并指出其中何者是σ键,何者是π键,何者是配位键。
(1)膦PH 3 (2)联氨N 2H 4(N-N 单键);(3)乙烯; (4)甲醛;(5)甲酸;(6)四氧化二氮(有双键)。
解:其结构式与化学键类型如表9.1所示:表 9.12. 根据下列分子或离子的几何构型,试用杂化轨道理论加以说明。
(1)HgCl 2(直线形);(2) SiF 4(正四面体);(3)BCl 3(平面三角形);(4)NF 3(三角锥形,102°);(5)(V 形,115.4°);(6)(八面体)。
2NO -26SiF -解:分子或离子的几何构型及其杂化理论解释如表9.2所示:表 9.23. 试用价层电子对互斥理论推断下列各分子的几何构型,并用杂化轨道理论加以说明。
解:用价层电子对互斥理论推断分子的几何构型应先计算中心原子的价电子对数,然后确定其空间分布,再根据是否有孤电子对来判断分子构型。
如果价层电子对数等于配位数,则分子的空间构型与电子空间排列相同,否则会存在孤对电子,分子的空间构型与电子空间排列不相同。
中心原子的杂化轨道类型与中心原子的价层电子对数有关,中心原子的价层电子对数等于其参与杂化的原子轨道数。
则可推知题中的分子构型如表9.3所示:表 9.34. 试用VSEPR 理论判断下列离子的几何构型。
解:推断结果如表9.4所示:表 9.45. 下列离子中,何者几何构型为T 形?何者构型为平面四方形?解:根据理论,几何构型为形的分子或离子,其中心原子的价层电子对数VSEPR T 为5,配位原子数为3。
所以在配位原子数为3的离子中的几何构型为形。
几何3XeF +T 构型为平面正方形的分子或离子,其中心原子的价电子对数为6,配位原子数为4。
所以的几何构型为平面正方形。
4ICl -6. 下列各对分子或离子中,何者具有相同的几何构型?解:中心原子价层电子对数相同,配位原子数也相同的分子或离子,一定具有相同的几何构型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第9章化学键与分子结构习题1. 根据AgX晶格能理论值与实验值差别判断Ag-X共价键成分递增顺序。
AgF AgCl AgBr AgI实验值(kJ·mol-1)951 902 887 886理论值(kJ·mol-1)925 833 808 7742.从Cr原子的价层结构3d54s1来看,Cr失去1个4s电子后成为3d5半充满构型。
这种结构似应是稳定的,因而似应有CrX (X =F、Cl、Br、I)化合物存在,但实际上却未能制备出这类化合物。
理论计算CrCl晶格能为758 kJ·mol-1,已知金属Cr的升华能(397 kJ·mol-1)、Cl-Cl键的键能(242.6 kJ·mol-1)、Cr的第一电离能(653 kJ·mol-1)、Cl的第一电子亲合能(348.6 kJ·mol-1)。
设计CrCl的玻恩-哈伯热化学循环,计算CrCl(s)的标准摩尔生成焓(∆f H m o)。
另已知反应2CrCl(s)=CrCl2(s)+Cr(s)的标准摩尔自由能变为-486 kJ·mol-1。
比较说明CrCl稳定性,解释上述事实。
3.4. 温度为298 K时,已知(1)H2=2H(g), Δr1H m o= 436 kJ.mol-1,(2)O2=2O(g), Δr2H m o= 498 kJ.mol-1,(3)H2O(g)=2H(g)+ 2O(g), Δr3H m o= 930 kJ.mol-1 求:反应H2 (g)+½ O2 (g)= H2O (g) 的Δr H m o。
5. 写出下列分子的Lewis结构式:CF4、OF2、HCN、CO、NSF6. 写出下列离子的Lewis结构式:CF3+、C22-、PH2-、BH4-7. 乙炔的标准生成焓为226.6 kJ.mol-1,H-H、C-H键键能D H-H、D C-H分别为436 kJ.mol-1、415 kJ.mol-1,石墨的升华能∆sub H(C(s)) 为717 kJ.mol-1,求C≡C的键能D C≡C。
8. 氰为一种有毒气体,其分子式为NCCN。
根据下列键能数据(单位:kJ.mol-1)计算反应NCCN(g) + 2 O2(g) = N2(g) + 2 CO2(g)的焓变。
9. 画出下列分子Lewis结构式,指出中心原子价层电子对数、中心原子价电子杂化方式、中心原子价层电子空间几何构型以及分子空间几何构型:CO2、ONF、BF3、ICl3。
10. 画出下列离子Lewis结构式,指出中心原子价层电子对数、中心原子价电子杂化方式、中心原子价层电子空间几何构型以及分子空间几何构型:IF4-、PCl4-、SeO32-、I3-。
11. 指出下列分子或离子的空间几何构型、中心原子杂化态:ClF3, BrF5, IF7, ClO2-,[ICl4]-NCl312. 根据杂化轨道理论说明下列分子成键过程:BeCl2、NCl3、XeF4、SF6、CO32-、SO42-、SO32-、NO3-。
13. 利用分子轨道理论写出下列分子或离子电子排布式:B2、O2-、BN。
计算键级并预测磁性质。
14. 分子结构中键角可以通过杂化轨道类型判断,另外对于同种杂化类型,由于原子间斥力不同,键角也会略有差异。
指出以下分子∠OSO由小到大的顺序并简述理由。
SO2、SO3、SO32-、SO42-、SO2Cl2、SO2F2。
15. 画出NO分子轨道能级图及电子填充。
计算NO+、NO、NO-键级、键长顺序、稳定性顺序并预测磁性质。
16. 写出的O2+、O2、O2-、O22-分子轨道电子排布式,计算其键级,比较其稳定性强弱,并说明其磁性。
17. 已知CO2分子轨道能级图如下(1)用↑↓表示电子自旋,在C、O基态原子轨道上填入适当的电子;(2)在CO2基态分子轨道上填入适当的电子;(3)计算CO2基态分子的键级;(4)预测CO2基态分子的磁性(5)如形成CO2—带一个电荷的负离子,试问CO2—键级?比较CO2—和CO2中C-O键长。
18. 指出下列分子的空间构型及分子极性:CCl4、PCl5、PCl3、SF6。
19.指出BF3与NH3结合之间化学键形成过程,并判断化学键类型。
20. 试根据下列化合物的价电子数目初步判断其导电性,并简述理由。
SiO2、RuO2、GaAs、TaN、Ta3N5。
21. 方铁矿中的主要成分是FeO,其中部分Fe2+位置被Fe3+取代。
电学性质测量表明方铁矿是半导体,试问方铁矿是哪一种类型半导体(p型、n型)?并简述理由。
22. 指出下列分子间存在的分子间作用力类型:(1)乙醇和水(2)氦和水(3)苯和四氯化碳(4)溴化氢HBr和碘化氢HI(5)H2S气体分子23. 丙烷(CH3CH2CH3)乙醚(CH3OCH3)一氯甲烷(CH3Cl)乙醛(CH3CHO)乙腈(CH3CN)偶极矩分别为0.1D,1.3D,1.9D,2.7D和3.9D,比较它们的沸点高低。
24. 乙腈(CH3CN)和一碘甲烷(CH3I)偶极矩分别为3.9 D和1.62 D,(1)比较CH3CN 和CH3I取向力大小;(2)比较CH3CN 和CH3I色散力大小;(3)比较CH3CN 和CH3I总的分子间作用力大小,并判断CH3CN 和CH3I熔沸点高低。
25. 简要回答:(1) 下列物质中液态时分子间作用力最弱的是:CCl4、Ar、Cl2、H2;(2) 乙醇中相邻分子间相互作用力是什么?(3) 单质硫S8中相邻分子间相互作用力是什么?26. 下列化合物哪些存在氢键,是什么类型的氢键?(1)NH3;(2)HNO3;(3)H3BO3(固体);(4)CF3H;(5)C2H6;(6)邻硝基苯酚;(7)对硝基苯酚;(8)邻-HOC6H4COOH。
(中山大学乔正平)1. 解:根据AgF、AgCl、AgBr、AgI 晶格能理论值与实验值差值(kJ/mol)分别为:26、69、79、112。
共价键成分递增顺序是AgF、AgCl、AgBr、AgI。
2. 解:CrCl的玻恩-哈伯热化学循环类似于NaCl,∆H m o= ∆H sub + 0.5B. E. Cl-Cl + I Cr - E.A. Cl- U = 397+121.3+653-348.6-758= 64.7 kJ/mol计算出来的生成焓是正值,由于Cr和Cl2生成CrCl是熵减的反应,因此反应标准摩尔自由能大于>64.7 kJ/mol, 表明CrCl即使能生成也是一个不大稳定的化合物。
同时,CrCl(s)分解反应的标准摩尔自由能为-486 kJ/mol,很负,说明反应趋势很大因此,即使能生成CrCl,也会按上式发生歧化反应。
所以CrCl是不稳定的。
3. RbI(s) 玻恩-哈伯热化学循环类似于NaCl,RbI(s)晶格能即反应Rb+(g)+I-(g) →RbI(s)焓变的相反数,根据热化学循环得反应Rb+(g)+I-(g) →RbI(s)焓变为-595 kJ/mol,所以RbI(s)晶格能为595 kJ/mol。
4. 解:式(1)+1/2×式(2)-式(3),得H2 (g)+1/ 2 O2 (g)= H2O (g)故Δr H m o=Δr H m o(1)+1/2Δr H m o(2)-Δr H m o(3)=436+1/2×498-930=-245 kJ.mol-15.6.7. D C≡C = 813 kJ•mol-1。
8. NCCN的结构为N≡C-C≡N,因此反应可以写成:N≡C-C≡N + 2 O=O → N≡N+2O=C=O 反应焓变:∆r H =2D C≡N+D C-C+2D O=O-D N≡N-2×2×D C=O=2×891+348+2×495-941-2×2×799=-1017 kJ•mol-1。
9.CO2ONF BF3ICl3Lewis结构式中心原子价层电4 6 6 10子对数中心原子价电子sp2sp2sp2sp3d 杂化方式中心原子价层电直线三角三角三角双锥子空间几何构型分子空间直线V型三角T型几何构型10.IF 4-PCl 4+SeO 32-I 3-Lewis 结构式中心原子价层电子对数 128810中心原子价电子杂化方式 sp 3d 2sp 3sp 3sp 3d中心原子价层电子空间几何构型 正八面体 正四面体 正四面体 三角双锥 分子空间几何构型平面正方形正四面体三角锥直线11. ClF 3: 杂化:sp 3d 空间构型:T 型BrF 5: 杂化:sp 3d 2 空间构型:四方锥 IF 7: 杂化:sp 3d 3 空间构型:五角双锥 ClO 2-: 杂化:sp 3 空间构型:V 型[ICl 4]-杂化:sp 3d 2 空间构型:平面正方形 NCl 3 杂化:sp 3d 2 空间构型:三角锥 12.BeCl 2:价层电子对数:(2+2)2/=2,sp 杂化。
NCl 3:价层电子对数:(5+3)2/=4,sp 3杂化。
XeF 4:价层电子对数:(8+4)2/=6,sp 3d 2杂化。
N :2s 22p 3sp 3 杂化与来自3个Cl 的3个单电子成键Be :2s 2sp 杂化与来自2个Cl 的2个单电子成键SF 6:价层电子对数:(6+6)2/=6,sp 3d 2 杂化。
CO 32-:价层电子对数:(4+0+2)2/=3,sp 2 杂化。
sp 2杂化轨道上没有成单电子,氧原子必须激发成2p 22p 22p 0构型,3个氧空出的3个p 轨道与C 的sp 2 杂化轨道成键。
SO 42-:价层电子对数:(6+0+2)2/=4,sp 3 杂化。
sp 3杂化轨道上没有成单电子,氧原子必须激发成2p 22p 22p 0构型,4个氧空出的4个p 轨道与S 的sp 3杂化轨道成键。
此外,由于氧原子电负性大、半径小,接纳来自S 的电子后核外电子斥力比较大,电子反馈到S 有3d 空轨道,形成反馈 ∏ 键。
每个氧提供2个电子,4个氧共提供8个电子,在包括S 在内的5个原子间运动,记为 ∏ 58,5中心8电子∏ 键。
SO 32--:价层电子对数:(6+0+2)2/=4,sp 3 杂化。
S :3s 23p 4外加2个电子sp 3 杂化C :2s 22p 2sp 2 杂化外加2个电子S :3s 23p 4sp 3d 2 杂化与来自6个F 的6个单电子成键3dXe :5s 25p 3sp 3d 2 杂化与来自4个F 的4个单电子成键5dsp 3杂化轨道上没有成单电子,氧原子必须激发成2p 22p 22p 0构型,3个氧空出的3个p 轨道与S 的sp 3杂化轨道成键。
