关键质量属性和关键工艺参数
关键质量属性CQA和关键工艺参数CPP评估

ICH Q8(R2)中关于CQA和CPP的定义
CQA
关键质量属性(CQA):物理、化学、生物学或微生物的性质 或特征,其应在适当的限度、范围或分布内,以保证产品质 量。
CPP
关键工艺参数(CPP):此工艺参数的变化会影响关键质量属 性,因此需要被监测及控制,确保生产产品的质量。
216
108
生产工艺的CQA&CPP
原辅料准备
混合
真空上料
混合
244
122
风险识别‐CQA
混合均一度
245
风险识别‐CPP 识别各个操作单元中影响关键质量属性的关键工艺参数:
体积 时间
转速
CPP
246
123
风险识别矩阵
混合
StepsCriticalQualityAttributesIncludes 工序关键质量属性包括
NO.
CQA
工艺流程图,SOP或批生产记录可以提供这些信息 资料准备工作很重要
评估小组应该确定上述信息的详细程度来支持风险评估。 评估小组对准备的资料要进行确认
238
119
风险识别
风险识别
目标产品质量概况(QTPP) 质量属性 生产工艺 操作单元
关键质量属性 关键工艺参数
239
风险识别‐QTPP
适应症:用于敏感菌所致的尿路感染、肠道感染、呼吸道感染以及 脑膜炎、中耳炎、痈肿及败血症等
含量:XXX含量: 93.0~107.0%
脆碎度
崩解时限 片重差异
XXX片剂
微生物限度
241
风险识别‐生产工艺 粉碎 称量
湿法制粒 干燥
混合 压片 铝塑包装 外包装
242
简述药品关键质量属性(CQA)以及指标分析

物理质量属性:
一、外观:(非CQA
属性目标:让患者容易接受的颜色和形状,无目视观察到的缺陷。
理由:颜色,形状和外观与安全性和有效性无直接关系。因此,它们 不是关键。做为质量属性的原因是因为长得好看的东西更容易让人接 受…例如小孩吃糖喜欢卡通状的。这是一个看脸的世界。
简述药品关键质量属性(
关键质量属性(Critical Quality Attributes, CQA):
指物质(药品或活性成分)具备的直接或间接影响物质安全、鉴别、 强度、纯度的物理,化学,微生物方面特性。关键质量属性确定的标 准是基于药品在不符合该质量属性时对患者所造成危害(安全性和有 效性)的严重程度。
理由:涉及药品生物利用度(BA)和生物等效性(BE),是关键。以及剂 量是否会产生倾泻问题。
十二、水分(CQA
属性目标:确保药物安全有效(降级),符合标准。
理由:水分过多会导致药物产生降解,或者生产过程中工艺执行不顺 利(例如压片、制粒)
十三、微生物限度(CQA
属性目标:确保药物安全性,以及避免引起外观投诉(细菌、霉变、 长蛆)
五、脆碎度(非CQA
属性目标:避免破碎带来的外观影响投诉,仿制药关注符合参比制剂 的质量标准以及药典或者已上市药品标准。
理由:除了按照药典或者已上市药品标准以为, 该属性尽量减少上市 后有关片剂外观的投诉。该目标脆碎度将不影响患者的安全性或有效 性。
六、鉴别(制剂 非CQA原料药CQA
属性目标:确定是否是这货--
理由:不符合微生物限度将影响患者的安全性。但是,只要原材料符 合药典的微生物要求,处方和工艺变量不可能影响该CQA对最终产 品检验,以确保药品不支持微生物生长。
关键质量属性和关键工艺参数【范本模板】
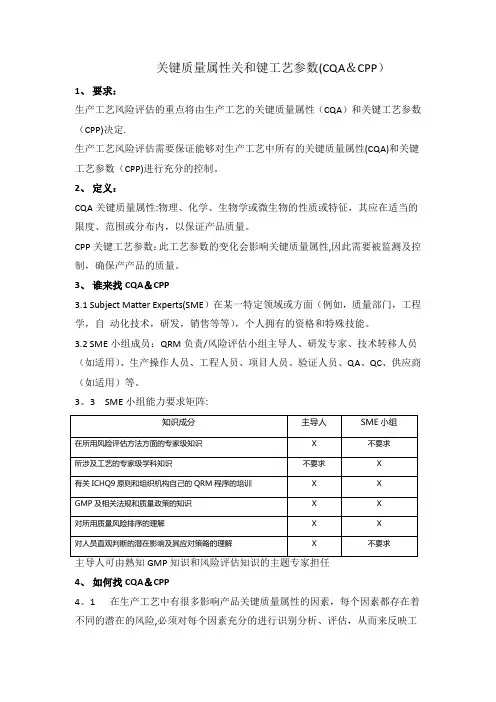
关键质量属性关和键工艺参数(CQA&CPP)1、要求:生产工艺风险评估的重点将由生产工艺的关键质量属性(CQA)和关键工艺参数(CPP)决定.生产工艺风险评估需要保证能够对生产工艺中所有的关键质量属性(CQA)和关键工艺参数(CPP)进行充分的控制。
2、定义:CQA关键质量属性:物理、化学、生物学或微生物的性质或特征,其应在适当的限度、范围或分布内,以保证产品质量。
CPP关键工艺参数:此工艺参数的变化会影响关键质量属性,因此需要被监测及控制,确保产产品的质量。
3、谁来找CQA&CPP3.1 Subject Matter Experts(SME)在某一特定领域或方面(例如,质量部门,工程学,自动化技术,研发,销售等等),个人拥有的资格和特殊技能。
3.2 SME小组成员:QRM负责/风险评估小组主导人、研发专家、技术转移人员(如适用)、生产操作人员、工程人员、项目人员、验证人员、QA、QC、供应商(如适用)等。
3。
3 SME小组能力要求矩阵:4、如何找CQA&CPP4。
1 在生产工艺中有很多影响产品关键质量属性的因素,每个因素都存在着不同的潜在的风险,必须对每个因素充分的进行识别分析、评估,从而来反映工艺的一些重要性质.4。
2 列出将要被评估的工序步骤。
工艺流程图,SOP或批生产记录可以提供这些信息.评估小组应该确定上述信息的详细程度来支持风险评估.例:文件资源:保证在评估之前已经具备所有必要的文件。
良好培训:保证在开展任何工作之前所有必要的风险评估规程、模板和培训已经就位。
评估会议:管理并规划所有要求的风险评估会议。
例:资料需求单ICH Q8(R2)‐QbD‐系统化的方法、ICHQ9‐质量风险管理流程图CQA&CPP风险评估工具‐FMEA6。
1FMEA实施:1。
成立一个评估小组2。
识别已知和潜在的失效模式3。
识别严重性、可能性和可检测性4. 详细说明行为5。
重新评级6。
详细说明剩余的风险7。
关键质量属性CQA和关键工艺参数CPP评估

境 控制) 工艺控制
110
生产工艺的操作参数
关键参数 非关键参数
工艺 参数
重要参数 非重要参数
221如何定义CPP ? 窄范Fra bibliotek(和/或难控制)
宽范围(和/或易控制)
关键的* 工艺中一个可调节的参数(可变的),需要在窄的
范围 内进行维护,以保证不会影响到关键的产品质量属
219
关键质量属性判定矩阵
属性
测试
关键or非关键
鉴别
所有的鉴别
关键
物化性质 性状
pH、熔点、折光率等
物理状态 (例如:液体、固体)
可能关键也可能不关键 基于API的物理性质和计划用途
关键
含量
纯度 粒度 微生物纯度
含量测试
关键
有机(HPLC) 无机(硫酸化灰分、
炽 灼残渣) 残留溶剂 重金属* 手性杂质(手性分析、 旋光度)
粒度 密度
总数 内毒素
热原
关键
使用ICHQ6A决策树 使用ICHQ6A决策树
晶型
晶型测试
使用ICHQ6A决策树
*如果工艺不能控制或是影响该属性也可能需要GMP控制
工艺控制orGMP控制 GMP控制
工艺控制和/或GMP控制 基于药品
GMP控制或工艺控制 (工
艺条件可能影响物理状 态)
工艺控制
工艺控制
工艺控制
Drug Product 制药产品
Critical Parameters 关键参数
Critical Steps 关键步骤
API Critical Quality Attributes
API关键质量属性
关键质量属性CQA和关键工艺参数CPP评估

228
找CQA&CPP之前的必要条件有哪些
保证在评估之前已经具备所有必要的文件
保证在开展任何工作之前所有必要的风险评估 规程 和培训已经就位
管理并规划所有要求的风险评估会议
1
VMP
明确风险评估的策略要求
2
系统影响性评估
确认厂房设施 系统 设备的直接影响系统
3
工艺注册文件
12
自控系统描述如适用
自控系统信息了解
115
229
文件资源
• 详细的文件资料能够有效的支持CQA&CPP风险评
估的
• 针对现状所有信息的分析才能得到一个有意义的
CQA&CPP风险评估结果
资料需求单
230
资料需求单
GMP知识 工艺知识
质量风险管理程序 CQA&CPP风险评估程序
质 量
关键的 工艺中一个可调节的参数可变的;需要在窄的范围 内进行维护;以保证不会影响到关键的产品质量属性
非重要的 工艺中一个可调整的参数可变的;被证明是 可以在较宽的范围内很好的控制的;虽然在极端 条件下会影响质量
例如: •生物反应器的搅拌速度影响溶氧水平;导致药物成分 的氧化状态和较低的效能 •柱洗脱过程的变异如:缓冲液梯度导致更高的 聚集;可能增加影响免疫原性的风险 •柱子的操作温度影响产品相关的杂质的清除
工艺控制和/或GMP控制 基于药品
性状
物理状态 例如:液体 固体
关键
GMP控制或工艺控制工 艺条件可能影响物理状态
含量
含量测试
关键
工艺控制
纯度
有机HPLC 无机硫酸化灰分 炽 灼残渣 残留溶剂 重金属 手性杂质手性分析 旋光度
关键质量属性和关键工艺参数
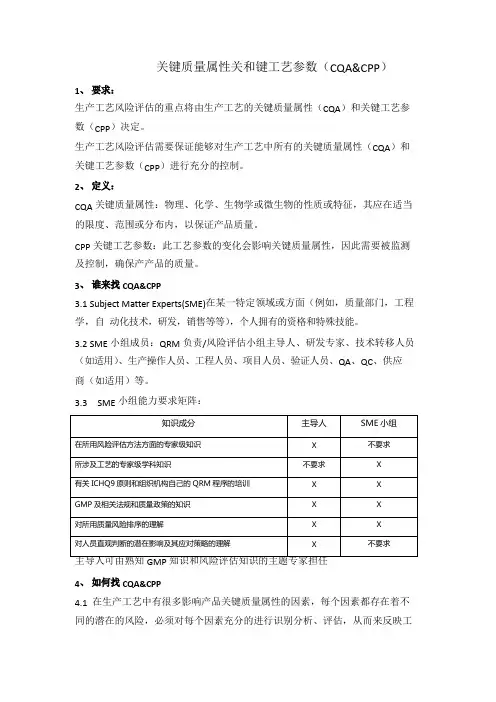
关键质量属性关和键工艺参数(CQA&CPP)1、要求:生产工艺风险评估的重点将由生产工艺的关键质量属性(CQA)和关键工艺参数(CPP)决定。
生产工艺风险评估需要保证能够对生产工艺中所有的关键质量属性(CQA)和关键工艺参数(CPP)进行充分的控制。
2、定义:CQA 关键质量属性:物理、化学、生物学或微生物的性质或特征,其应在适当的限度、范围或分布内,以保证产品质量。
CPP 关键工艺参数:此工艺参数的变化会影响关键质量属性,因此需要被监测及控制,确保产产品的质量。
3、谁来找CQA&CPP3.1 Subject Matter Experts(SME)在某一特定领域或方面(例如,质量部门,工程学,自动化技术,研发,销售等等),个人拥有的资格和特殊技能。
3.2 SME 小组成员:QRM 负责/风险评估小组主导人、研发专家、技术转移人员(如适用)、生产操作人员、工程人员、项目人员、验证人员、QA、QC、供应商(如适用)等。
3.3 SME 小组能力要求矩阵:4、如何找CQA&CPP4.1在生产工艺中有很多影响产品关键质量属性的因素,每个因素都存在着不同的潜在的风险,必须对每个因素充分的进行识别分析、评估,从而来反映工艺的一些重要性质。
4.2列出将要被评估的工序步骤。
工艺流程图,SOP 或批生产记录可以提供这些信息。
评估小组应该确定上述信息的详细程度来支持风险评估。
例:文件资源:保证在评估之前已经具备所有必要的文件。
良好培训:保证在开展任何工作之前所有必要的风险评估规程、模板和培训已经就位。
评估会议:管理并规划所有要求的风险评估会议。
例:资料需求单ICH Q8(R2)‐ QbD‐系统化的方法、ICHQ9‐质量风险管理流程图CQA&CPP 风险评估工具‐FMEA6.1FMEA 实施:1.成立一个评估小组2.识别已知和潜在的失效模式3.识别严重性、可能性和可检测性4.详细说明行为5.重新评级6.详细说明剩余的风险7.完成一个简短的摘要6.2 风险评估:1、列出将要被评估的工序步骤:在生产工艺中有很多影响产品关键质量属性的因素,每个因素都存在着不同的潜在的风险,必须对每个因素充分的进行识别分析、评估,从而来反映工艺的一些重要性质。
关键质量属性和关键工艺参数
关键质量属性关和键工艺参数(C Q A&C P P)1、要求:生产工艺风险评估的重点将由生产工艺的关键质量属性(CQA)和关键工艺参数(CPP)决定。
生产工艺风险评估需要保证能够对生产工艺中所有的关键质量属性(CQA)和关键工艺参数(CPP)进行充分的控制。
2、定义:CQA关键质量属性:物理、化学、生物学或微生物的性质或特征,其应在适当的限度、范围或分布内,以保证产品质量。
CPP关键工艺参数:此工艺参数的变化会影响关键质量属性,因此需要被监测及控制,确保产产品的质量。
3、谁来找CQA&CPP3.1 Subject Matter Experts(SME)在某一特定领域或方面(例如,质量部门,工程学,自动化技术,研发,销售等等),个人拥有的资格和特殊技能。
3.2 SME小组成员:QRM负责/风险评估小组主导人、研发专家、技术转移人员(如适用)、生产操作人员、工程人员、项目人员、验证人员、QA、QC、供应商(如适用)等。
3.3 SME小组能力要求矩阵:4、如何找CQA&CPP4.1 在生产工艺中有很多影响产品关键质量属性的因素,每个因素都存在着不同的潜在的风险,必须对每个因素充分的进行识别分析、评估,从而来反映工艺的一些重要性质。
4.2 列出将要被评估的工序步骤。
工艺流程图,SOP或批生产记录可以提供这些信息。
评估小组应该确定上述信息的详细程度来支持风险评估。
例:文件资源:保证在评估之前已经具备所有必要的文件。
良好培训:保证在开展任何工作之前所有必要的风险评估规程、模板和培训已经就位。
评估会议:管理并规划所有要求的风险评估会议。
例:资料需求单ICH?Q8(R2)‐ QbD‐系统化的方法、 ICHQ9‐质量风险管理流程图CQA&CPP风险评估工具‐FMEA6.1FMEA实施:1. 成立一个评估小组2. 识别已知和潜在的失效模式3. 识别严重性、可能性和可检测性4. 详细说明行为5. 重新评级6. 详细说明剩余的风险7. 完成一个简短的摘要6.2风险评估:1、列出将要被评估的工序步骤:在生产工艺中有很多影响产品关键质量属性的因素,每个因素都存在着不同的潜在的风险,必须对每个因素充分的进行识别分析、评估,从而来反映工艺的一些重要性质。
简述药品关键质量属性(CQA)以及指标分析
简述药品关键质量属性(CQA)以及指标分析关键质量属性(Critical Quality Attributes,CQA):指物质(药品或活性成分)具备的直接或间接影响物质安全、鉴别、强度、纯度的物理,化学,微生物方面特性.关键质量属性确定的标准是基于药品在不符合该质量属性时对患者所造成危害(安全性和有效性)的严重程度。
关键工艺参数:简单来说:影响药品关键质量属性的工艺参数复杂来说:Critical Process Parameter (CPP):A process parameter whose variability has an impact on a critical quality attribute and therefore should be monitored or controlled to ensure the process produces the desired quality。
ICH Q8 Pharmaceutical Development。
我们来看看常见质量属性以及为什么这些属性是或者不是关键质量属性(重点考虑安全性和有效性)物理质量属性:一、外观:(非CQA)属性目标:让患者容易接受的颜色和形状,无目视观察到的缺陷。
理由:颜色,形状和外观与安全性和有效性无直接关系.因此,它们不是关键。
做为质量属性的原因是因为长得好看的东西更容易让人接受...例如小孩吃糖喜欢卡通状的.这是一个看脸的世界。
二、气味:(非CQA)属性目标:不要那么难闻。
理由:一般来说,可觉察的气味与安全性和有效性无直接关系,但气味可影响患者可接受性并导致投诉。
如果药品中使用的药物和辅料都有难闻气味或者在药品生产工艺中使用有机溶剂,则应该在药品研发阶段设定好适量的矫味剂。
三、尺寸大小(CQA)属性目标:便于吞咽、使用(仿制药考虑与参比制剂一致)理由:药品(片剂、胶囊、栓剂等)的尺寸大小与吞咽性、可使用性有关;因此,它是关键。
关键质量属性CQA、关键工艺参数CPP、质量风险管理
与患者用药安全相关的,质量属性都应该是CQA
质量风险管理
质量风险管理
质量管理的思维方式
1、有可能出现的风险就一定会出现 2、有风险的操作一定要有明确的控制措施和明 确的控制方法才可以操作 3、关注一切可能发生的风险事件,所以我们才 会有变更管理、风险评估、验证管理、文件管理 等等质量管理手段
操作繁琐、流程复杂、效率降低
4
1
2
8
低
灭菌后取出物品的顺序 1、岗位操作规程中对物品取出 错误 顺序进行规定。 呼吸器泄露 1、IQ中对呼吸器进行检漏。 2、在管理文件中规定呼吸器滤 芯的更换周期。
3
1
3
9
低
4
2
1
8
低
项目
失败
导致的原因 未按时更换易损件
控制的措施 1、定期更换P 2、采购煤气泄漏检 测器D 1、专人看管D 2、采购有自动关闭 煤气功能的煤气灶P
高 高 高 高 高
灭菌效果无法保证 柜内装载物品过多或过少 计量器具不准确 柜内温度分布不均匀 灭菌温度过低 灭菌时间过短
低风险指示值:1~9;中等风险指示值:10~25;高风险指示值:26~125
如果是一个已经发生的事件我们在评估的时候应该评估,已经导致的失败,受影 响的工序、产品、物料等因素。
项目 火灾隐患
1、墨菲定律的原句是这样的:如果有两种或两种以上的方式去做某件事情, 而其中一种选择方式将导致灾难,则必定有人会做出这种选择。 2、墨菲定律根本内容是:如果事情有变坏的可能,不管这种可能性有多小, 它总会发生
风险是永远存在的,我们能做的是降低风险发生的可能、降低风险导致后果 的严重性
质量风险管理、风险评估(ICH Q9)
关键质量属性CQA和关键工艺参数CPP评估
总数 内毒素
热原
关键
使用ICHQ6A决策树 使用ICHQ6A决策树
晶型
晶型测试
使用ICHQ6A决策树
*如果工艺不能控制或是影响该属性也可能需要GMP控制
工艺控制orGMP控制 GMP控制
工艺控制和/或GMP控制 基于药品
GMP控制或工艺控制 (工
艺条件可能影响物理状 态)
工艺控制
工艺控制
工艺控制
工艺流程图,SOP或批生产记录可以提供这些信息 资料准备工作很重要
评估小组应该确定上述信息的详细程度来支持风险评估。 评估小组对准备的资料要进行确认
238
119
风险识别
风险识别
目标产品质量概况(QTPP) 质量属性 生产工艺 操作单元
关键质量属性 关键工艺参数
感染、肠道感染、呼吸道感染以及 脑膜炎、中耳炎、痈肿及败血症等
6. 详细说明剩余的风险 7. 完成一个简短的摘要
新发现的失效问题应 该随时加进来
236
118
风险评估
在生产工艺中有很多影响产品关键质量属性的因素 每个因素都存在着不同的潜在的风险
必须对每个因素充分的进行识别分析、评估 从而来反映生产工艺的一些重要性质
237
风险评估
列出将要被评估的工序步骤 生产工艺中所有的步骤均需要列出
WorstCaseEffect 最差影响情况 产品混合不均匀
产品混合不均匀
产品混合不均匀 产品混合不均匀 产品混合不均匀 产品混合不均匀
250
125
风险评价
风险评价
需要对生产工艺风险分析时确认的危害进行全 面的审查以保证能够确定出所有的潜在风险并 对其进行评估。
风险评价 全面审查依据当前控制方法进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
关键质量属性关和键工艺参数(C Q A&C P P)
1、要求:
生产工艺风险评估的重点将由生产工艺的关键质量属性(CQA)和关键工艺参数(CPP)决定。
生产工艺风险评估需要保证能够对生产工艺中所有的关键质量属性(CQA)和关键工艺参数(CPP)进行充分的控制。
2、定义:
CQA关键质量属性:物理、化学、生物学或微生物的性质或特征,其应在适当的限度、范围或分布内,以保证产品质量。
CPP关键工艺参数:此工艺参数的变化会影响关键质量属性,因此需要被监测及控制,确保产产品的质量。
3、谁来找CQA&CPP
3.1 Subject Matter Experts(SME)在某一特定领域或方面(例如,质量部门,工程学,自
动化技术,研发,销售等等),个人拥有的资格和特殊技能。
3.2 SME小组成员:QRM负责/风险评估小组主导人、研发专家、技术转移人员(如适用)、生产操作人员、工程人员、项目人员、验证人员、QA、QC、供应商(如适用)等。
3.3 SME小组能力要求矩阵:
4、如何找CQA&CPP
4.1 在生产工艺中有很多影响产品关键质量属性的因素,每个因素都存在着不同的潜在的风险,必须对每个因素充分的进行识别分析、评估,从而来反映工艺的一些重要性质。
4.2 列出将要被评估的工序步骤。
工艺流程图,SOP或批生产记录可以提供这些信息。
评估小组应该确定上述信息的详细程度来支持风险评估。
例:
文件资源:保证在评估之前已经具备所有必要的文件。
良好培训:保证在开展任何工作之前所有必要的风险评估规程、模板和培训已经就位。
评估会议:管理并规划所有要求的风险评估会议。
例:资料需求单
ICH?Q8(R2)‐QbD‐系统化的方法、ICHQ9‐质量风险管理流程图
CQA&CPP风险评估工具‐FMEA
6.1FMEA实施:
1. 成立一个评估小组
2. 识别已知和潜在的失效模式
3. 识别严重性、可能性和可检测性
4. 详细说明行为
5. 重新评级
6. 详细说明剩余的风险
7. 完成一个简短的摘要
6.2风险评估:
1、列出将要被评估的工序步骤:在生产工艺中有很多影响产品关键质量属性的因素,每个因素都存在着不同的潜在的风险,必须对每个因素充分的进行识别分析、评估,从而来反映工艺的一些重要性质。
2、列出将要被评估的工序步骤。
工艺流程图,SOP或批生产记录可以提供这些信息。
评估小组应该确定上述信息的详细程度来支持风险评估。
6.3风险识别:
1、目标产品质量概况(QTPP ):详细列举目标产品的适应症、给药途径、剂型、性状、包装形式、微生物限度等概况。
2、生产工艺:列举完整的工艺流程图及详细步骤。
3、操作单元的识别:一个在生产工艺中独立的步骤或操作,对工艺和操作进行定义以实现一个特殊的工艺目标。
对生产工艺中各个操作单元进行识别。
4、关键质量属性的识别:对生产工艺中各个操作单元的关键质量属性进行识别。
5、关键工艺参数的识别:识别各个操作单元中影响关键质量属性的关键工艺参数。
7、找到CQA&CPP之后怎么办
7.1风险分析
1、风险分析是对所关联已经确认了的危害因素进行评估。
2、在确定了关键工艺参数之后,将针对每个已经确定的关键工艺参数进行分析,分析其失效时可能产生的危害。
3、明确描述确认的原因,可能是一个或多个。
7.2 风险评价
1、需要对生产工艺风险分析时确认的危害进行全面的审查以保证能够确定出所有的潜在风险并对其进行评估。
2、全面审查依据当前控制方法进行
3、风险评价可以定性或定量描述
风险评价
将把严重性和可能性合在一起来评价风险级别。
将采用如下方法来确定风险级别:
在此步将对风险优先性进行评价。
在进行评价之后,将风险级别和可检测性合并到一起来确定整体的风险优先性,通过如下方式对风险优先性进行评价:
用风险优先级别高低来决定适宜的控制方法并确定验证工作的范围。
7.3风险控制
风险评估结果(风险优先结果为高或中)用于确定合理的控制措施。
应具有选择范围来基于识别的风险提供所需的控制措施。
7.4风险降低
1、当风险超过了其可接受水平时,采用质量风险降低和避免程序。
风险降低可包括降低危害的严重性和可能性时所采取的措施。
提高危害和质量风险的可检测性的程序也被用作风险控制策略的一部分。
在实施风险降低措施的过程中,新的风险可能也会被引入到系统中,或者提高了其它已有风险的显着性。
因此,合适的做法应当是重新进行风险评估,以确认和评价可能的风险变更。
2、推荐的控制措施
1) 工艺设计或系统设计的更改;
2) 外部规程的应用;
3) 增加技术规格的详细信息或格式;
4) 增加检查确认工作的程度或力度;
5) 其他。
3、采取行动
如适用的话,则简要描述实际采取的控制行动。
4、风险再评估
针对计划应用的风险控制措施,以再次确认严重性、可能性和可检测性,并确认实施措施后的风险优先性。
5、责任人及指定日期
根据计划采取的控制行动指定责任人和完成日期。
7.5风险接受
1、是接受风险的决定。
风险接受可以是接受残余风险的正式决议,也可以是一个被动决议,其中并没有指定残余风险。
对于某些类型的危险,即使最好的质量风险管理也不能完全消除风险。
在这些情况下,可以认为已经应用了最佳质量风险管理策略且质量风险也降低到了一个可接受水平。
2、风险接受的类型如下:
1) 当风险优先性为低时为风险可控;
2) 当风险优先性为中时为风险降低但仍存在剩余风险,需要接受剩余风险;
3) 当风险优先性为高时需重新进行风险评估,检查是否正确的识别、分析和评价了风险,并采取了相应的风险控制措施;
风险控制矩阵
例:
定期进行审核以确保建议的措施能有效降低风险,并且不会给工艺带来新风险。
审核和更新的执行应基于变更控制事件和响应,或发现的重要新信息或数据的,例如:失败、偏差、调查及其他纠正预防措施。
7.7风险沟通
将对确定风险,建议,措施的执行和剩余风险形成一份报告来供审核和批准。
风险评估文件将被维护并遵循变更控制。
总结:
1、C QA&CPP是工艺验证的关注内容
2、F MEA工具是ICH Q9 推荐风险管理工具
3、C QA&CPP评估需要不同的SME参与
4、. CQA&CPP评估应关注工艺先前知识
5、。
