第十章 食品中元素含量的测定
食品分析(教学大纲)
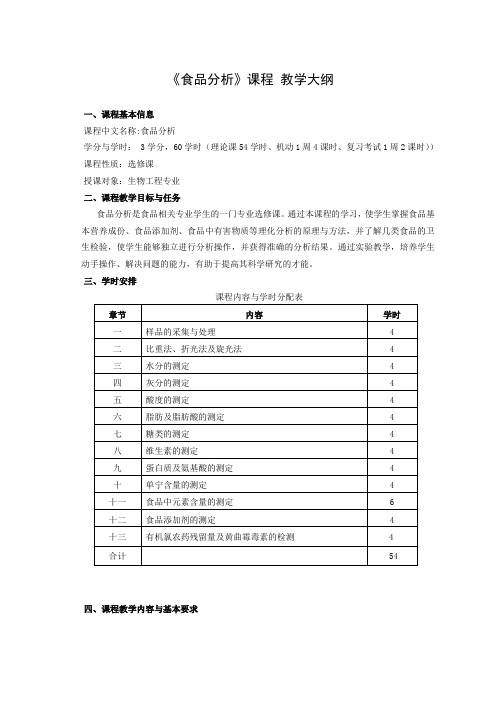
《食品分析》课程教学大纲一、课程基本信息课程中文名称:食品分析学分与学时: 3学分,60学时(理论课54学时、机动1周4课时、复习考试1周2课时))课程性质:选修课授课对象:生物工程专业二、课程教学目标与任务食品分析是食品相关专业学生的一门专业选修课。
通过本课程的学习,使学生掌握食品基本营养成份、食品添加剂、食品中有害物质等理化分析的原理与方法,并了解几类食品的卫生检验,使学生能够独立进行分析操作,并获得准确的分析结果。
通过实验教学,培养学生动手操作、解决问题的能力,有助于提高其科学研究的才能。
三、学时安排课程内容与学时分配表四、课程教学内容与基本要求绪论教学目的:介绍食品分析的定义、发展历史及发展方向。
基本要求:掌握食品分析的定义,领会食品分析的作用和内容,了解食品分析的发展趋势。
重点与难点:食品分析的定义,食品分析的内容教学方法:以课堂讲授为主,辅以小组讨论主要内容:食品分析的定义和作用、食品分析的内容和方法、食品分析的发展趋势。
第一章样品的采集与处理教学目的:介绍食品分析样品采集与处理的一般知识。
基本要求:了解采样的种类和数量要求,掌握食品分析中样品预处理的方法,明确本章的基本概念。
重点与难点:样品的制备与处理教学方法:课堂讲授主要内容:样品的采集、制备及保存,样品预处理,分析方法的评价,食品分析的误差与数据处理。
第二章比重法、折光法及旋光法教学目的:介绍比重法、折光法及旋光法的概念、原理及测定方法。
基本要求:要求学生通过本章的学习,掌握比重法、折光法和旋光法的测定原理、测定方法及注意事项,熟练掌握仪器的使用方法。
能够检验食品搀假情况及加工、运输、储藏过程中的污染情况。
重点与难点:比重法、折光法和旋光法的测定原理教学方法:课堂讲授主要内容:比重法、折光法和旋光法的测定原理、测定方法及注意事项第三章水分的测定教学目的:使学生掌握各种食品中水分的测定方法。
基本要求:通过本章学习要求学生了解食品中水分含量;掌握食品中水分存在的形式以及常见的几种水分测方法;熟练掌握重量法测定水分的原理及操作技术。
食品分析理论第十章 维生素的测定_OK

• 1、微生物法:根据某种维生素是某种细菌生长所必需的原理,以细 菌繁殖程度或代谢产物定量该维生素含量,方法选择性较高,多用 于水溶性维生素检测,适用于检测多种衍生物的总和(如总叶酸), 是经典方法。但微生物法操作繁琐、耗时过长,而且要求有特殊设 备和专门的训练人员。
• 2、比色法 可见分光光度、紫外分光光度
2021/7/3
16
(二)测定方法
• 维生素D的测定方法有:比色法、荧光法、紫外分光 光度法、气相色谱法、液相色谱法及薄层层析法等。
• 比色法灵敏度较高,但操作十分复杂、费时。
• 气相色谱法虽然操作简单,精密度也高,但灵敏度 低,不能用于含微量维生素D的样品。
• 液相色谱法的灵敏度比比色法高20倍以上,且操作简 便,精度高,分析速度快。是目前分析维生素D的最 好方法。
2021/7/3
14
• 胡萝卜素一般存在于植物性食品中,以含有胡萝卜为食物家 禽、兽类、水产动物及其加工产品,为着色而添加胡萝卜素 的食品,也含有胡萝卜素。
• 胡萝卜素对热及酸、碱比较稳定,但紫外线和空气中的氧可 促进其氧化破坏。用有机溶剂从食物中提取。
• 胡萝卜素本身是一种色素,在450nm波长处有最大吸收。胡 萝卜素常与叶绿素、叶黄素等共存,在测定前,必须将胡萝 卜素与其它色素分开。常用的方法有纸层析、柱层析和薄层 层析法,下面介绍的是纸层析法。
• ②、操作时加入乙酰氯可以消除温度的影响,可使 灵敏度比仅用三氯化锑提高约3倍。并可减少部分甾 醇的干扰。
• ③、此法不能区分D2和D3测定值是两者的总量。
2021/7/3
18
B、高效液相色谱法
• 1、原理 • 试样经皂化后,用苯提取不皂化物,馏去苯后,使用第一阶段的分
食品通用检测技术:有毒有害物质(有害元素的测定)

试样测定
食品中总汞的测定
❖试样测定 ①标准曲线制作
分别吸取50ng/ml汞标准使用液0.00mL、0.20mL、0.50 mL、1.00mL、1.50ml、2.00 ml、2.50mL于50ml容量瓶中,用硝酸溶液(1+9)稀释至刻度,混匀。各 自相当于汞浓度为0.00ng/mL、0.20ng/mL、0.50 ng/mL、1.00 ng/mL、1.50 ng/mL、2.00 ng/mL、2.50ng/ml。
Thank You !
第一法原子荧光光谱分析法
食品中总汞 的测定
原理:试样经酸加热消解后,在酸性介 质中,试样中汞被硼氢化钾或硼氢化钠 还原成原子态汞,由载气(氩气)带入 原子化器中,在汞空心阴极灯照射下, 基态汞原子被激发至高能态,在由高能 态回到基态时,发射出特征波长的荧光 ,其荧光强度与汞含量成正比,与标准 系列溶液比较定量。
铅的测定
分析步骤 (2)试样前处理 湿法消解 微波消解 压力罐消解
铅的测定
分析步骤
③ 测定 标准曲线的制作 试样溶液的测定 在与测定标准溶液相同的实验条件下, 将10 μL 空白溶液或试样溶液同时注入石墨炉, 原子化后测其吸光度值, 与标准系列比较定量。
铅的测定
分析结果的表述
试样中铅的含量按式
食品中有毒有害物质的 检测
食品中有害元素的测定
有害Байду номын сангаас素定 义
食品中所包含 的金属元素和 非金属元素约 80种。
可分为3类
常量元素 微量元素 有害元素
有害元素定义
不是人体需要的元素, 而且摄入较小的量会对 人体健康造成危害。
1.可不可以 对样品中的 元素直接测 定呢?
食品中金属元素的检测方法-食品安全快速检测网

食品中金属元素的检测方法近年来随着工业技术的发展,有越来越多的农药化肥用于农业耕作中,这导致一些有害金属元素如铅、镉、铜、汞等进入食品中。
这些金属元素随食物进入人体内,会转变成具有高毒性的化合物。
而且多数金属具有蓄积性,半衰期较长,能产生急性和慢性毒性反应,还有可能产生致畸、致癌和致突变的作用。
自我国加入WTO后,食品安全受到了政府和人民更广泛的关注,而食品中有害金属元素的检测问题也变得日趋重要。
目前常用于食品中金属元素的检测方法有物理法、化学法及生物法,以下将分别进行介绍。
物理法1、光谱法(1)原子吸收光度法原子吸收光光度法(Atomic Absorption Spectrometry,AAS)是基于被测元素基态原子在蒸气状态对其原子共振辐射的吸收进行元素定量分析的一种方法。
AAS具有灵敏度高(ng/mL-pg/mL、准确度高、选择性高、分析速度快等优点。
但是,AAS也存在不足,即不能多元素同时分析。
AAS是国家标准所规定的用于检测砷(GB/T5009。
11-2003)、铅(GB/T5009.12—2003)、铜(GB/T5009。
13-2003)、锌(GB/T5009.14-2003)、镉(GB/T5009.15—2003)、汞(GB/T5009。
17-2003)等元素的方法。
B.Demi等人使用AAS检测面包中铁、铜、锌、铅和钙等金属离子的含量,测出了这些离子的平均含量,取得了满意的结果。
(2)原子发射光谱法原子发射光谱法(Atomic Emission Spectroscopy,AES)是根据原子或离子在电能或热能激发下离解成气态的原子或离子后所发射的特征谱线的波长及其强度测定物质的化学组成和含量的分析方法。
AES操作简单,分析速度快;具有较高的灵敏度(ng/mL—pg/mL)和选择性;试剂用量少,一般只需几克至几十毫克;微量分析准确度高;使用原子发射仪测定,仪器较简单;可以定性及半定量的检测食品中的金属元素。
《食品分析》课件——第十章 维生素的测定

维生素A存在于动物性脂肪中,主要来源于 肝脏、鱼干油、蛋类、乳类等动物性食品中。植 物性食品中不含VA,但在深色果蔬中含有胡萝卜 素,它在人体内可转变为VA,故称为VA原。
11
12
思考题
1、高效液相色谱法测定食物中VA、VE的原理?样品处理方法 ?测定步骤?
2、高效液相色谱法测定食物中VA、VE的样品皂化的流程、用 具、试剂?
浓缩
将洗涤后的醚层经无水硫酸钠(约3g)滤入250mL旋转蒸发瓶 或氮气浓缩管中,用约15mL石油 醚冲洗分液漏斗及无水硫酸 钠2次,并入蒸发瓶内,并将其接在旋转蒸发仪或气体浓缩仪上, 于40℃水 浴中减压蒸馏或气流浓缩,待瓶中醚液剩下约2mL 时,取下蒸发瓶,立即用氮气吹至近干。用甲醇分 次将蒸发瓶 中残留物溶解并转移至10mL容量瓶中,定容至刻度。溶液过 0.22μm 有机系滤膜后供高 效液相色谱测定。
标准曲线的制作
本法采用外标法定量。将维生素 A 和维生素 E标准系列工作溶 液分别注入高效液相色谱仪中,测 定相应的峰面积,以峰面积为 纵坐标,以标准测定液浓度为横坐标绘制标准曲线,计算直线回 归方程。
样品测定
试样液经高效液相色谱仪分析,测得峰面积,采用外标法通过上 述标准曲线计算其浓度。在测定过 程中,建议每测定10个样品 用同一份标准溶液或标准物质检查仪器的稳定性。
第十章 维生素的测定
1
【教学目标与要求】
1.教学目标:能够根据不同测定方法对样品进行 预处理,对常用维生素能够正确测定其含量。
2.教学要求:通过本章学习,要求学生了解维生 素对人体健康的重要性。理解脂溶性维生素和 水溶性维生素的处理方法,掌握VA、VD、VE和 VB1、VC的测定方法。
【教学重点与难点】
食品中多元素的测定

食品中多元素的测定一、引言食品中的多元素测定是食品安全监测的重要内容之一。
随着人们对食品安全的关注度增加,食品中的多元素成分分析变得越来越重要。
本文将从多个方面探讨食品中多元素的测定方法和意义。
二、食品中多元素的意义食品中的多元素成分对于人体健康至关重要。
不同的元素在人体内发挥着不同的作用,如钙、铁、锌等元素是人体必需的微量元素,它们参与维持人体正常的生理功能;而重金属元素如铅、汞、镉等则是有害元素,过量摄入可能会对人体健康造成危害。
因此,准确测定食品中的多元素含量对于保障人体健康具有重要意义。
三、食品中多元素的测定方法3.1 原子吸收光谱法原子吸收光谱法是一种常用的食品中多元素测定方法。
该方法基于元素对特定波长的光的吸收特性进行测定。
通过将食品样品原子化,使其吸收特定波长的光,从而测定其中元素的含量。
原子吸收光谱法具有灵敏度高、准确度高的优点,广泛用于食品中钙、铁、锌等元素的测定。
3.2 电感耦合等离子体质谱法电感耦合等离子体质谱法(ICP-MS)是一种高灵敏度、高选择性的多元素测定方法。
该方法利用电感耦合等离子体将样品原子化,再利用质谱仪进行元素的定量分析。
ICP-MS具有快速、准确的优点,适用于食品中微量元素和有害元素的测定。
3.3 X射线荧光光谱法X射线荧光光谱法是一种无损、快速的多元素测定方法。
该方法利用样品受到X射线照射后产生的荧光光谱进行元素的定量分析。
X射线荧光光谱法具有样品准备简单、分析速度快的优点,适用于食品中多元素的快速筛查。
四、食品中多元素的测定步骤食品中多元素的测定通常包括样品的制备、仪器的校准和测定等步骤。
以下是一个常见的测定步骤:1.样品的制备–将食品样品经过粉碎和均匀混合,保证样品的代表性。
–根据不同元素的测定要求,选择适当的提取方法,如酸溶解、微波消解等。
2.仪器的校准–根据测定元素的特点,选择适当的标准物质进行校准。
–制备一系列不同浓度的标准溶液,进行曲线拟合和校准。
食品中多元素的测定 标准文本(食品安全国家标准)

食品安全国家标准食品中多元素的测定1.范围本标准规定了食品中多元素测定的第一法电感耦合等离子体质谱法(ICP-MS);第二法电感耦合等离子体发射光谱法(ICP-OES)。
本标准适用于食品中铅、镉、砷、汞、硒、铬、锡、铜、铁、锰、锌、镍、铝、锑、钾、钠、钙、镁、硼、钡、锶、钼、铊、钛、钒、钴的ICP-MS 测定;食品中钾、钠、钙、镁、铁、锰、镍、铜、锌、磷、硼、钡、铝、锶、钒、钛的ICP-OES 测定。
第一法电感耦合等离子体质谱法(ICP-MS)2.原理样品经消解后,消解液以气溶胶形态引入电感耦合等离子体质谱仪测定。
根据各元素特定质量数(质荷比, m/z )进行分离定性;对于一定的质荷比,其质谱的信号强度与进入质谱仪的粒子数成正比,即质谱信号强度与样品中元素浓度成正比。
采用内标校正法,通过测定目标元素与内标元素的质谱信号强度比对试样溶液中的元素进行定量分析。
3.试剂和材料注1:除非另有说明,本方法所用试剂均为优级纯,水为GB/T 6682规定的一级水。
3.1 试剂3.1.1硝酸(HNO3):经亚沸蒸馏或采用高纯试剂或优级纯试剂。
3.1.2 氩气(Ar):高纯氩气(>99.99%)或液氩。
3.1.3 氦气(He):高纯氦气(>99.99%)。
3.1.4 金(Au):金单元素标准溶液(1000 mg/L)3.2 试剂配制3.2.1 硝酸溶液(5+95):取50 mL硝酸,缓慢加入950 mL 水中,用水稀释至1000 mL。
3.2.2 汞标准稳定剂:取2mL单元素金(Au,1000 mg/L)标准溶液,用硝酸溶液(5+95)稀释至1000 mL,用于汞标准溶液的配制。
注 2:汞标准稳定剂亦可采用2 g/L 半胱氨酸盐酸盐+ 硝酸(5+95)混合溶液,或其它等效稳定剂。
3.3 标准品3.3.1 元素贮备液(1000 mg/L或100 mg/L):铅、镉、砷、汞、硒、铬、锡、铜、铁、锰、锌、镍、铝、锑、钾、钠、钙、镁、硼、钡、锶、钼、铊、钛、钒和钴,采用有证标准物质单元素或多元素标准贮备液,贮备液以稀硝酸介质为佳。
原子吸收光谱法测定食品中金属元素的含量的实验方案

原子吸收光谱法测定食品中金属元素的含量一、实验目的1.进一步了解和熟悉原子吸收光谱法的基本原理和仪器结构。
2.熟悉掌握几种元素分析的前处理方法及基本操作。
3.掌握利用原子吸收光谱法测定食品样品及原材料中金属元素的含量。
4.掌握气体钢瓶的使用及维护。
二、实验原理原子吸收光谱法(atomic absorption spectrometry, AAS )是指物质所产生的气态的基态原子对特征光谱辐射具有吸收能力的现象。
当辐射投射到原子蒸汽上时,如果辐射波长相应的能量等于原子由基态跃迁到激发态所需要的能量时,就会引起原子对辐射的吸收,产生吸收光谱,通过测量气态原子对特征波长(或频率)的吸收,便可获得有关组成和含量的信息。
原子吸收光谱通常出现在可见光区和紫外区。
一个原子可具有多种能级状态,最低的能态称为基态。
如果原子接受外界能量使其激发至最低激发态(即第一激发态E 1),而后又回到基态所发射出的辐射即为“共振线”。
相反,基态原子的外层电子吸收共振辐射也可从基态跃迁至最低激发态。
在一定的温度下,激发态原子数与基态原子数具有一定的比例。
由计算可知,绝对温度小于3000K 时,激发态原子数与基态原子数的比值是很小的,即与处于基态的原子数相比,处于激发态的原子数可以忽略不计。
因此,可认为基态原子数近似等于待测元素的总原子数。
原子吸收服从朗伯-比尔定律,在一定浓度范围内,待测元素的吸光度与其在待测溶液中的浓度成正比。
即:kcL I I A ==)/lg(0,其中:I 0和I 分别为频率为f 的入射光和透射光的强度,c 为待测溶液中该元素的浓度,k 为摩尔吸光系数,L 为光线通过样品的光程。
本实验采用湿法消解法将样品进行前期消化,然后利用空气乙炔火焰法将样品进行原子化,样品中的待测元素能够迅速处在基态,并且基态原子能在特定光源的激发下跃迁为激发态,同时伴有特定原子吸收光谱的产生。
这样我们利用这种特定的原子吸收光谱对样品中的待测元素进行定性和定量的检测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(三)H2SO4—HClO4消化法
取样品5g于250mL凯氏瓶中→加浓 H2SO410mL电炉上低温加热至至黑色粘稠状→滴 加高氯酸2mL加热,至溶液澄清透明为止→再加热 20分钟→冷却后加入10mL水稀释,移入50mL容 量瓶中,定容,摇匀供测定用。
第二节 钙的测定——EDTA滴定法
一、原理
EDTA是一种氨羧络合剂,在不同的pH条件下可
此法不适合于测定易挥发的元素。
1、直接灰化法
适用于含Fe、Cu、Pb、Zn的样品有机物的破坏。
固体样品
称取均匀样品5g→电炉低温炭化→高温炉(500℃) 中灰化→冷却后加入2mL6mol/LHCl或HNO3溶液 →水浴上加热至干→加水溶解→将溶液完全转入 50mL容量瓶定容摇匀供测定用。
液体样品
取25mL试液于蒸发皿中→水浴上蒸干→按固体样 品处理。
汞、镉、铅、砷等。
二、测定意义
1、对于评价食品的营养价值,开发和生产强化食 品具有指导意义。
2、有利于食品加工工艺的改进和食品质量的提高。
3、保证食品的安全和食用者的健康。
三、食品中矿物质元素的分离方法
(一)干法灰化
是将样品在一定温度下灼烧,有机物质变成水和 二氧化碳,无机元素留在灰分中,取灰分作元素分 析。
第十章 食品中元素含量的测定
第一节 食品中重要矿物质元素及测定意义 第二节 钙的测定——EDTA滴定法 第三节 氯的测定 思考题
第一节 食品中重要矿物质元素及测定意义
一、食品中矿物质元素 1、常量元素
钙、镁、磷、钠、钾、氯、硫。 2、微量元素
铁、锌、铜、锰、镍、钴、铜、硒、铬、碘、 氟、锡、硅、钒等14种。 3、有毒元素
终点时 EDTA十NN-Ca) 钙指示剂 0.1%的酒精溶液。
(2)1%KCN或NaCN溶液
(3)0.05mol/L柠檬酸纳溶液
(4)2mol/LNaOH溶液
(5) HCl溶液(1+1)
(6) HCl溶液(1+4)
(7)钙标准溶液 准确称取0.4994g在110℃烘干2小时并 于干燥器中冷却的CaCO3基准物质于250mL烧杯中,先 用少量水润湿,盖上表面皿,缓慢加入 6mol/LHCl10mL,使之溶解,转入100mL容量瓶中, 用水稀释至刻度,摇匀。此溶液每毫升含钙0.2mg(TCa)。
称取样品2g于l50或250mL凯氏瓶中→加入10ml 浓H2SO4 →电炉上低温加热至瓶内硫酸开始冒白烟后 5分钟为止→将凯氏瓶移开电炉,稍冷却→逐滴加入 30%H2O22mL →加热2分钟→反复处理至瓶内溶液 完全无色为止→加热5分钟→冷却后移入50mL容量瓶 中,用水定容,摇匀供测定用。
同时作试剂空白。
2、氢氧化钙法
适用于含As样品有机物的破坏。
取均匀样品5g于瓷蒸发皿中→加入无砷氢氧化钙 5g →电炉低温炭化至无烟→置于500-580℃高温炉 完全灰化→冷却→加入6mol/LHCl溶液至灰分溶解 →转入50mL容量瓶中定容,摇匀供测定用。
固体样品加少量水,液体样品不加,以玻棒搅 拌均匀后,用滤纸擦净玻棒上的沾物,滤纸放
当凯氏瓶中颜色呈深棕色(NO2)后,及时补加2— 5mLHNO3,使瓶内溶液始终保持棕色或浅棕色,直到有机
物分解完全,不再有红棕色氧化氮产生,继续加热至产生 SO3白烟,此时溶液呈无色或微黄色
2、H2SO4-H2O2消化法
适用于含Fe和含脂肪高的食品,如糕点、罐头、肉 制品、乳制品等的有机物破坏。
入蒸发皿中
3、氢氧化钠法
适用于含Sn样品有机物的破坏。
称取5g样品→加入10%NaOH溶液3mL(液体样品 取样10mL,加入NaOH至呈碱性)→水浴蒸干→电炉 低温炭化至不冒烟→ 600℃灰化→加水5m1 →水浴蒸 干→加入10ml浓HCl,使残渣溶解→加入10mL水, 移入50mL容量瓶中,用6mol/LHCl溶液洗涤蒸发皿, 合并洗液,用6mol/LHCl稀释至刻度.摇匀供测定用。
蛋白质含量高的样品:除蛋白。
用水移至250mL容量瓶后,加入20%醋酸铅溶液1520mL,然后加入10%硫酸钠溶液大约10-20mL,在沸
水浴中煮30min后,冷却,稀释至刻度,过滤得样品液。
色泽过深的样品:称取样品5.00-10.00g于坩埚中, 在水浴上蒸干,小火炭化至内容物易压碎为止。用 水将炭化物移入100mL容量瓶中,加水至刻度,过 滤得样品液。
2、硝酸银滴定法测定食品中氯时,控制的酸度 范围是多少?为什么?
三、测定方法 1、样品处理
直接干法灰化制备试液 2、测定
准确吸取试液5ml(V2)放入100 mL三角瓶中,加蒸 馏水15mL,以下操作同EDTA的标定。记录EDTA用 量V3ml。同时用蒸馏水作空白试验,消耗EDTAV4mL。 3、结果计算
第三节 氯的测定 一、原理
用硝酸银标准溶液滴定样品中的Cl-,生成AgCl白 色沉淀,待全部Cl-沉淀完后,过量的AgNO3与铬酸 钾指示刘作用,生成桔红色Ag2CrO4沉淀,指示终 点到达。 滴定反应如下:
滴定过程中 Ag+十Cl-=AgCl↓白色 终点时 2Ag+十CrO42-=Ag2CrO4↓桔红色 由AgNO3的用量计算出Cl-的含量。
二、试剂和主要仪器 1.25m1棕色滴定管 2.5%K2CrO4溶液 3.0.05mol/LAgNO3标准溶液
三、测定步骤 1、样品处理 (1) 固体样品
称取10.00-20.00g的粉碎均匀样品→用100150mL蒸馏水移入250 mL容量瓶中→沸水浴中煮 30min →冷却→定容并过滤得样品液。
(2)液体样品
准确吸取样品溶液5m1于100ml容量瓶中, 加水稀释至刻度摇匀,得样品液。
2、测定
吸取制备好的样品液25mL于三角瓶中,加入酚 酞指示剂3-4滴,用0.1N氢氧化钠溶液滴定至淡粉 红色。加入10%铬酸钾指示剂0.5-1mL,用0.1N 硝酸银标准溶液滴定至桔红色在1min内不退色为 终点。
(8)0.01mol/LEDTA溶液 配制:
称取2gEDTA二钠盐于500mL烧杯中,加水溶解后 稀释至500mL。 标定:
准确吸取钙标准溶液10mL于100ml三角瓶中,加水 10mL,用2mol/LNaOH溶液(约l mL)调至中性,加 入1%KCN1滴,0.05mol/L柠檬酸2滴, 2mol/LNaOH 2m1,钙指示剂5滴,用EDTA溶液滴 定mL,,溶计液算由E酒DT红A色对变钙纯的蓝滴为定终度点:,纪录EDTA用量V1
与多种金属离子形成稳定的络合物。在pH≥12的溶
液中,Ca2+与EDTA定量作用,生成稳定的EDTA—Ca
配合物,因此可以直接确定。采用钙指示剂(简称
NN)为指示剂,溶液由酒红色变为纯蓝色即为滴定
终点,可计算出钙的含量。
滴定反应如下:
加入指示剂时 Ca2+十NN=NN-Ca
纯蓝 酒红色
滴定过程中 Ca2+十EDTA=EDTA-Ca
(二)湿法消化
1、HNO3-H2SO4消化法
适用于含Pb、As、Cu、Sn元素的测定。
取固体样品5g(或液体10mL)置于250或500mL凯 氏瓶中→加水10mL(液体样品不加) →加浓 HNO315mL →加浓H2SO410mL →放入数粒玻璃珠 加热直到有机物分解完全→放冷→加10-15m1饱和 (NH4)2C2O4溶液或者40mL水→加热煮沸直到有SO3 白烟为止→冷却后加入5m1水稀释,转入50m1容量 瓶中,定容,摇匀供测定用。
取100m1蒸馏水作空白试验。
四、结果计算
式中 C——AgNO3的浓度(mol/L) M——NaCl的摩尔质量(58.45g/mol)
m——样品质量或体积(g,或Ml ) U——分取倍数,即测定用样液体积/样液 总体积
思考题:
1、用EDTA滴定法测定食品中的钙时,加入氰 化钾起什么作用?使用时应注意哪些问题?废 液如何处理?
