第4讲 蛋白质的结构体系III
合集下载
-蛋白质的三维结构ppt课件
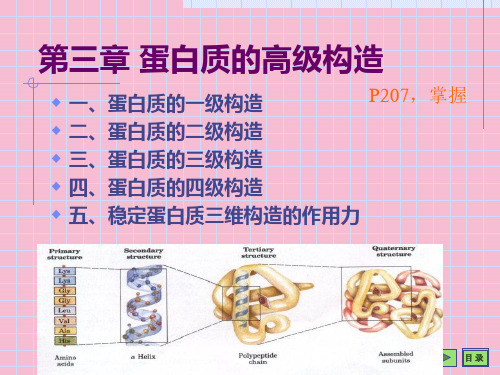
两个肽键衍生而来
目录
影响螺旋构成的要素〔P208,熟习〕
(1) R侧链对α-螺旋的影响
R侧链的大小和带电性决议了能否构成α-螺旋以及 构成的α-螺旋的稳定性。
① 多肽链上延续出现带同种电荷基团的氨基酸残基, (如Lys,或Asp,或Glu),那么由于静电排斥,不能 构成链内氢键,从而不能构成稳定的α-螺旋。如多聚 Lys、多聚Glu。而当这些残基分散存在时,不影响α螺旋稳定。
目录
β-凸起(了解)
β-凸起是一种小片的非反复性构 造,能单独存在,大多数经常作 为反平行β-折叠片中的一种不规 那么情况而存在。 β-凸起可以为是β-折叠股中额外 插入的一个残基,它使得在两个 正常氢键之间、在凸起折叠股上 是两个残基,而另一侧的正常股 上的一个残基。 β-凸起可引起多肽链方向的改动, 但改动的程度不如β-转角。
目录
〔1〕超二级构造〔掌握〕
在蛋白质分子中,由假
αα
设干相邻的二级构造单元组
合在一同,彼此相互作用,
构成有规那么的、在空间上
能识别的二级构造组合体。
几种类型的超二级构造:
ββ
αα;ββ;βαβ;
★超二级构造在构造层
次上高于二级构造,但没有
聚集成具有功能的构造域.
βαβ
目录
〔2〕构造域〔P222,掌握〕 多肽链在二级构造或超二级构造的根底 上构成三级构造的部分折叠区,它是相对 独立的严密球状实体,称为构造域。 *对于那些较小的蛋白质分子或亚基来说, 构造域和三级构造是一个意思,也就是说 这些蛋白质或亚基是单构造域的,如红氧 还蛋白、肌红蛋白等; *对于较大的球状蛋白质或亚基,其三级 构造往往由两个或多个构造域缔合而成也
我国1965年在世界上第一个用化学方法人工合成 的蛋白质就是这种牛胰岛素。
蛋白质分子结构

特征:多肽 链中氨基酸 残基n的羰基 上的氧与残 基 ( n+3 ) 的 氮原上的氢 之间形成氢 键,肽键回 折1800 。
无
规
则
卷
曲
无规则卷曲
示
意
图
细胞色素C的三级结构
蛋白质分子中那些没有确定规律性的部分肽链构象称为无规卷曲。
三、蛋白质的三级结构
(一) 定义
整条肽链中全部氨基酸残基的相对空间位置。 即肽链中所有原子在三维空间的排布位置,包括 主链和侧链。三级结构的形成使得在序列中相隔 较远的氨基酸侧链相互靠近。 主要的化学键
亚基之间的结合力主要是疏水作用,其次 是氢键和离子键。
-亚基
如:血红蛋白含有四个亚基,为22,血红素 每个亚基含一个血红素,每个血红素 Fe2
+
可结合一个氧分子。亚基含141个氨 基酸残基,亚基含146个氨基酸残基。 -亚基
-亚基
血红素 Fe2
+
-亚基
第五节 蛋白质结构与功能的关系
一、蛋白质一级结构与功能的关系
疏水键、离子键、氢键和 Vander Waals力等。
目录
肌红蛋白 (Mb) 的三级结构
C 端
N端
四、蛋白质的四级结构
有些蛋白质分子含有二条或多条多肽链, 每一条多肽链都有完整的三级结构,称为蛋白 质的亚基 (subunit)。
蛋白质分子中各亚基的空间排布及亚基接 触部位的布局和相互作用,称为蛋白质的四级 结构。
蛋白质构象改变导致疾病的机理:有些蛋 白质错误折叠后相互聚集,常形成抗蛋白水解 酶的淀粉样纤维沉淀,产生毒性而致病,表现 为蛋白质淀粉样纤维沉淀的病理改变。
这类疾病包括:人纹状体脊髓变性病、老 年痴呆症、亨停顿舞蹈病、疯牛病等。
无
规
则
卷
曲
无规则卷曲
示
意
图
细胞色素C的三级结构
蛋白质分子中那些没有确定规律性的部分肽链构象称为无规卷曲。
三、蛋白质的三级结构
(一) 定义
整条肽链中全部氨基酸残基的相对空间位置。 即肽链中所有原子在三维空间的排布位置,包括 主链和侧链。三级结构的形成使得在序列中相隔 较远的氨基酸侧链相互靠近。 主要的化学键
亚基之间的结合力主要是疏水作用,其次 是氢键和离子键。
-亚基
如:血红蛋白含有四个亚基,为22,血红素 每个亚基含一个血红素,每个血红素 Fe2
+
可结合一个氧分子。亚基含141个氨 基酸残基,亚基含146个氨基酸残基。 -亚基
-亚基
血红素 Fe2
+
-亚基
第五节 蛋白质结构与功能的关系
一、蛋白质一级结构与功能的关系
疏水键、离子键、氢键和 Vander Waals力等。
目录
肌红蛋白 (Mb) 的三级结构
C 端
N端
四、蛋白质的四级结构
有些蛋白质分子含有二条或多条多肽链, 每一条多肽链都有完整的三级结构,称为蛋白 质的亚基 (subunit)。
蛋白质分子中各亚基的空间排布及亚基接 触部位的布局和相互作用,称为蛋白质的四级 结构。
蛋白质构象改变导致疾病的机理:有些蛋 白质错误折叠后相互聚集,常形成抗蛋白水解 酶的淀粉样纤维沉淀,产生毒性而致病,表现 为蛋白质淀粉样纤维沉淀的病理改变。
这类疾病包括:人纹状体脊髓变性病、老 年痴呆症、亨停顿舞蹈病、疯牛病等。
生物化学 蛋白质的结构课课件

上具有相对固定的二面角
学习交流PPT
23
不同二级结构的拉氏图
学习交流PPT
24
α螺旋的主要内容
① 肽链骨架围绕一个轴以螺旋的方式伸展;
② 螺旋形成是自发的,肽链骨架上由n位氨基酸残基上 的-C=O与n+4位残基上的-NH之间形成的氢键起着稳 定的作用。被氢键封闭的环含有13个原子,因此α螺 旋也称为3.613-螺旋;
学习交流PPT
10
蛋白质大小的多样性
蛋白质可大可小
☻胰岛素- A链(21aa)、 B链(30aa),大小为5.7k ☻大肠杆菌谷氨酰胺合成酶- 12个亚基组成,每一个亚
基含有 468aa。总大小为600k。 ☻α连接素(connectin):大小为28 00k! ☻β连接素:大小为2 100k,长达 1 000nm!
除了少数环状肽链 以外,其它肽链都
含有不对称的两端: 其中含有自由α-氨 基的一端被称为氨 基端或N端,含有 自由α-羧基的一端 称为羧基端或C端。
学习交流PPT
5
非核糖体合成肽与核糖体合成肽
学习交流PPT
6
寡肽的理化性质
1. 两性解离
˗ 肽也有等电点,其中小肽的pI的计算方法与氨基酸相似, 但复杂的寡肽只能与多肽和蛋白质一样不能计算,只能测 定(如使用等电聚焦的手段)。
学习交流PPT
38
蛋白质的三级结构
三级结构是指多肽链在二级结构的基础上,进一步盘绕、卷曲和 折叠,形成主要通过氨基酸侧链以次级键(有时还有二硫键和金 属配位键)维系的完整的三维结构。三级结构通常由模体(motif) 和结构域(domain)组成。稳定三级结构主要包括氢键、疏水键、 离子键、范德华力。
☺蛋白质是氨基酸的线性多聚物(≥51aa ) ☺1958年,Watson提出“中心法则”:DNA RNA
学习交流PPT
23
不同二级结构的拉氏图
学习交流PPT
24
α螺旋的主要内容
① 肽链骨架围绕一个轴以螺旋的方式伸展;
② 螺旋形成是自发的,肽链骨架上由n位氨基酸残基上 的-C=O与n+4位残基上的-NH之间形成的氢键起着稳 定的作用。被氢键封闭的环含有13个原子,因此α螺 旋也称为3.613-螺旋;
学习交流PPT
10
蛋白质大小的多样性
蛋白质可大可小
☻胰岛素- A链(21aa)、 B链(30aa),大小为5.7k ☻大肠杆菌谷氨酰胺合成酶- 12个亚基组成,每一个亚
基含有 468aa。总大小为600k。 ☻α连接素(connectin):大小为28 00k! ☻β连接素:大小为2 100k,长达 1 000nm!
除了少数环状肽链 以外,其它肽链都
含有不对称的两端: 其中含有自由α-氨 基的一端被称为氨 基端或N端,含有 自由α-羧基的一端 称为羧基端或C端。
学习交流PPT
5
非核糖体合成肽与核糖体合成肽
学习交流PPT
6
寡肽的理化性质
1. 两性解离
˗ 肽也有等电点,其中小肽的pI的计算方法与氨基酸相似, 但复杂的寡肽只能与多肽和蛋白质一样不能计算,只能测 定(如使用等电聚焦的手段)。
学习交流PPT
38
蛋白质的三级结构
三级结构是指多肽链在二级结构的基础上,进一步盘绕、卷曲和 折叠,形成主要通过氨基酸侧链以次级键(有时还有二硫键和金 属配位键)维系的完整的三维结构。三级结构通常由模体(motif) 和结构域(domain)组成。稳定三级结构主要包括氢键、疏水键、 离子键、范德华力。
☺蛋白质是氨基酸的线性多聚物(≥51aa ) ☺1958年,Watson提出“中心法则”:DNA RNA
蛋白质的结构知识要点总结ppt课件

特征
1、每隔3.6个AA残基螺 旋上升一圈,螺距0.54nm
2、螺旋体中所有氨基酸 残基R侧链都伸向外侧链中 的全部>C=0和>N-H几乎都 平行于螺旋轴
3、每个氨基酸残基的 >NH与前面第四个氨基酸残 基的>C=0形成氢键,肽链上 所有的肽键都参与氢键的形 成
7
(2)β-折叠 β-折叠(β结构或β构象)是一种重复性的结构,可以把它想
3
一 一级结构是蛩白质最基本的结构。研究一个蛋白质 的结构和功能。首先要测定氨基酸序列。 直接测定蛋白质的氨基酸序列是很困难的, Sanger 通过近10年的工作,于1953年完成了牛胰岛素51个氨基 酸的序列测定。因此而荣获了1958的诺贝尔化学奖。我 国科学家通力合作,于1965年人工合成了有活性的牛胰 岛素。 胰岛素由A、B两条肽链组成。A链由21个氨基酸组 成B链由30个氨基酸组成。A链和B链之间通过两对二硫 键相连另外A链内部6位和l1位上的两个半胱氨酸通过二 硫键相连形成链内小环,下图为牛胰岛素的一级结构。
12
2.超二级结构和结构域
①超二级结构 超二级结构指若干相邻的二级结构中的构象单元彼此
相互作用。形成有规则的,在空间上能辨认的二级结构组 合体,常见的有ααβ,βαβ,βαβαβ( Rossman折叠),ββ,β曲折和希腊图案拓扑结构等。 ②结构域 结枃域指多肽链在超二级结构基础上进一步绕曲折叠 成的近似球状的紧密结构。
4
二、蛋白质的空间结构
定义:蛋白质的空间结构通常称作蛋白质的构象,或 高级结构,是指蛋白质分子中所有原子在三维空间的分布 和肽链的走向。
一个天然蛋白质在一定条件下,往往只有一种或很少 几种构象,这是因为主链上有3是C-N键,不能自由旋转,另 两个可旋转的键所形成的φ角和Ψ角,也受到主链原子空 问位阻的限制。只有一小部分二面角的搭酉是空间位置 所允许的。此外,侧链R基团有大有小,相互间或者相斥, 或者吸引,使多肽链的构象数目受到进一步的限制。研究 蛋白质构象的主要方法有X射线衍射法、核磁共振法等。
1、每隔3.6个AA残基螺 旋上升一圈,螺距0.54nm
2、螺旋体中所有氨基酸 残基R侧链都伸向外侧链中 的全部>C=0和>N-H几乎都 平行于螺旋轴
3、每个氨基酸残基的 >NH与前面第四个氨基酸残 基的>C=0形成氢键,肽链上 所有的肽键都参与氢键的形 成
7
(2)β-折叠 β-折叠(β结构或β构象)是一种重复性的结构,可以把它想
3
一 一级结构是蛩白质最基本的结构。研究一个蛋白质 的结构和功能。首先要测定氨基酸序列。 直接测定蛋白质的氨基酸序列是很困难的, Sanger 通过近10年的工作,于1953年完成了牛胰岛素51个氨基 酸的序列测定。因此而荣获了1958的诺贝尔化学奖。我 国科学家通力合作,于1965年人工合成了有活性的牛胰 岛素。 胰岛素由A、B两条肽链组成。A链由21个氨基酸组 成B链由30个氨基酸组成。A链和B链之间通过两对二硫 键相连另外A链内部6位和l1位上的两个半胱氨酸通过二 硫键相连形成链内小环,下图为牛胰岛素的一级结构。
12
2.超二级结构和结构域
①超二级结构 超二级结构指若干相邻的二级结构中的构象单元彼此
相互作用。形成有规则的,在空间上能辨认的二级结构组 合体,常见的有ααβ,βαβ,βαβαβ( Rossman折叠),ββ,β曲折和希腊图案拓扑结构等。 ②结构域 结枃域指多肽链在超二级结构基础上进一步绕曲折叠 成的近似球状的紧密结构。
4
二、蛋白质的空间结构
定义:蛋白质的空间结构通常称作蛋白质的构象,或 高级结构,是指蛋白质分子中所有原子在三维空间的分布 和肽链的走向。
一个天然蛋白质在一定条件下,往往只有一种或很少 几种构象,这是因为主链上有3是C-N键,不能自由旋转,另 两个可旋转的键所形成的φ角和Ψ角,也受到主链原子空 问位阻的限制。只有一小部分二面角的搭酉是空间位置 所允许的。此外,侧链R基团有大有小,相互间或者相斥, 或者吸引,使多肽链的构象数目受到进一步的限制。研究 蛋白质构象的主要方法有X射线衍射法、核磁共振法等。
蛋白质的结构与功能ppt课件(完整版)全文
• 氨基酸残基(residue) :肽链中的氨基酸分 子因为脱水缩合而基团不全,被称为氨基 酸残基。
* 两分子氨基酸缩合形成二肽,三分子氨 基酸缩合则形成三肽……
* 由十个以内氨基酸相连而成的肽称为寡 肽(oligopeptide),由更多的氨基酸相 连形成的肽称多肽(polypeptide)。
* 多肽链(polypeptide chain)是指许多 氨基酸之间以肽键连接而成的一种结构。
3)运动与支持
机体的结构蛋白:头发、骨骼、牙齿、肌肉等
4)参与运输贮存的作用
血红蛋白 ——运输氧 铜蓝蛋白 ——运输铜 铁蛋白 ——贮存铁
5)免疫保护作用
抗原抗体反应 凝血机制
6)参与细胞间信息传递
信号传导中的受体、信息分子等
7) 氧化供能Βιβλιοθήκη 第一节蛋白质的分子组成
The Molecular Component of Protein
4. 无规卷曲
无规卷曲是用来阐述没有确定规律性的那部 分肽链结构。
(三)模体(motif)
在许多蛋白质分子 中,可发现二个或三个 具有二级结构的肽段, 在空间上相互接近,形 成一个特殊的空间构象, 被称为模体
钙结合蛋白中 结合钙离子的模体
锌指结构
螺旋-折叠-折叠 2个His和2个Cys 与Zn离子结合 螺旋区 与 DNA 结合
子,占人体干重的45%,某些组织含量更 高,例如脾、肺及横纹肌等高达80%。
大事记:
1833年 Payen和Persoz分离出淀粉酶。 1864年 Hoppe-Seyler从血液分离出血红蛋
白,并将其制成结晶。 19世纪末 Fischer证明蛋白质是由氨基酸组成
的,并将氨基酸合成了多种短肽 。 1938年 德国化学家Gerardus J. Mulder引用
* 两分子氨基酸缩合形成二肽,三分子氨 基酸缩合则形成三肽……
* 由十个以内氨基酸相连而成的肽称为寡 肽(oligopeptide),由更多的氨基酸相 连形成的肽称多肽(polypeptide)。
* 多肽链(polypeptide chain)是指许多 氨基酸之间以肽键连接而成的一种结构。
3)运动与支持
机体的结构蛋白:头发、骨骼、牙齿、肌肉等
4)参与运输贮存的作用
血红蛋白 ——运输氧 铜蓝蛋白 ——运输铜 铁蛋白 ——贮存铁
5)免疫保护作用
抗原抗体反应 凝血机制
6)参与细胞间信息传递
信号传导中的受体、信息分子等
7) 氧化供能Βιβλιοθήκη 第一节蛋白质的分子组成
The Molecular Component of Protein
4. 无规卷曲
无规卷曲是用来阐述没有确定规律性的那部 分肽链结构。
(三)模体(motif)
在许多蛋白质分子 中,可发现二个或三个 具有二级结构的肽段, 在空间上相互接近,形 成一个特殊的空间构象, 被称为模体
钙结合蛋白中 结合钙离子的模体
锌指结构
螺旋-折叠-折叠 2个His和2个Cys 与Zn离子结合 螺旋区 与 DNA 结合
子,占人体干重的45%,某些组织含量更 高,例如脾、肺及横纹肌等高达80%。
大事记:
1833年 Payen和Persoz分离出淀粉酶。 1864年 Hoppe-Seyler从血液分离出血红蛋
白,并将其制成结晶。 19世纪末 Fischer证明蛋白质是由氨基酸组成
的,并将氨基酸合成了多种短肽 。 1938年 德国化学家Gerardus J. Mulder引用
生物化学2.6.2 蛋白质的超二级结构以及三级、四级结构

(a)
羧肽酶
(b)
腺苷酸激酶
2.结构域(structure domain)
结构域: 多肽链在二级结构或超二级结构的基础上形成三级
结构的折叠区,这种相对独立的紧密球状实体就是结构域 (structure domain)或简称域(domain)。
★ 结构域是多肽链的独立折叠单位,
一般由100-200个氨基酸残基构成
主讲教师:尹春光
蛋白质的空间结构:
α-螺旋 β-折叠 β-转角 无规卷曲
1.超二级结构(super secondary structure):
超二级结构 • 由若干个相邻的二级结构单元(α-螺旋、β-折叠、β-转角
及无规卷曲)组合在一起,彼此相互作用,形成有规则的、 在空间上能够辨认的二级结构组合体 。
• 疏水相互作用力、氢 键、范德华力、盐键
氢键
范德华力
疏水相互作用
离子键
稳定蛋白质空间
范德华力 离子键
四. 蛋白质的四级结构
亚基: • 自然界很多蛋白质是以独立折叠的球状多肽链
聚集体形式存在,这些具有三级结构的多肽链 称为亚基。
四. 蛋白质的四级结构
蛋白质四级结构(quaternary stucture): • 亚基通过非共价键相互作用彼此缔合在一起 ,亚基的
缔合方式或组织方式称为蛋白质四级结构(quaternary stucture)。
超二级结构基本类型 • αα;ββ;βαβ;
(1)αα结构(复绕α-螺旋)
(2)βxβ结构(βαβ)
x:无规卷曲 x:α-螺旋
(3)α-螺旋-β转角- α-螺旋
超二级结构
αα
β×β
βαβ(两个:Rossman折叠)
羧肽酶
(b)
腺苷酸激酶
2.结构域(structure domain)
结构域: 多肽链在二级结构或超二级结构的基础上形成三级
结构的折叠区,这种相对独立的紧密球状实体就是结构域 (structure domain)或简称域(domain)。
★ 结构域是多肽链的独立折叠单位,
一般由100-200个氨基酸残基构成
主讲教师:尹春光
蛋白质的空间结构:
α-螺旋 β-折叠 β-转角 无规卷曲
1.超二级结构(super secondary structure):
超二级结构 • 由若干个相邻的二级结构单元(α-螺旋、β-折叠、β-转角
及无规卷曲)组合在一起,彼此相互作用,形成有规则的、 在空间上能够辨认的二级结构组合体 。
• 疏水相互作用力、氢 键、范德华力、盐键
氢键
范德华力
疏水相互作用
离子键
稳定蛋白质空间
范德华力 离子键
四. 蛋白质的四级结构
亚基: • 自然界很多蛋白质是以独立折叠的球状多肽链
聚集体形式存在,这些具有三级结构的多肽链 称为亚基。
四. 蛋白质的四级结构
蛋白质四级结构(quaternary stucture): • 亚基通过非共价键相互作用彼此缔合在一起 ,亚基的
缔合方式或组织方式称为蛋白质四级结构(quaternary stucture)。
超二级结构基本类型 • αα;ββ;βαβ;
(1)αα结构(复绕α-螺旋)
(2)βxβ结构(βαβ)
x:无规卷曲 x:α-螺旋
(3)α-螺旋-β转角- α-螺旋
超二级结构
αα
β×β
βαβ(两个:Rossman折叠)
生物化学 蛋白质的三维结构讲课文档

➢二硫键绝大多数情况下二硫键是在多肽链的β-转角附近形成的。。假 如二硫键的形成并不规定多肽链的折叠,然而一旦蛋白质采取了它的三 维结构则二硫键的形成将对此构象起稳定作用,蛋白质中所有的二硫键相 继被还原将引起蛋白质的天然构象改变和生物活性丢失。在许多情况下二 硫键可选择性的被还原。
第六页,共43页。
第二十页,共43页。
永久性烫发的生化过程
第二十一页,共43页。
六、纤维状蛋白-β角蛋白
Top view
•除了α角蛋白伸展后可逆转 变成β角蛋白之外,自然界还 存在天然的β角蛋白,例如丝 心蛋白,是典型的反平行折 叠,是蚕丝和蜘蛛丝的组成 。
•丝心蛋白:多层结构;链间氢键 、层间范德华力;其侧链主要是 小侧链的甘氨酸,丝氨酸,丙氨 酸,每隔一个残基就是甘氨酸, 甘氨酸位于折叠面的一侧。
➢ 常见的结构域
锌指结构,Zinc finger;
亮氨酸拉链结构,Leucin zipper;
EF手型钙结合性模序
(EF-hand Ca2+-binding motif)
肌钙蛋白的两个结构域。
第二十九页,共43页。
七、球状蛋白与三级结构
1、定义:蛋白质的三级结构是指多肽链中全部氨基酸残基的相对空间位置, 即整条肽链的三维构象。蛋白质的三级结构是在多种二级结构的基础上进 一步盘旋、折叠,从而生成特定的空间结构(球状),包括主链和侧链的 所有原子的空间排布,一般非极性侧链埋在分子内部,形成疏水核,极性 侧链在分子表面。
形成。几乎所有肽键都参与链内氢键的交联,氢键与链的长轴接近垂直。
第十五页,共43页。
③ -折叠有两种类型。 一种为平行式,即所有肽链的N-端
都在同一边,相邻R基团之间的 距离为0.65nm 。
第六页,共43页。
第二十页,共43页。
永久性烫发的生化过程
第二十一页,共43页。
六、纤维状蛋白-β角蛋白
Top view
•除了α角蛋白伸展后可逆转 变成β角蛋白之外,自然界还 存在天然的β角蛋白,例如丝 心蛋白,是典型的反平行折 叠,是蚕丝和蜘蛛丝的组成 。
•丝心蛋白:多层结构;链间氢键 、层间范德华力;其侧链主要是 小侧链的甘氨酸,丝氨酸,丙氨 酸,每隔一个残基就是甘氨酸, 甘氨酸位于折叠面的一侧。
➢ 常见的结构域
锌指结构,Zinc finger;
亮氨酸拉链结构,Leucin zipper;
EF手型钙结合性模序
(EF-hand Ca2+-binding motif)
肌钙蛋白的两个结构域。
第二十九页,共43页。
七、球状蛋白与三级结构
1、定义:蛋白质的三级结构是指多肽链中全部氨基酸残基的相对空间位置, 即整条肽链的三维构象。蛋白质的三级结构是在多种二级结构的基础上进 一步盘旋、折叠,从而生成特定的空间结构(球状),包括主链和侧链的 所有原子的空间排布,一般非极性侧链埋在分子内部,形成疏水核,极性 侧链在分子表面。
形成。几乎所有肽键都参与链内氢键的交联,氢键与链的长轴接近垂直。
第十五页,共43页。
③ -折叠有两种类型。 一种为平行式,即所有肽链的N-端
都在同一边,相邻R基团之间的 距离为0.65nm 。
《蛋白质的结构》PPT课件

36
精选课件ppt
(3) 球状蛋白质分子是紧密的球状或椭球状 实体
(4) 球状蛋白质疏水侧链埋藏在分子内部, 亲水侧链暴露在分子表面
疏水作用力是维持三级结构的主要动力。
(5) 球状蛋白质分子的表面有一个空穴(也称 裂沟、凹槽或口袋)
这种空穴常是结合底物、效应物等配体并 行使生物功能的活性部位。
亚基缔合还可以屏蔽亚基表面 上的疏水残基以避开溶剂水。
41
精选课件ppt
2. 使催化基团汇集在一起
寡聚体的形成可使不同单体亚基的催化基 团汇集在一起以形成完整的催化部位。
42
精选课件ppt
4. 使寡聚蛋白具有别构效应和协同性
多亚基蛋白质一般具有多个结合部位,结合 在蛋白质分子的特定部位上的配体对该分子 的其他部位所产生的影响(如改变亲和力或催 化能力)称为别构效应。
(4)β转角多数都处在蛋白质分子的表面, 在这里改变多肽链方向的阻力比较小。β转 角在球状蛋白质中的含量是相当丰富的, 约占全部残基的四分之一。
21
精选课件ppt
四、无规卷曲(randon coil)
22
精选课件ppt
超二级结构和结构域
23
精选课件ppt
一、超二级结构(super—secondary struture)
-“非极性基团
被极性水分子排 挤相互聚拢”作
用力。
离子键(
或盐键)
精选课件ppt
肽键 二硫键 离子键 氢键 疏水键 范德华力
键能
90kcal/mol
3kcal/mol 1kcal/mol 1kcal/mol 0.1kcal/mol
这四种键能远小于共价键,称次级键
提问:次级键微弱但却是维持蛋白质三级结构中主
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
●
二硫键: 可用还原反应断开之 (是可逆反应) Cys-S-S-Cys → Cys-SH + HS-Cys RNase A (RNA 水解酶): Anfinsen
124 个氨基酸序列中有 四对二硫键 极度坚固
●
●
Chaperonin 可诱导蛋白质的正确折叠
Proteasome 则摧毀不正确折叠者
The polypeptide hormone insulin cannot spontaneously re-form if its disulfide bonds are disrupted. It is synthesized as a larger protein (proinsulin) that is cleaved by a proteolytic enzyme after the protein chain has folded into a specific shape. Excision of part of the proinsulin polypeptide chain causes an irretrievable loss of the information needed for the protein to fold spontaneously into its normal conformation.
目前研究发现,大部分的蛋白质不像 RNase 一样地可自由地 变性与复性,二硫键的形成或打断,都需要经由另一种酶的 催化。 而要正确地折迭三级结构,有时需要相当复杂的帮手 来协助,这一群帮手统称为 chaperonin。
分子间 Interchain Disulfide bond
C CH2 SH
Oxidation Reduction
二.蛋白质的一级结构
三.蛋白质的二级结构
性质小结 基本概念
四.结构模体与结构域 血红蛋白专题
五.蛋白质的三级结构 六.蛋 的 四 级 结 构
1 2
Mathews et al (2000) Biochemistry (3e) p.195
3 4
蛋白质的四级结构
Judson (1996) The Eighth Day of Creation
第 一 个 解 出 的 蛋 白 质 立 体 结 构
1962
Kendrew
--
Cytochrome C
血红素分子埋藏在疏水的空穴中,只有一边向蛋白质分子外暴露。
Lysozyme
图把其结 构上各种 不同极性 的氨基酸 分层显示 ,可发现 非极性氨 基酸的确 都挤在分 子内部, 极性氨基 酸大多分 布在外表 。而与底 物的结合 区是一凹 陷的口袋 ,底物刚 好镶入此 一口袋中 ,接受水 解的催化 反应。
蛋白质的三级结构举例
1974,北京胰岛素结构研究组,以0.18 nm分辨率, 测出了猪胰岛素的空间结构。
我国科学工作者合成的结晶牛胰岛素(1965年)
肌 红 蛋 白 Perutz
Nelson & Cox (2000) Lehninger Principles of Biochemistry (3e) p.189
金属离子对蛋白质的贡献 (1) 稳定蛋白质结构 (2) 参与该蛋白质的功能 (例如参加酶的催化反应等)
Stryer (1995) Biochemistry (4e) p.1000
三级结构中的疏水性作用力
疏水性氨基酸基团
Alberts et al (2002) Molecular Biology of the Cell (4e) p.135
● 具有三级结构的某些蛋白质多肽链即可表现生物学活性。 ● 三级结构的完整性是其功能的基础。若蛋白质严密有序的 空间结构遭到破坏,则其生理功能丧失。 ● 蛋白质的结构域和亚基是具有三级结构的蛋白质分子的亚 单位。对于无亚基并只有单结构域的蛋白质,三级结构就是 它的完整三维结构;对于大多数较大的蛋白质,它们具有多 个结构域或亚基,需要通过这些三级结构单位的进一步组织 才形成完整的分子。 ● 维持三级结构的作用力:
三级结构中的氢键
二级结构氢键 三级结构氢键
三级结构的氢键 与二级结构中的 不同,你认为这 样的区别有意义 吗?
sheet
helix 胰脏 trypsin inhibitor
Garrett & Grisham (1999) Biochemistry (2e) p.181
三级结构中的离子键
可与金属离子形成离子键: Cys, His, Glu, Asp
亲水性基团
以水溶性蛋白质而言(整个立
体结构的中心大都是由非极性氨基酸所组成, 非极性基团之间形成疏水性吸引力,可以避 开外界的水分子环境,使得结构更为稳定。 反之,大部分的亲水性基团,便暴露在分子 外面,与外界的水分子有较强的亲和力,容 易融入水溶液中。)
(脂溶性蛋白质恰相反)
三级结构中的二硫键
C CH2 SH SH CH2 C
C CH2 S S CH2 C C CH2 S S CH2 C
SH CH2 C
分子內 Intrachain Disulfide bond
Adapted from Alberts et al (2002) Molecular Biology of the Cell (4e) p.152
■ 维持三级结构的作用力
四级结构的功能与效用
★蛋白质为何要再聚成四级结构?
■ 活性调节作用:hemoglobin
可调节酶催化活性的开启或关闭
■ 酶复合体: pyruvate dehydrogenase
聚集数种酶在一起可提高催化效率
■ 組合结构组织:actin, myosin, virus
小单位蛋白质聚集成为生物体的构造成份
Hemoglobin
■ 四级结构性质小结
● 亚基之间没有共价键连接,而是借次级键缔合在 一起。 ● 此类蛋白质只有完整四级结构才有生物学活性。 ● 具有四级结构的蛋白质的功能活性可以通过变构 作用(allosteric effect)而被调节。 ● 由少数亚基聚合而成的蛋白质,称为寡聚蛋白 (oligomer protein);由几十个甚至上千个亚基聚合而 成的蛋白质,称为多聚蛋白(polymer protein)。
注:二硫键越多的蛋白质,通常对热较稳定,因为分子比较不易被扯开。二硫键有以上形
成共价键的特性(即:架桥特性),可形成相当坚固的连接;但也可以被还原反应打断,但打 断后的 -SH 也可以再氧化,恢复二硫键。 因此,早期 Anfinsen 以含有很多二硫键的 ribonuclease (RNase) 进行这种可逆反应的实 验,发现 RNase 可以因而在原态与变性状态下来回转变。
种环肽链由于其氨基酸残基侧
链相互作用,发生范围广泛的 盘旋、折叠,形成包括主链、 侧链在内的特定的空间构象, 就是蛋白质的三级结构 (tertiary
Hemoglobin 近垂直的螺旋结构
structure)。
■ 三级结构要点
● 二级结构单位集合组成三级结构
一些二级结构组合会反复出现在不同蛋白质中 如 桶状) ← Motif
Backbone Hydrophobic Hydrophilic Total + substrate
Watson et al. (1987) Mol Biol Gene, Plate 3
Computer-generated space-filling models of two enzymes. In (A) cytochrome c is shown with its bound heme coenzyme. In (B) egg-white lysozyme is shown with a bound oligosaccharide substrate. In both cases the bound ligand is red.
第三讲 蛋白质的结构体系
一.蛋白质结构之总论
二.蛋白质的一级结构
三.蛋白质的二级结构 三级结构举例 五.蛋白质的三级结构 六.蛋白质的四级结构 七.蛋白质结构的分类
基本概念
三级结构组成的作用力
四.结构模体与结构域
蛋白质的三级结构
■ 基本概念 结构域在三维空间中以专一的 方式组合排布,或者二级结构、 结构模体及其与之相关联的各
蛋白质的四级结构
■ 血红蛋白专题
Hemoglobin 血红蛋白 The iron-containing respiratory pigment in red blood cells of vertebrates, consisting of about 6 percent heme and 94 percent globin. 脊椎动物红血细胞中一种含铁 Hemoglobin 的呼吸色素,由大约 6% 的血 红素和94%的球蛋白组成。 学习血红蛋白,如何理解蛋白质的四
级结构?学到什么研究方法?(自修)
Hemoglobin – 1
Hemoglobin is a tetrameric protein composed of two subunits and two subunits (22).
胰凝乳蛋白酶的疏水性口袋的底部是一个不带电荷的 氨基酸残基
底物“口袋”中有一个带电荷的天冬氨酸残
酶结合底物的口袋中含有缬氨酸和苏氨酸残基, 限制大的底物进入。
由 4 个相同亚基组成四 聚 体 , 亚 基 分 子 量 36 000 ,含有一条多肽链 和 一 个 辅 基 (NAD+) , 多肽链由 334 个氨基酸 组成,折叠、盘曲成两 个结构域。
Comparison of the conformations of the two serine proteases. Although only those amino acid residues in the polypeptide chain shaded in green are the same in the two proteins, their conformations are very similar everywhere. The active site, which is circled in red, contains an activated serine residue. Chymotrypsin contains more than two chain termini because it is formed by the proteolytic cleavage of chymotrypsinogen, an inactive precursor.
二硫键: 可用还原反应断开之 (是可逆反应) Cys-S-S-Cys → Cys-SH + HS-Cys RNase A (RNA 水解酶): Anfinsen
124 个氨基酸序列中有 四对二硫键 极度坚固
●
●
Chaperonin 可诱导蛋白质的正确折叠
Proteasome 则摧毀不正确折叠者
The polypeptide hormone insulin cannot spontaneously re-form if its disulfide bonds are disrupted. It is synthesized as a larger protein (proinsulin) that is cleaved by a proteolytic enzyme after the protein chain has folded into a specific shape. Excision of part of the proinsulin polypeptide chain causes an irretrievable loss of the information needed for the protein to fold spontaneously into its normal conformation.
目前研究发现,大部分的蛋白质不像 RNase 一样地可自由地 变性与复性,二硫键的形成或打断,都需要经由另一种酶的 催化。 而要正确地折迭三级结构,有时需要相当复杂的帮手 来协助,这一群帮手统称为 chaperonin。
分子间 Interchain Disulfide bond
C CH2 SH
Oxidation Reduction
二.蛋白质的一级结构
三.蛋白质的二级结构
性质小结 基本概念
四.结构模体与结构域 血红蛋白专题
五.蛋白质的三级结构 六.蛋 的 四 级 结 构
1 2
Mathews et al (2000) Biochemistry (3e) p.195
3 4
蛋白质的四级结构
Judson (1996) The Eighth Day of Creation
第 一 个 解 出 的 蛋 白 质 立 体 结 构
1962
Kendrew
--
Cytochrome C
血红素分子埋藏在疏水的空穴中,只有一边向蛋白质分子外暴露。
Lysozyme
图把其结 构上各种 不同极性 的氨基酸 分层显示 ,可发现 非极性氨 基酸的确 都挤在分 子内部, 极性氨基 酸大多分 布在外表 。而与底 物的结合 区是一凹 陷的口袋 ,底物刚 好镶入此 一口袋中 ,接受水 解的催化 反应。
蛋白质的三级结构举例
1974,北京胰岛素结构研究组,以0.18 nm分辨率, 测出了猪胰岛素的空间结构。
我国科学工作者合成的结晶牛胰岛素(1965年)
肌 红 蛋 白 Perutz
Nelson & Cox (2000) Lehninger Principles of Biochemistry (3e) p.189
金属离子对蛋白质的贡献 (1) 稳定蛋白质结构 (2) 参与该蛋白质的功能 (例如参加酶的催化反应等)
Stryer (1995) Biochemistry (4e) p.1000
三级结构中的疏水性作用力
疏水性氨基酸基团
Alberts et al (2002) Molecular Biology of the Cell (4e) p.135
● 具有三级结构的某些蛋白质多肽链即可表现生物学活性。 ● 三级结构的完整性是其功能的基础。若蛋白质严密有序的 空间结构遭到破坏,则其生理功能丧失。 ● 蛋白质的结构域和亚基是具有三级结构的蛋白质分子的亚 单位。对于无亚基并只有单结构域的蛋白质,三级结构就是 它的完整三维结构;对于大多数较大的蛋白质,它们具有多 个结构域或亚基,需要通过这些三级结构单位的进一步组织 才形成完整的分子。 ● 维持三级结构的作用力:
三级结构中的氢键
二级结构氢键 三级结构氢键
三级结构的氢键 与二级结构中的 不同,你认为这 样的区别有意义 吗?
sheet
helix 胰脏 trypsin inhibitor
Garrett & Grisham (1999) Biochemistry (2e) p.181
三级结构中的离子键
可与金属离子形成离子键: Cys, His, Glu, Asp
亲水性基团
以水溶性蛋白质而言(整个立
体结构的中心大都是由非极性氨基酸所组成, 非极性基团之间形成疏水性吸引力,可以避 开外界的水分子环境,使得结构更为稳定。 反之,大部分的亲水性基团,便暴露在分子 外面,与外界的水分子有较强的亲和力,容 易融入水溶液中。)
(脂溶性蛋白质恰相反)
三级结构中的二硫键
C CH2 SH SH CH2 C
C CH2 S S CH2 C C CH2 S S CH2 C
SH CH2 C
分子內 Intrachain Disulfide bond
Adapted from Alberts et al (2002) Molecular Biology of the Cell (4e) p.152
■ 维持三级结构的作用力
四级结构的功能与效用
★蛋白质为何要再聚成四级结构?
■ 活性调节作用:hemoglobin
可调节酶催化活性的开启或关闭
■ 酶复合体: pyruvate dehydrogenase
聚集数种酶在一起可提高催化效率
■ 組合结构组织:actin, myosin, virus
小单位蛋白质聚集成为生物体的构造成份
Hemoglobin
■ 四级结构性质小结
● 亚基之间没有共价键连接,而是借次级键缔合在 一起。 ● 此类蛋白质只有完整四级结构才有生物学活性。 ● 具有四级结构的蛋白质的功能活性可以通过变构 作用(allosteric effect)而被调节。 ● 由少数亚基聚合而成的蛋白质,称为寡聚蛋白 (oligomer protein);由几十个甚至上千个亚基聚合而 成的蛋白质,称为多聚蛋白(polymer protein)。
注:二硫键越多的蛋白质,通常对热较稳定,因为分子比较不易被扯开。二硫键有以上形
成共价键的特性(即:架桥特性),可形成相当坚固的连接;但也可以被还原反应打断,但打 断后的 -SH 也可以再氧化,恢复二硫键。 因此,早期 Anfinsen 以含有很多二硫键的 ribonuclease (RNase) 进行这种可逆反应的实 验,发现 RNase 可以因而在原态与变性状态下来回转变。
种环肽链由于其氨基酸残基侧
链相互作用,发生范围广泛的 盘旋、折叠,形成包括主链、 侧链在内的特定的空间构象, 就是蛋白质的三级结构 (tertiary
Hemoglobin 近垂直的螺旋结构
structure)。
■ 三级结构要点
● 二级结构单位集合组成三级结构
一些二级结构组合会反复出现在不同蛋白质中 如 桶状) ← Motif
Backbone Hydrophobic Hydrophilic Total + substrate
Watson et al. (1987) Mol Biol Gene, Plate 3
Computer-generated space-filling models of two enzymes. In (A) cytochrome c is shown with its bound heme coenzyme. In (B) egg-white lysozyme is shown with a bound oligosaccharide substrate. In both cases the bound ligand is red.
第三讲 蛋白质的结构体系
一.蛋白质结构之总论
二.蛋白质的一级结构
三.蛋白质的二级结构 三级结构举例 五.蛋白质的三级结构 六.蛋白质的四级结构 七.蛋白质结构的分类
基本概念
三级结构组成的作用力
四.结构模体与结构域
蛋白质的三级结构
■ 基本概念 结构域在三维空间中以专一的 方式组合排布,或者二级结构、 结构模体及其与之相关联的各
蛋白质的四级结构
■ 血红蛋白专题
Hemoglobin 血红蛋白 The iron-containing respiratory pigment in red blood cells of vertebrates, consisting of about 6 percent heme and 94 percent globin. 脊椎动物红血细胞中一种含铁 Hemoglobin 的呼吸色素,由大约 6% 的血 红素和94%的球蛋白组成。 学习血红蛋白,如何理解蛋白质的四
级结构?学到什么研究方法?(自修)
Hemoglobin – 1
Hemoglobin is a tetrameric protein composed of two subunits and two subunits (22).
胰凝乳蛋白酶的疏水性口袋的底部是一个不带电荷的 氨基酸残基
底物“口袋”中有一个带电荷的天冬氨酸残
酶结合底物的口袋中含有缬氨酸和苏氨酸残基, 限制大的底物进入。
由 4 个相同亚基组成四 聚 体 , 亚 基 分 子 量 36 000 ,含有一条多肽链 和 一 个 辅 基 (NAD+) , 多肽链由 334 个氨基酸 组成,折叠、盘曲成两 个结构域。
Comparison of the conformations of the two serine proteases. Although only those amino acid residues in the polypeptide chain shaded in green are the same in the two proteins, their conformations are very similar everywhere. The active site, which is circled in red, contains an activated serine residue. Chymotrypsin contains more than two chain termini because it is formed by the proteolytic cleavage of chymotrypsinogen, an inactive precursor.
