高中化学考试注意事项及电子式书写技巧
高考化学中常见的电子式大全
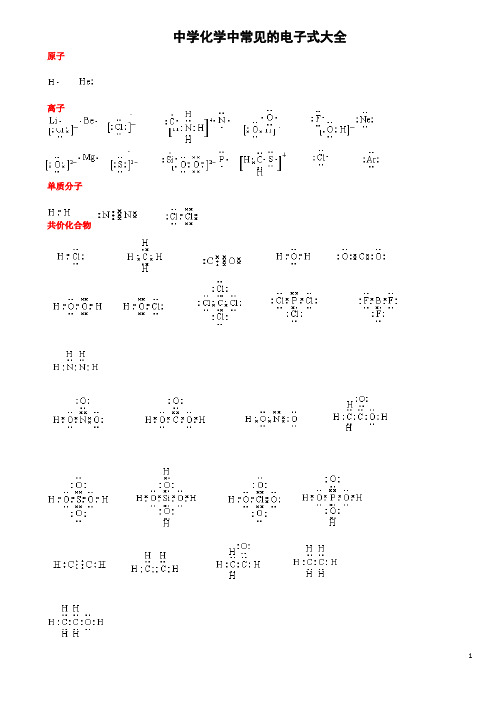
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
高中化学电子式书写注意点

高中化学电子式书写注意点电子式是重要的化学用语,能清楚地表示出原子、离子、离子化合物和共价化合物的结构和形成,要能正确地掌握和应用,书写时必须注意以下问题。
1. 用电子式表示离子化合物的形成的注意点(1)左边写出形成离子化合物中各原子的电子式,右边写出生成的离子化合物的电子式,中间用“→”连接,而不是“=”。
(2)用电子式表示离子化合物的结构时,对于阳离子来说,一般用阳离子符号表示,如等;而阴离子则不同,应在元素符号的周围用小黑点(·)或小叉(×)表示最外层电子数,外面加上中括号([ ]),并在中括号的右上角标上离子所带的负电荷数,如。
(3)构成离子化合物的每一个离子都要单独书写,不可合并,书写原子的电子式时,若有几个相同的原子,可合并书写。
如:2. 用电子式表示共价化合物的形成的注意点(1)左边书写出形成共价化合物的原子的电子式,相同可以合并,右边写出生成的共价化合物的电子式,相同原子不可合并,中间用“”连接。
(2)不同元素的原子形成分子时,共用电子对的数目不同,原子最外层电子数目离稳定结构差几个电子,一般要共用几对电子。
(3)共价化合物的电子式中,要注意使每个原子周围的电子数均达到稳定结构。
(4)由于共价化合物中没有阴、阳离子,所以用电子式表示共价化合物的结构时,不使用中括号,也不标电荷数。
如:3. 电子式书写中的常见错误(1)漏写未参加成键的电子对。
如:(2)离子错误合并。
如:(3)错写分子中原子间的结合方式。
如:中是O与H和Cl成键,应写为。
(4)离子化合物、共价化合物不分,乱用或丢掉中括号。
如:(5)不遵循成键规律,胡乱添加电子。
如:4. 例题解析例1. 下列化合物的电子式书写正确的是()A. 氨气:B. 四氯化碳:C. 甲烷:D. 二氧化碳:解析:A项中N的最外层电子没有全部标出;B项中Cl的最外层电子也没有全部标出;D项中C、O共用电子对数目标错。
故选C项。
点评:书写共价化合物的电子式时应注意:①各原子最外层的电子即使未参与成键也必须全数标出;②要正确标出共用电子对的数目;③较复杂的分子要标出原子间的连接方式,原子间的连接方式不一定是分子式书写的顺序。
电子式的书写方法分类

电子式是高中化学必修二的一个重要高中化学只是带你,考查形式通常为电子式的书写和判断正误,也是高考化学试题中常涉及到的一个知识点。
首先我们来看看什么是电子式?电子式就是在元素符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子的式子。
其次,中学化学网现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“·”或“×”标出它的最外层电子。
依据元素的原子最外层电子个数的多少,先用小黑点“•”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对。
②例子:元素周期表中前18号元素原子电子式如下图:2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示。
具体原因是:简单阳离子由于在形成过程中已失去最外层电子,所以其电子式就是其离子符号本身。
②例子:钠离子Na+;镁离子Mg2+;钡离子Ba2+(3)复杂的阳离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子电子式如下图(铵根离子电子式)(3)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷。
②例子:氯离子和氧离子的电子式如下图:(4)复杂的阴离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:过氧根离子和氢氧根离子的电子式分别如下图(过氧根离子电子式)(氢氧根离子电子式)3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:(氧气分子电子式)(氯气分子电子式)③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:(氯化钠电子式)(硫化钾电子式)(氯化铵电子式)(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况②例子:(氯化氢电子式)(二氧化碳电子式)③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H2的形成过程K2S的形成过程注意:①用“→”表示形成过程,不用“=”;②“→”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“→”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
电子式书写之诀窍

电子式书写之诀窍电子式是一种重要的化学用语,能清楚地表示出原子、离子、离子化合物和共价化合物的结构,是中学化学教学的重点,也是高考考纲中要求学生必须掌握的重要内容之一,已成为各类考试的热点。
电子式在表达形式上有严格的要求,学习时一定要掌握其书写诀窍。
一、明确物质类别,分类记忆书写规则1.原子的电子式直接在原子符号周围用小黑点“·”或“×”来表示原子的最外层电子。
如:2.离子的电子式⑴简单阳离子:离子符号即为电子式。
如:Na +、Mg 2+、Al 3+⑵复杂阳离子和阴离子:在原子符号周围用小黑点“·”或“×”来表示原子的最外层电子,并用方括号括起来,在方括号的右上角标明所带的电荷数。
如:3.化合物的电子式⑴共价化合物共价化合物是原子间通过共用电子对结合而形成的,书写时将共用电子对画在两原子之间。
每个原子的未成对电子和孤对电子也应画出,使每个原子周围的电子都达到稳定结构。
如:⑵离子化合物离子化合物是阴、阳离子通过离子键结合而形成的,书写时先根据离子电子式的书写方法,分别画出阳离子和阴离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能并合。
如:二、善于归纳总结,熟练掌握规律技巧1.同一个式子中同一元素原子的电子要用同一符号,都用“·”或“×”。
2.要注意共价化合物与离子化合物电子式的区别。
前者不加括号,不写表示电荷的符号,后者阴离子(复杂阳离子)加方括号,括号外写表示电荷的符号。
3.离子化合物中阴阳离子个数比不是1∶1时,要注意每一个离子都与带相反电荷的离子O N ClH直接相邻的事实。
如:4.不同元素的原子形成分子时,共用电子对的数目不同,一般原子的共用电子对数目=8—最外层电子数。
三、有备无患,储存记忆常见物质电子式1.离子化合物2.共价化合物(单质分子)3.特殊微粒CaC 2NH 4ClNH 3 CH 4 HClO CCl 4 OH —(氢氧根离子) —OH (羟基)。
中学高中高考化学中常见的电子式大全
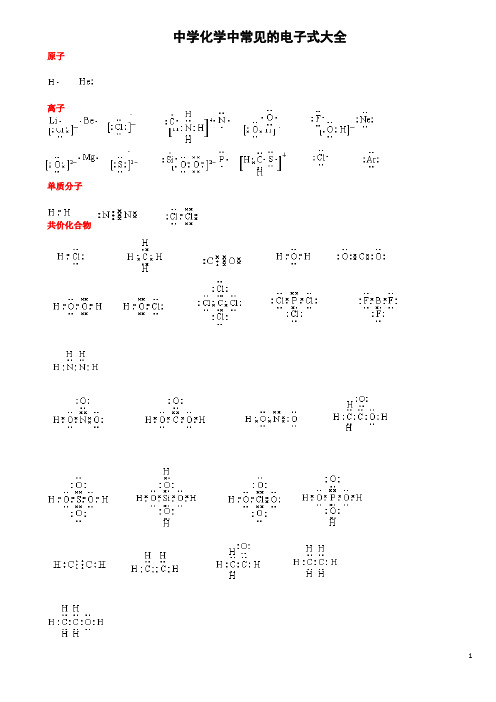
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
高三化学 电子式的书写规则口诀

电子式的书写规则口诀定义:在化学反应中,一般是原子的最外层电子数目发生变化。
为了简便起见,化学中常在元素符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H·、Na·、(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+(3)阴离子的电子式:要画出最外层电子数,用“[ ]”括起来,右上角标出“n-”:、、(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并:、(5)共价化合物的电子式:画出离子最外层电子数:、(6)用电子式表示物质形成的过程:氯化氢的形成过程:氯化镁的形成过程:结构式:共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如:书写电子式的常见错误:漏写未参与成键的电子,如:化合物类型不清,漏写或多写“[]”及错写电荷数,如:书写不规范,错写共用电子对如:N2的电子式为:,不能写成:,更不能写成:或。
不考虑原子间的结合顺序如:HClO的电子式为,而非。
因氧原子需形成2对共用电子才能达到稳定结构,而H、Cl各需形成1对共用电子就能达到稳定结构。
不考虑原子最外层有几个电子均写成8电子结构如:的电子式为,而非,因中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
不清楚A如型离子化合物中两个B是分开写还是写一块如:中均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。
它们的电子式分别为:。
高中化学电子式的书写技巧(最简版)公开课教学课件

电子式书写方法
1.写好原子电子式——基础: 2. 厘清得失与共用——关键:
H Na Mg Al C N O Cl
[ Cl ]-
[ O××]2-
[ Cl×]-
[ O ]2-
结论1:简单阳离子的电子式=其离子符号
Hale Waihona Puke 结论2:阴离子的电子式:点画出最外层电子数+得到的电子数 n=8 ,用中括号“[ ]”括起来,在右上角标出“n-”电荷数。
电子式书写方法
3. 排序:共用电子数多的原子或得失电子数多的离 子通常放中心,多个相同的离子或原子两边放。
Na2O2、Mg3N2
AB型 A2B型 AB2型
NaCl Na2S MgCl2
2-
Na S Na
AB ABA
BAB
电子式书写方法
3. 排序:共用电子数多的原子或得失电子数多的离 子通常放中心,多个相同的离子或原子两边放。
CO2
HSCN 、HClO、H2O2
结论3:离子化合物电子式=阳离子电子式+阴离子电子式。 共价化合物电子式=原子电子式+原子电子式。
注意:相同离子不能放一起(而是相同离子放两边)。
[反思小结]
1. 基础:写好原子的电子式。 2. 关键:分清是离子键还是共价键(或得失或是共用)。 3. 排序:共用电子数多的原子或得失电子数多的离子 通常放中心,多个相同的离子或原子两边站。 4.结果:原子间电子的得失或共用形成8 e-稳定结构。
电子式书写中应该注意的几个问题

电子式书写中应该注意的几个问题电子式是重要的化学用语,能清楚地表示出原子、离子、离子化合物和共价化合物的结构和形成,要能正确地掌握和应用,书写时必须注意以下问题。
1. 用电子式表示离子化合物的形成的注意点(1)左边写出形成离子化合物中各原子的电子式,右边写出生成的离子化合物的电子式,中间用“→”连接,而不是“=”。
(2)用电子式表示离子化合物的结构时,对于阳离子来说,一般用阳离子符号表示,如等;而阴离子则不同,应在元素符号的周围用小黑点(·)或小叉(×)表示最外层电子数,外面加上中括号([ ]),并在中括号的右上角标上离子所带的负电荷数,如。
(3)构成离子化合物的每一个离子都要单独书写,不可合并,书写原子的电子式时,若有几个相同的原子,可合并书写。
如:2. 用电子式表示共价化合物的形成的注意点(1)左边书写出形成共价化合物的原子的电子式,相同可以合并,右边写出生成的共价化合物的电子式,相同原子不可合并,中间用“”连接。
(2)不同元素的原子形成分子时,共用电子对的数目不同,原子最外层电子数目离稳定结构差几个电子,一般要共用几对电子。
(3)共价化合物的电子式中,要注意使每个原子周围的电子数均达到稳定结构。
(4)由于共价化合物中没有阴、阳离子,所以用电子式表示共价化合物的结构时,不使用中括号,也不标电荷数。
如:3. 电子式书写中的常见错误(1)漏写未参加成键的电子对。
如:(2)离子错误合并。
如:(3)错写分子中原子间的结合方式。
如:中是O与H和Cl成键,应写为。
(4)离子化合物、共价化合物不分,乱用或丢掉中括号。
如:(5)不遵循成键规律,胡乱添加电子。
如:4. 例题解析例1. 下列化合物的电子式书写正确的是()A. 氨气:B. 四氯化碳:C. 甲烷:D. 二氧化碳:解析:A项中N的最外层电子没有全部标出;B项中Cl的最外层电子也没有全部标出;D项中C、O共用电子对数目标错。
故选C项。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学考试注意事项及电子式书写技巧1 、排列顺序时,分清是“由大到小”还是“由小到大”,类似的:“由强到弱”、“由高到低”等等。
2 、书写化学方程式时,分清是“=”还是“⇌”,如一种盐水解方程式一定用“⇌”不能用“=”,其产物也不能标“↓”或“↑”,弱酸、弱碱的电离一定要用“⇌”不能用“=”。
多元弱酸电离、多元弱酸根离子水解:不能一步写成和或漏写可逆符号;3 、别忽视题干中“混合物”、“化合物”、“单质”等限制条件。
4 、有单位的要写单位,没有单位的就不要写了。
如“溶解度”单位是“ g ”,却不写出,“相对分子质量”、“相对原子质量”无单位,却加上“g ”或“g ·mol -1”。
摩尔质量有单位(g ·mol -1) 却不写单位,阿伏加德罗常数单位是“ mol -1”而未写,失分。
5 、要求写“名称”却写分子式或其他化学式,要求写分子式或结构式却写名称。
电子式、原子或离子结构示意图、结构简式、结构式不看清,张冠李戴。
要求写离子方程式而错写成化学方程式。
书写电子式时,共价化合物忘了未成对电子,离子化合物中的阴离子与原子团离子忘了加中括号;元素符号和元素名称、结构简式和分子式、化学方程式和结构简式不要混淆。
6 、所有的稀有气体都是单原子分子而误认为双原子分子。
7 、273 ℃与273K 不注意区分,是“标况”还是“非标况”,是“气态”还是“液态”“固态”不分清楚。
22.4L.mol-1的适用条件。
注意三氧化硫、乙烷、己烷、水等物质的状态。
区分液态氯化氢和盐酸,液氨和氨水,液氯和氯水。
8 、计算题中往往出现“将样品分为两等份” ( 或“从 1000mL 溶液中取出50mL ”) ,最后求的是“原样品中的有关的量”,你却只求了每份中的有关量。
9 、请注意选择题“正确的是”,“错误的是”两种不同要求。
请注意,做的正确,填卡时却完全填反了,要十分警惕这种情况发生。
10 、求“物质的质量”与“物质的物质的量”、求气体的“体积分数”与“质量分数”不看清楚,失分。
11 、描述实验现象要全面,“陆海空”全方位观察。
12 、表示离子电荷与元素化合价混为一谈。
13 、原电池正负极不清,电解池、电镀池阴阳极不清,电极反应式写反了。
14 、求“转化率”、“百分含量”混淆不清。
15 、两种不同体积不同浓度同种溶液混和,总体积是否可以加和,要看题目情景和要求。
16 、化学计算常犯错误如下:①分子式写错②化学方程式写错或不配平或配平有错③用关系式计算时,物质的量关系式不对,以上情况发生,全扣分④相对分子质量算错⑤讨论题,缺讨论过程,扣相当多的分⑥给出两种反应的量,不考虑一反应物过量 ( 要有判断过程) ⑦要求写出计算规范过程:解、设未知量、方程式或关系式,计算比例关系、比例式主要计算过程、答、单位、有的题目还要写出推理过程,不要省略步骤,计算过程要带单位。
注意题中对有效数字的隐性要求。
17 、推断题。
请注意根据题意,无机物、有机物均应考虑( 全面,综合) 。
18 、要注意试题中小括号内的话,专门看。
19 、回答简答题,一定要避免“简单化”,要涉及原理,应该有因有果,答到“根本”。
20 、m A(s) + n B(g) ⇌pC(l) + q D(g) 这种可逆反应,加压或减压,平衡移动只考虑其中的气态物质(g) 的化学计量数。
21 、配平任何方程式,最后都要进行“系数化简”。
书写化学反应方程式,反应条件必须写,而且写正确。
,氧化—还原反应配平后,得失电子要相等,离子反应电荷要守恒,不搞假配平。
有机化学方程式未用“→”,热化学反应方程式不漏写物质的聚集状态,不漏写反应热的“ + ”或“+ ”,反应热的单位是kJ·mol-1。
22 、有机结构简式中原子间的连结方式表达正确,不要写错位。
结构简式有多种,但是碳碳键、官能团不要简化,酯基、羧基的各原子顺序不要乱写,硝基、氨基写时注意碳要连接在N 原子上。
如,COOHCH2CH2OH( 羧基连接错) ,CH 2CHCOOH( 少双键) 等( 强调:在复杂化合物中酯基、羧基最好不要简化) 。
化学用语中文名称不能写错别字。
如,“酯化”不能写成“脂化”,“羧基”不能写成“酸基”。
酯化反应的生成物不漏写“水”、缩聚反应的生成物不漏写“小分子”。
23 、有机分子结构式中有几个苯环要看清楚,千万不要认为六边形一定是苯环;24 、量器书写时不注明规格,滴定管书写时不注明酸、碱式,均要扣分;第VIII 、第IVA等容易写错;25 、遇到做过的类似题,一定不要得意忘形,结果反而出错,一样要镇静、认真解答,不要思维定势;碰到难题决不能一下子“蒙”了,要知道,机会是均等的,要难大家都难。
应注意的是,难度大的试题中也有易得分的小题,你应该得到这分。
26 、化学考题难易结合,波浪型发展。
决不能认为前面的难,后面的更难!有难有易,难题或较难题中一定有不少可以得分的地方,不可放弃。
27 、解题时,切莫在某一个“较难”或“难”的考题上花去大量的宝贵时间,一个 10 分左右的难题,用了30 多分钟甚至更多时间去考虑,非常不合算,不合理。
如果你觉得考虑了几分钟后还是无多少头绪,请不要紧张、心慌,暂把它放在一边,控制好心态,去解答其他能够得分的考题,先把能解决的考题先解决。
再回过头来解决它,找到了感觉,思维活跃了,很可能一下子就想通了,解决了。
28 、解推断题,实验题。
思维一定要开阔、活跃,联想性强。
切不可看了后面的文字,把前面的话给忘了,不能老是只从一个方面,一个角度去考虑,应该是多方位、全方位进行考虑。
积极地从考题中字字、句句中寻找出“突破口”。
29 、考试时切忌“反常”,仍然是先易后难,先做一卷,后做二卷。
30 .在临场实战中,由于非智力因素的影响,使得某些考生的真实水平不能正常发挥,极易出现某些不值一谈的甚至是可笑的错误。
由于思维弹性较小且极度紧张,考生的失误往往出现在不知不觉的情境之中,甚至丢了分还不以为然。
即使基础较好的考生也会“马失前蹄”。
例如有的同学因“紧张”而涂黑错位。
当只剩最后几分钟时老师提醒再涂卡,仓忙为之的结果致使“错位”失分。
有的同学习惯先在试卷上书写,最后再誉写到答题纸上,这样有两个弊端:一是费时,二是易漏写填空线。
纠正化学电子式书写常见错误的措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高,如将氧原子的电子式写成(正确应为)。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO的电子式写成:;MgCl2的电子式写成:。
二、不能正确表达共价键的数目。
例如混淆O2和H2O2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO,但根据H、Cl、O个三原子的氧化性(或电负性)差异可知该分子中H、Cl带部分正电荷,O带部分负电荷,因此HClO的电子式应为。
对于离子化合物Mg3N2,先可判断出式中Mg为+2价,N为-3价,根据“异性相吸、电荷交叉”的规律其电子式为这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl2由Mg2+和Cl-以1:2的比例构成,Na2O2由Na+和O22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN(其中C为+4价、N为-3价,电子式为)。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
二、“电子分配求差量”揭开共用电子对数目的面纱。
该方法的理论依据来源于配位化学中的“18电子规则”。
虽然该方法仅适用于计算共用键的数目,对配位键则爱莫能助。
但在高中阶段要求掌握的配位化合物较少,典型代表为Fe(SCN)3、[Ag(NH3)2]OH、。
该方法在高中阶段应用较广。
具体算法以例说明:1、CO2根据“异性相吸、电荷交叉”的规律其原子排列顺序为OCO,其中O原子的最外层有6个电子,要达到8电子稳定结构还需2个电子,则O、C原子之间需共用两对电子对,此时C原子的最外层电子已全部被共用,因此CO2电子式为:2、N2和Na2O2N2:每个N原子的最外层有5个电子,还需两个电子达到8电子的稳定结构,因此N、N之间共用两对电子对,其电子式为Na2O2:Na2O2为离子化合物,O22-得到了两个来自Na的电子,则其最外层共计有14个电子(2×6+2),这样平均每个O原子的最外层有7个电子,要达到8电子稳定结构还需1个电子,因此O22-中有一对共用电子对,则Na2O2的电子式为:此方法对于短周期元素的原子形成的共价微粒中共价键数目的计算很有效,但O2除外。
三、“等电子体”带动“家族”亮起来。
在2004年江苏省高考试题化学卷中给出了“等电子体”的概念并有以下引申(第二卷第22题):由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们也具有相似的结构特征。
根据此定义我们可以从一种微粒的电子式推导出上述概念范围内的等电子体的电子式。
如:掌握了微粒电子式的写法,就可以快速书写该微粒的结构式,也可以用电子式来表示微粒的形成过程。
对于简单短周期元素的原子形成的微粒还可以依据其电子式推导其空间结构,如中B原子上无孤对电子,此分子应为平面型,而3个F原子的的相互作用力相同,因此BF3的空间结构为平面正三角形。
中N原子上有一对孤对电子,相当与在已形成的平面正三角形上方增加了一对孤对电子。
它对N、H键的共用电子对有排斥作用,因而该分子应为立体型,而N原子连接3个原子且相同,因此NH3的空间结构为三角锥型。
