武汉大学2005-2013年普通化学考研真题合集
新版武汉大学化学考研经验考研参考书考研真题

考研是我一直都有的想法,从上大学第一天开始就更加坚定了我的这个决定。
我是从大三寒假学习开始备考的。
当时也在网上看了很多经验贴,可是也许是学习方法的问题,自己的学习效率一直不高,后来学姐告诉我要给自己制定完善的复习计划,并且按照计划复习。
于是回到学校以后,制定了第一轮复习计划,那个时候已经是5月了。
开始基础复习的时候,是在网上找了一下教程视频,然后跟着教材进行学习,先是对基础知识进行了了解,在5月-7月的时候在基础上加深了理解,对于第二轮的复习,自己还根据课本讲义画了知识构架图,是自己更能一目了然的掌握知识点。
8月一直到临近考试的时候,开始认真的刷真题,并且对那些自己不熟悉的知识点反复的加深印象,这也是一个自我提升的过程。
其实很庆幸自己坚持了下来,身边还是有一些朋友没有走到最后,做了自己的逃兵,所以希望每个人都坚持自己的梦想。
本文字数有点长,希望大家耐心看完。
文章结尾有我当时整理的详细资料,可自行下载,大家请看到最后。
武汉大学化学的初试科目为:(101)思想政治理论(201)英语一(655)分析化学和物理化学(881)无机化学和有机化学参考书目为:1、《无机化学》(上下册),天津大学无机化学教研室编,高等教育出版社,第四版;2、《有机化学》,徐寿昌主编,高等教育出版社,第二版;3、《分析化学》,郑燕英主编,同济大学出版社,2015年4、《物理化学》(上下册),天津大学物理化学教研室编,高等教育出版社,第五版关于英语复习的建议考研英语复习建议:一定要多做真题,通过对真题的讲解和练习,在不断做题的过程中,对相关知识进行查漏补缺。
对于自己不熟练的题型,加强训练,总结做题技巧,达到准确快速解题的目的。
虽然准备的时间早但因为各种事情耽误了很长时间,真正复习是从暑假开始的,暑假学习时间充分,是复习备考的黄金期,一定要充分利用,必须集中学习,要攻克阅读,完形,翻译,新题型!大家一定要在这个时间段猛搞学习。
在这一阶段的英语复习需要背单词,做阅读(每篇阅读最多不超过20分钟),并且要做到超精读。
武汉科技大学有机化学考研真题试题2005—2010、2019年(含标准答案)
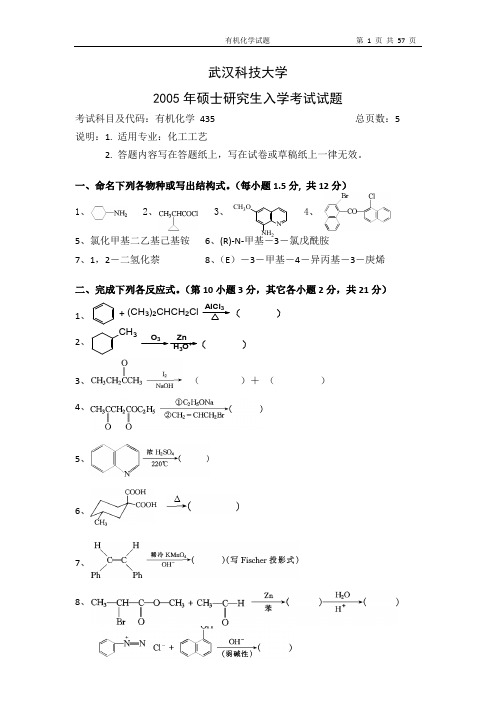
(7 分)
八、推导结构题。 (共 16 分) 1、一个糖和苯肼作用生成 D-葡萄糖脎,但不被溴水氧化。写出该糖的结构式。 (2 分) 2、组成为 C7H8O3S 的化合物 A,经高锰酸钾氧化后得磺酸基苯甲酸,A 和氢氧化 钠熔融后,酸化得邻甲酚。确定该化合物的构造式。 (2 分) 3. 化合物 A(C5H10O)能使高锰酸钾溶液褪色,与乙酰氯作用可生成醋酸酯 B(
(A) CH3CHICH3 (B) CH3CHBrCH3 (C) CH3CHClCH3
9、将下列化合物按熔点高低排列:
(A) HCON(CH3)2
(B) CH3CONHCH3
(C) CH3CH2CONH2
10、将下列化合物按氨解的易难排列成序:
(A)
Cl (B) CH3O
Cl (C) NO2
Cl (D)
五、用简便的化学方法鉴别下列各组化合物。(共 16 分)
1、(A) 葡萄糖 (B) 蔗糖 (C) 2-己酮 (4 分)
2、(A) 苯 (B) 苯酚 (C) 噻吩
(4 分)
3、
(6 分) 4.(A)对甲苯胺 (B)N-甲基苯胺 (C)N,N-二甲基苯胺 (2 分) 六、用化学方法分离下列各组化合物。(每小题 3 分,共 6 分) 1、2-硝基-1, 3-二氯苯和 2, 6-二氯苯胺的混合物。 2、邻甲苯酚和水杨酸的混合物。 七、有机合成题。 (共 19 分) 1、以异戊醇为原料(无机试剂任选)合成亮氨酸:
2、丙烯酸甲酯与溴化氢加成,得到的主要产物为 3-溴丙酸甲酯,而不是 2-溴 丙酸甲酯。试解释之。 (7 分)
武汉大学《分析化学》第5版上册名校考研真题(酸碱滴定法)【圣才出品】

武汉大学《分析化学》第5版上册名校考研真题第5章酸碱滴定法一、选择题1.按照酸碱质子理论,在下列溶剂中HF的酸性最强的是()。
[华侨大学2015研]A.纯水B.浓H2SO4C.液氨D.醋酸【答案】C【解析】非水溶液中的酸碱滴定时,HF在碱中的酸性最强。
2.以草酸为基准物质,用来标定NaOH溶液的浓度,但因保存不当,草酸失去部分结晶水,请问此草酸标定NaOH溶液浓度的结果是()。
[中国科学院大学2013研] A.偏低B.偏高C.无影响D.不确定【答案】A3.增加电解质的浓度,会使酸碱指示剂的理论变色点()。
[华南理工大学2012研]A.变大B.变小C.不变D.无法判断【答案】B4.以下溶液稀释10倍时pH改变最大的是()。
[厦门大学2011研]A.0.1mol/L NaAc和0.1mol/L HAc溶液B.0.1mol/L NH4Ac和0.1mol/L HAc溶液C.0.1mol/L NH4Ac溶液D.0.1mol/L NaAc溶液【答案】D【解析】AB两项,为缓冲溶液,改变浓度时pH改变较小;C项,为两性物质,浓度增加后pH改变也不大。
5.欲用酸碱滴定法在水溶液中测定NaAc试剂的纯度,采用指示剂确定终点,达到0.2%准确度,以下何种方法可行?()[南开大学2009研]A.提高反应物浓度直接滴定B.采用返滴定法测定C.选好指示剂,使变色点与化学计量点一致D.以上方法均达不到【答案】D6.用0.0500mol·L-1的HCl溶液滴定浓度为0.0500mol·L-1二元弱酸盐Na2A溶液,当pH=10.25时,,当pH=6.38时,,求滴定至第一化学计量点时,溶液的pH值是多少?()(用最简公式计算)[四川大学2005研] A.8.32B.10.25C.6.38D.7.00【答案】A【解析】当,;当,。
从而可以求得,可以求得第一化学计量点时的最简公式为解得pH=8.32。
二、填空题1.甲基橙的变色范围是pH=______,当溶液的pH小于这个范围的下限时,指示剂呈现______色,当溶液的pH大于这个范围的上限时则呈现______色,当溶液的pH处在这个范围之内时,指示剂呈现______色。
武汉大学分析化学试题集(内附答案)

是固定相。
14..定量分析过程包括
,
,
,
和
。
二、简答题(每小题 4 分,共 20 分, 答在所留空白处) 1. 什么是基准物质?什么是标准溶液? 2. 分别简单阐述酸碱滴定指示剂,络合滴定指示剂, 氧化还原滴定指示剂
和沉淀滴定指示剂指示滴定终点的原理. 3. 在进行络合滴定时,为什么要加入缓冲溶液控制滴定体系保持一定的 pH? 4. 吸光光度法中测量条件的选择应注意哪几点? 5. 分析化学中常用的分离和富集方法有哪些?(回答不能少于 8 种方法)
w(KBr)= ────────────×100% = 47.60% 50.00
1.000× ────×1000 200.0
2.解: 根据题意:
lgK’CaY=10.7-0.45=10.25, lgK’MgY=8.7-0.45=8.25, (2 分)
lgK’CaIn=5.4-1.6=3.8,
lgK’MgIn=7.0-1.6=5.4, (2 分)
四.计算(共 40 分,写在答题纸上)
1.称取含 KBr 和 KI 的混合试样 1.000 g, 溶解并定容至 200 mL 后, 作如下 测定:
(1) 移取 50.00 mL试液, 在近中性条件下, 以溴水充分处理, 此时I- 量转变 为 IO3-。 将溴驱尽, 加入过量 KI 溶液, 酸化, 生成的 I2采用淀粉指示 剂, 以 0.1000 mol/L Na2S2O3 溶液滴定至终点时, 消耗 30.00 mL。 (5 分)
武汉大学 2005-2006 学年度第一学期《分析化学》期末 考试试卷答案(A)
学号
姓名
院(系)
分数
有效数字不对总共扣 0.5 分
一、填空(每空 1 分,共 35 分) 1.(1)[H+]+[H3PO4]= [OH-]+[NH3] +[HPO42-]+2[PO43-]
武汉科技大学物理化学考研真题试题2005—2010、2016、2019年(含标准答案)

1.
点G
2 A(s),l
2
点E
3 A(s), D(s), l
0
点H
1 D(s)
1
区Ⅰ
2 D(s),l
1
2. 固相质量为: w(s) a ' f 'Aw(总) 1 15kg 5kg
a'a
3
液相质量为: w ( l ) = (15-10) kg =10 kg.
3. a
b
c
l → D(s)
l 消失
l → D(s)+B(s)
= -5154 kJ·mol-1
f H (C10H8 ) = 10fH ( CO2 ) + 4fH ( H2O, l ) - rH =[10(-393.51) + 4(-285.83) -5154 ] kJ·mol-1= 75.6 kJ·mol-1
四、(14 分) 解:1. r G (1) (1000K)= 5440 J·mol -1; r G (2)(1000K) = 3352 J·mol -1
5. 常数:F=96500C·mol-1;L=6.022×1023 mol-1;R=8.315J·mol-1 K-1
一、填空题 ( 每空 2 分;共 44 分) 1. 在外压恒定为 101325 kPa,温度恒定为10℃的条件下,发生下列相变过程:
H2O ( l ) H2O ( s ) 此过程的Sm (1) ; Hm (2) ;Gm (3) ;环境的熵变 S(环) (4) ;S(隔) (5) 。(选填 > 0 ,= 0 ,< 0 或不能确定)
2. 某液体的正常沸点为 127℃,该液体在此温度下的摩尔蒸发焓为 3520 kJ·mol-1,则在此 温度附近其蒸气压随温度的变化率 dp/dT = (6) 。 3. 60℃时,甲醇和乙醇的饱和蒸汽压分别为 83.39 kPa 和 47.01 kPa。两者可形成理想液态混
武汉大学分析化学2005试卷A

武汉大学分析化学2005试卷A第一篇:武汉大学分析化学2005试卷A武汉大学2005-2006学年度第一学期《分析化学》期末考试试卷(A)一.填空(每空1分。
共35分)1.写出下列各体系的质子条件式:(1)c1(mol/L)NH4H2PO4(2)c1(mol/L)NaAc+ c2(mol/L)H3BO32.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长,透射比。
3.检验两组结果是否存在显著性差异采用检验法,检验两组数据的精密度是否存在显著性差异采用检验法。
4.二元弱酸H2B,已知pH=1.92时,δ=δ;pH=6.22时δ=δ, 则H2B HB-HB-B2-H2B的pKa1=,pKa2=。
5.已知ϕΦ(Fe3+/Fe2+)=0.68V,ϕΦ(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 mol/L Ce4+滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为,化学计量点电位为,电位突跃范围是。
6.以二甲酚橙(XO)为指示剂在六亚甲基四胺缓冲溶液中用Zn2+滴定EDTA,终点时溶液颜色由_________变为__________。
7.某溶液含Fe3+10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg,3+则Fe在两相中的分配比=。
8.容量分析法中滴定方式有, ,和。
9.I2与Na2S2O3的反应式为。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最大处的波长叫做,可用符号表示。
11.紫外可见分光光度计主要由,,四部分组成.12.桑德尔灵敏度以符号表示,等于;桑德尔灵敏度与溶液浓度关,与波长关。
13.在纸色谱分离中,是固定相。
14..定量分析过程包括,,和。
二、简答题(每小题 4分,共20 分,答在所留空白处)1.什么是基准物质?什么是标准溶液? 2.分别简单阐述酸碱滴定指示剂,络合滴定指示剂, 氧化还原滴定指示剂和沉淀滴定指示剂指示滴定终点的原理.3.在进行络合滴定时,为什么要加入缓冲溶液控制滴定体系保持一定的pH? 4.吸光光度法中测量条件的选择应注意哪几点?5.分析化学中常用的分离和富集方法有哪些?(回答不能少于8种方法)三、分析方法设计(共15分,写在答题纸上)1.设计测定含有中性杂质的Na2CO3与Na3PO4混合物中二组分质量分数的分析方案。
武汉科技大学环境化学2005考研专业课真题

2.已知干空气中CO2的含量为0.0314%(体积),水在25℃时的蒸汽压为0.0 3167×105Pa,CO2的亨利常数为3.34×10-7mol/(L.Pa)( 25℃),计算CO2在水中溶解度。(已知:碳酸的第一级解离常数K1=4.45×10
-7,本题8分)
3.在一个pH为10.0的SO42-—HS-体系中(25℃),其反应为:
共2页
第2页
四.论述题(每题16分,共32分) 1. 谈一谈你对温室效应及温室气体的认识。 2.试从以下几个方面介绍一种你所熟悉的水环境污染物。
(1)该污染物的来源;(2)该污染的主要危害;(3)该污染物现阶段的主要治 理技术。
生物降解作用(水环境中有机污染物) 二.简答题(每题8分,共56分)
水的总含盐量(TDS)
1.环境化学研究的内容主要包括那些方面? 2.简述光化学第一定律和第二定律内容。 3.用方程式表示光化学烟雾形成机制中的引发反应。 4.简述大气颗粒物的三模态模型,并简单分析三模态模型中粗粒子和细 粒子之间能否相互转化。 5.影响酸雨形成的主要因素包括哪些? 6.水的总碱度是什么含义?写出它的表达式。 7.简要回答有机物在土壤(沉积物)中的吸着存在的两种机理。 三.计算题(共32分) 1.Freon-22(CHClF2)的蒸发热△Hv=R(42717.96T),且在T1=300K时蒸汽压P1=10.86×(1.013×105)Pa,试导出其蒸汽 压的计算公式。(本题8分)
武汉科技大学 2005年硕士研究生入学考试试题
考试科目及代码:环境化学 412 说明:1.适用招生专业 : 2.可使用的常用工具: 环境工程 计算器 共2页 第1页
3.答题内容写在答题纸上,写在试卷或草稿纸上一律无效。 一.名词解释(每题5分,共30分) 地球环境系统 光化学烟雾 化学耗氧量(COD) 湖泊的富营养化
武汉纺织大学物理化学2005,2007-2013,2015,2017年考研初试真题+2012答案

两个反应的 rGm 分别为 Gr m,1 与 rGm,2 ,则两者的关系为 rGm,2 =_______。
7. 在 一 定 T 、 P 下 , 由 纯 A(l) 与 纯 B(l) 混 合 而 成 理 想 液 态 混 合 物 , 此 过 程 的
mixV _______0, mixSm _______0, G mix m ______0(填>,<或=)。
(B) Ea Eb, Ka Kb
(C) Ea Eb, Ka Kb
(D) Ea Eb, Ka Kb
11. 在等温等压下,化学反应系统达平衡时,下列式子不一定成立的是_______
(A) ΣνBμB=0(B) NhomakorabeaG / T,P =0
(C) rGm =0
(D) rGm =0
12. 天空中有大小不等的小水滴,在运动中,这些水滴的变化趋势是______
(A) 大水滴分散成小水滴,半径趋于相等
(B) 大水滴变大,小水滴变小趋于消失
(C) 大小水滴的变化没有规律
(D) 不会有什么变化
共 4 页;第 2 页
13. 表面活性物质一个很重要的特征是_______
2. 现有 A、B 两种水溶液,A 的渗透压较 B 的低,当 A、B 之间隔有半透膜时,水的
渗透方向是从__________。
3. 过饱和溶液中的溶质与纯溶质的化学势分别为 μ1 和 μ2,则 μ1_____μ2 (填>,<或=)。
4. 将固态的 NH4Cl(s)放入一抽空容器中,并使它达到平衡 NH4Cl(s)=NH3(g) + HCl(g)
本试卷总分 150 分,考试时间 3 小时。
一、选择题(每题 2 分,共 30 分)
