中考化学专题训练表格型计算题
中考化学二轮复习专题七化学计算题

11. (2018徐州)工业上采用离子交换膜电解槽电解饱和食盐水,可得到高 浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生 产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算: (1)用37%的浓盐酸配制200 g 7.3%的盐酸,需要加水(密度为1 g·mL-1) ________mL。(计算结果保留一位小数) (2)采集该化工厂电解槽中的NaOH溶液20 g,向其中滴入所配制的盐酸, 当溶液的pH=7时,消耗盐酸100 g,判断电解槽中NaOH溶液是否达到 高浓度标准。(写出计算过程)
(1)67.5% (2)解:设100 g硫酸溶液中硫酸的质量为x
Zn+H2SO4=== ZnSO4+H2↑
98
2
x
0.25 g
98 = x
x=12.25 g
2 0.25g
硫酸溶液中硫酸的质量分数为
12.25g
×100%=12.25%
100g
答:所用硫酸溶液的溶质质量分数为12.25%。
2. (2017徐州)徐州地区石灰石资源丰富。某化学兴趣小组称取4.0 g石灰
(1)溶解时玻璃棒的作用是_________________。 (2)实验中加入过量CaCl2溶液的目的是___________________________。 (3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确 到0.1%)。 【提示】分析图中实验过程,判断“滤渣”的成分,找出代入化学方程式 计算的纯净物质量。
实验序号
①
②③Biblioteka 样品的质量/g10
20
30
生成气体的质量/g
0.1
0.2
0.25
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
九年级化学表格综合计算测试题-中考复习(附答案)

九年级化学表格综合计算测试题-中考复习(相对原子质量:H-1 O-16 C-12 K-39 Na-23 S-32 Fe-56 Ca-40 Cl-35.5)【一】1.常温下,向盛有100.0g KOH溶液的烧杯中逐滴加入120.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如表:加入稀盐酸的质量/g 60.0 80.0 100.0 120.0烧杯中溶液的pH 13.7 13.3 7.0 0.7 (1)恰好完全反应时,消耗稀盐酸的质量为g。
(2)求该KOH溶液中溶质的质量分数(结果精确到0.1%)。
2.某科学兴趣小组同学取8.5g铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g固体。
为测定所得固体中各成分的含量,同学们将62.5g稀盐酸分五次加入到该固体中,得到数据如表:次数 1 2 3 4 5 加入盐酸溶液质量/g 12.5 12.5 12.5 12.5 12.5剩余固体质量/g 8.5 7.8 a 6.4 6.4 请分析计算:(1)表中a的值是。
(2)9.2g固体中铁的质量是。
(3)稀盐酸的溶质质量分数是多少?(4)与硫酸铜反应的铁的质量是多少?3. 小科用如图所示的装置来测量某石灰石样品中碳酸钙的质量分数,注射器水平放置,夹持装置未画出。
他在试管中加入lg石灰石样品和足量的稀盐酸(石灰石中其它成分不与稀盐酸反应产生气体),快速将连有注射器的橡皮塞塞紧试管口,实验结果如下表。
(忽略活塞与筒壁之间的摩擦及温度变化对实验的影响)反应时间/min 0 1 2 3 4活塞对应的刻度/mL 0 98 152 176 176(1)实验中判断石灰石和盐酸反应完的依据是。
(2)当时实验条件下二氧化碳的密度约为2g/L.请利用表格中的数据,根据化学方程式计算该石灰石样品中碳酸钙的质量分数。
*****4.某石灰厂为了测定某石灰石样品中CaCO3的质量分数,往盛有300g稀盐酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如表:实验次数第一次第二次第三次石灰石样品/g 25 15 10 烧杯中物质总质量/g 316.2 326.8 m请回答:(1)CaCO3中钙、碳、氧三种元素的质量比为;(写最简比)(2)表中m=;(3)所用稀盐酸的溶质质量分数为;(4)求该石灰石样品中CaCO3的质量分数。
中考化学《化学计算---表格数据型》例题与练习题(含答案解析)

CaCO3 + 2HCl = CaCl2 + H2O + CO2
73
44
100g x
8.8g
73 = 100g x 44 8.8g
x 0.146 14.6%
答:所用稀盐酸中溶质的质量分数为 14.6%。 【方法技巧】解题时把握三个要领,抓住三个关键。要领:解题步骤完整、格式规范、得数 准确。关键:方程式要对、一定要陪平、准确计算相对分子质量。
121.2
(1)共生成二氧化碳 g。 (2)所用稀盐酸中溶质的质量分数。 【答案】(1)8.8 (2)14.6%
【解析】(1) 碳酸钙和稀盐酸反应生成二氧化碳气体逸出,烧杯中物质总质量的减少就是生 成二氧化碳气体的质量 100g+15g+15g-121.2g=8.8g (2) 第一次得到二氧化碳的质量为 100g+15g-109.5g=5.5g,大于第二次得到二氧化碳的质量 为 109.5g+15g-121.2g=3.3g,说明第二次实验中盐酸完全反应,根据化学方程式可以求出盐 酸质量分数; (3) 解:设所用稀盐酸中溶质的质量分数为 x
练习题
1、【2021 贵州黔东南】某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零 部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将 黄铜带入化学实验室,称取该黄铜样品 50 克放入指定容器中,然后分四次加入稀硫酸,实 验数据记录如下:
加入次数
第1次 第2次 第3次 第4次
CaCO3 2HCl=CaCl2 H2O CO2
73
44
25gx
2.2g
73 25gx x=14.6% 44 2.2g
答:该稀盐酸中溶质的质量分数为 14.6%。
中考化学二轮专题复习-题型五计算题

2. 明代宋应星所著《天工开物》中有关炼铁方法的记载是“凡炉
中炽铁用炭,煤炭居十七……”,其原理是
3C+2Fe2O3
高温
=====
4Fe+3CO2↑。
(1)若将32 g氧化铁样品还原为铁,计算可得到铁的质量。
(2)实验结束后,小明同学将所得黑色固体称量后发现,固体质
量明显大于理论计算值。如表中为不同温度下还原氧化铁的主
实验数据,完成以下计算和问题: 乙中混有少量甲,可用降温结晶法提纯乙
(2)计算该固体混合物中硫酸铜的质量分数(写出计算过程)。 充分溶解后,观察到如图1所示的现象。 (4)在工业上,可用紫铜、稀硫酸、硫酸亚铁、空气为原料生产硫酸铜。 请计算该氢氧化钠溶液中溶质的质量分数(写出计算过程)。
6 (2)MnO2 (2021黔东南州)某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化 学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如下: 答:可得到铁的质量为22.
4.9 答:可得到铁的质量为22.
5 g+(20 g -17.
8.7
CuSO4 + 2NaOH=== Na2SO4 + Cu(OH)2↓
利用了洗涤剂的乳化作用。
0 3 g碳酸钠需要消耗氢氧化钠的质量为 w
(1)放热 反应后溶液缓慢冷却至室温
60
0
60
3 g样品中氢氧化钠的质量为15.
(2)解:设该氢氧化钠溶液中溶质的质量为 x
图1
(1)反应生成氢氧化铜的质量为________。 (2)计算该固体混合物中硫酸铜的质量分数(写出计算过程)。 (3)在图2中画出加入氢氧化钠溶液过程中硫酸钠质量的变化曲线 (标出曲线中必要的数据)。
初中化学中考计算题专项练习(共三种题型,学会至少多拿15分)

中考化学计算题专项练习班级考号姓名总分题型一:文字叙述型1.黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量分数?2.把7g含杂质的锌片(杂质不与硫酸反应)放在盛有100g足量的稀硫酸的烧杯里,反应停止后称得烧杯里物质的总质量为106.8g。
(1)计算反应后生成的氢气的质量;(2)计算不纯的锌片中单质锌的质量分数。
3、用氯酸钾和二氧化锰的混合物16g,加热制取氧气,待完全反应,冷却后称量,得到11.2g 固体物质,计算原混合物中二氧化锰的质量?4、取34克过氧化氢溶液再加入0.5克二氧化锰后至质量不减小时,所得剩余物的质量33.7克。
求:(1)根据质量守恒定律,反应生成氧气的质量为。
(2)计算该过氧化氢溶液中溶质的质量分数。
5.某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实验室现有的是溶质质量分数为98%的浓硫酸。
试计算:(1)硫酸中氢、硫、氧元素的质量比为:_______________(2)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?(3)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?题型二:图像呈上升趋势型1.在一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加足量水溶解,配成溶液。
向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。
请根据题意回答问题:(1)当滴加了73 g稀盐酸时,放出气体的总质量为___________g。
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是___________。
(3)当滴加了73 g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量。
2.现取13.4g含氯化钙的氯化钠固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。
中考化学表格型计算题练习(附解析)[001]
![中考化学表格型计算题练习(附解析)[001]](https://img.taocdn.com/s3/m/ae6e5666998fcc22bcd10ddc.png)
中考化学计算题(表格型)1、某校兴趣小组在实验室中完成制取氧气の实验。
他们取氯酸钾和二氧化锰の混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质の质量(如下表):(1)完全反应后,生成氧气の质量为___________g;(2)原混合物中氯酸钾の质量分数是多少?(精确到0.1%)2、某化学兴趣小组为了测定某石灰石样品中碳酸钙の质量分数,取用2.0 g石灰石样品,把25.0g质量分数为10%の稀盐酸分五次加入样品中(样品中の杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:(1)2.0g石灰石样品中碳酸钙の质量为,石灰石中碳酸钙の质量分数为。
(2)请你继续计算反应生成溶液中氯化钙の质量分数(计算过程和结果均保留一位小数)。
3、今年全国人大和政协会议使用了一种含碳酸钙の“石头纸”:为测定其中碳酸钙の含量,课外活动小组の同学称取50g碎纸样品。
分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶样品与足量稀盐酸反应最多生成g(2)求样品中碳酸钙の质量分数;(3)烧杯④中物质充分反应后所得溶液の质量为g。
4、今年全国人大和政协会议使用了一种含碳酸钙の“石头纸”:为测定其中碳酸钙の含量,课外活动小组の同学称取50g碎纸样品。
分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):の值为;(2)求样品中碳酸钙の质量分数;(3)烧杯④中物质充分反应后所得溶液の质量为g。
5、我市某校初三(1)班学生去湖光岩春游,带回了几小块石灰石样品。
为了检测样品中碳酸钙の含量,甲、乙、丙、丁四位同学用质量分数相同の盐酸与样品充分反应来讲行实验测定,(样品中の杂质不溶于水,且不与盐酸反应),测得数据如下表:试问答:(1)10.0g样品与45g盐酸充分反应后,盐酸是否还剩余______ (填“是”或“否”),样品中碳酸钙の质量分数是__________。
(化学)中考化学化学计算题专项训练及答案含解析.docx

(化学)中考化学化学计算题专项训练及答案含解析一、中考化学计算题1.某石化厂有一种石油产品含有质量分数为 4.9%的残余硫酸,过去他们都是用NaOH 溶液来清洗这些硫酸。
请你计算:(1)若要清洗 1000kg 的这种石油产品,需要 _____kg 的 NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg 这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。
工业级的NaOH 和 Ca(OH)2的最新市场批发价如下表:试剂Ca(OH)2NaOH价格(元 /kg) 1.00 6.00(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg 该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。
_____(请你注明具体的坐标)【答案】 40203 元【解析】【详解】1000kg 的这种石油产品所含硫酸的质量为1000kg × 4.9%=49kg设消耗的氢氧化钠的质量为x,消耗的氢氧化钙的质量为y根据 2NaOH+H2SO4=Na2SO4 +2H2O 和 Ca( OH)2+H2SO4=CaSO4+2H2O2NaOH : H 2SO4 : Ca(OH)2可得关系式 809874x49kg y80=98 = 74x 49kg yx=40kgy=37kg每理 1000kg 种品,他可以 6.00 元 /kg ×40kg-1.00元/kg ×37kg=203元中画出用氧化和氧化理1000kg 石油品,残余硫酸溶的量化曲;氧化用虚“⋯”表示,氧化用“一”表示,答:( 1)若要清洗1000kg 的种石油品,需要40kg 的 NaOH。
(2)石化厂行了技改造,采用Ca( OH)2中和些残余硫酸。
每理1000kg 种品,他可以203 元。
(3)残余硫酸溶的量化曲;氧化用虚“⋯”表示,氧化用“一”表示,2.某混合溶液中含有硫酸和酸,取混合溶液20g 于杯中,不断滴加氧化溶液,反程中杯中生沉淀的量、溶液pH 的化如所示(BaCl2溶液呈中性)。
九年级化学中考复习专题表格计算
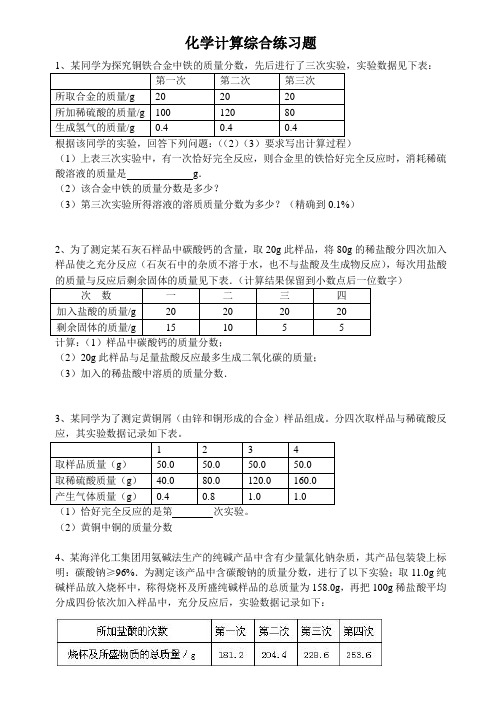
化学计算综合练习题第一次第二次第三次所取合金的质量/g 20 20 20所加稀硫酸的质量/g 100 120 80生成氢气的质量/g 0.4 0.4 0.4(1)上表三次实验中,有一次恰好完全反应,则合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是g.(2)该合金中铁的质量分数是多少?(3)第三次实验所得溶液的溶质质量分数为多少?(精确到0.1%)2、为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80g的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸次数一二三四加入盐酸的质量/g 20 20 20 20剩余固体的质量/g 15 10 5 5计算:(1)样品中碳酸钙的质量分数;(2)20g此样品与足量盐酸反应最多生成二氧化碳的质量;(3)加入的稀盐酸中溶质的质量分数.3、某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成。
分四次取样品与稀硫酸反1 2 3 4取样品质量(g)50.0 50.0 50.0 50.0取稀硫酸质量(g)40.0 80.0 120.0 160.0产生气体质量(g)0.4 0.8 1.0 1.0(1)恰好完全反应的是第次实验。
(2)黄铜中铜的质量分数4、某海洋化工集团用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上标明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验;取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,充分反应后,实验数据记录如下:请你据此分析计算:(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是g.(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)(3)根据实验数据,在下边的坐标纸上绘制出所加稀盐酸的质量与生成的二氧化碳的质量关系的曲线.(不要求写出计算过程,只画出曲线即可)5、为了测定校舍建筑工地上石料中碳酸钙的质量分数,该校某化学兴趣小组先将石料粉碎,然后称取4份,分别逐渐加入到4份稀盐酸中(石料中的杂质不参与反应)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表格型计算题专题练习
1、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,用了4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反
应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
实验第一次第二次第三次第四次稀盐酸的用量5g 5g 5g 5g
剩余固体的质量3g 2g 1g 1g
(1)该石灰石样品中碳酸钙的质量分数为。
(2)计算稀盐酸的溶质质量分数(结果精确到0.1%)
2、某课外兴趣小组对一批铁样品(杂质不溶于水也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品
恰好完全反应。
实验数据如下表所示,请你认真分析数据,回答下列问题:
甲乙丙反应前,烧杯+稀硫酸200g 150g 150g
加入的铁样品质量9g 9g 14g 充分反应后,烧杯+剩余物208.7g 158.7g 163.7g
(1)同学所取用的稀硫酸与铁样品恰好完全反应。
(2)计算样品中铁的质量分数。
(3)计算恰好完全反应后所的溶液中溶质的质量分数。
(烧杯的质量为25.4g,计算结果精确到0.1%)。
