乙烷和乙烯的结构和性质的比较
(整理)高中化学必修2第三章《有机化合物》教材分析与教学建议

精品文档人教版高中化学必修2第三章《有机化合物》教材分析与教学建议一、本章节内容的地位和功能必修模块的有机化学内容,是以典型有机物的学习为切入点,让学生在初中有机物常识的基础上,能进一步从结构的角度,加深对有机物和有机化学的整体认识。
选取的代表物有甲烷、乙烯(制品)、乙醇(酒)、乙酸(醋)、糖、油脂、蛋白质等,这些物质都与生活联系密切,是学生每天都能看到、听到的,使学生感到熟悉、亲切,可以增加学习的兴趣与热情。
必修模块的有机化学具有双重功能,即一方面为满足公民基本科学素养的要求,提供有机化学中最基本的核心知识,使学生从熟悉的有机化合物入手,了解有机化学研究的各个方面,象和物质用途;好最基本的知识基础研究方法,激发他们深入学习的欲望。
二、内容结构与特点分析精品文档 本章的内容结构可以看成是基础有机化学的缩影或概貌,可表示如下:这些典型代表物,基本涵盖了基础有机化学的各类物质,以期使学生能从中了解有机化学的概貌。
根据课程标准和学时要求,本章没有完全考虑有机化学本身的内在逻辑体系,主要是选取典型代表物,介绍其基本的结构、主要性质以及在生产、生活中的应用,较少涉及到有机物的类概念和它们的性质(如烯烃、芳香烃、醇类、羧酸等)。
为了学习同系物和同分异构体的概念,只简单介绍了烷烃的结构特点和主要性质,没有涉及烷烃的系统命名等。
教材特别强调从学生生活实际和已有知识出发,从实验开始,组织教学内容,尽力渗透结构分析的观点,使学生在初中知识的基础上有所提高。
精品文档为了帮助学生理解内容,教材增加了章图、结构模型、实验实录图、实物图片等,丰富了教材内容,提高了教材的可读性和趣味性。
为了帮助学生认识典型物质的有关反应、结构、性质与用途等知识,教材采用了从科学探究或生活实际经验入手,充分利用实验研究物质的性质与反应,再从结构角度深化认识。
如:甲烷、乙烯的研究,乙醇结构的研究,糖和蛋白质的鉴定等,都采用了较为灵活的引入方式。
烯烃的知识点总结

烯桂的知识点总结-CAL-FENGHAI-(2020YEAR-YICAI) JINGBIAN第三节乙烯烯婭•教学目的:1、了解乙烯的物理性质和主要用途,掌握乙烯的化学性质和实验室制法。
2、使学生了解加成反应和聚合反应以及不饱和桂的概念。
3、使学生了解烯桂在组成、结构、主要化学性质上的共同点,以及物理性质随碳原子数的增加而变化的规律。
•教学重点:乙烯的化学性质。
•教学难点:乙烯的结构以及与化学性质的关系。
教学过程:[引入]何谓烷桂其通式如何它属于何类绘(饱和链绘)与此相对应就应该有不饱和绘。
另外有机物之所以种类繁多,除了存在大量的同分异构现象, 在有机物中碳原子除了可以形成C-C,还可能形成或—C三C 」\从而使得碳原子上的氢原子数少于饱和链桂里的氢原子数。
这样的怪叫做不饱和炷。
[板书]不饱和婭:性分子里含有碳碳双键或碳碳三键,碳原子所结合的氢原子数少于饱和链坯里的氢原子数,这样的坯叫做不饱和坯。
[讲解]根据烧分子中碳原子的连接方式不同,怪可以分为如下类别:饱和单一一烷坯链r \ r烯烧余未饱和绘v I烘烧I环婭1[过渡]今天我们来学习最简单的烯绘一一乙烯。
一.乙烯来源及用途1•乙烯的來源和用途⑴来源从石油中获得乙烯,已成为目酢丁妆上生产乙烯的主姜途径,乙烯是石油 的裂鋤产物•乙烯的产址可以用来衡量一个园家的石油化工发展水平。
(2)用途(一聚乙烯塑料一> 食品袋、餐具.地膜等 T聚乙嫦纤维-无纺布-乙醇一燃料、化工原料 T 涤纶―纺织材料等乙烯一洗涤剂、乳化剂;防冻液1-酷酸纤维念B 类―增塑剂-杀虫剂、植物生长凋节剂T 聚氯乙烯塑料i 包装疲、管材等 一合成润滑油、高级醇、聚乙二醇二. 乙烯的分子组成和结构1> [设问h(1)把乙烷C2H6中H 原子去掉两个就变成了乙烯QHs 根据每个原子通过共饱和的原理,试推导C2H4中共价键是怎样组成H H:C :: C : H分子式:C 2H 4 最简式:CH 2结构简式:CH 2=CH 2 结构式:(2)展示乙烯和乙烷的球棍模型,对比两者有何不同2、[讲解]给出下表为乙烷和乙烯的结构比较:用电子对达到 的 电子式:H[设问](I)乙烯中c=c双键可否认为是两个C-C的加和不能,因为C==C键能小于c—C单键键能的2倍,615<2X384 = 768 (2)通过键能大小来看,乙烯和乙烷哪个化学性质较活泼乙烯为平面分子,键角为120。
知识讲解_乙烯(基础)
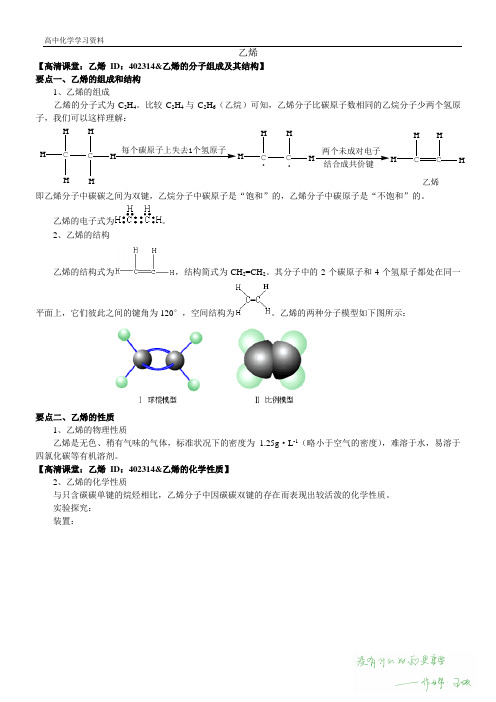
乙烯【高清课堂:乙烯ID:402314&乙烯的分子组成及其结构】要点一、乙烯的组成和结构1、乙烯的组成乙烯的分子式为C2H4。
比较C2H4与C2H6(乙烷)可知,乙烯分子比碳原子数相同的乙烷分子少两个氢原子,我们可以这样理解:CHHH C HHH每个碳原子上失去1个氢原子CHHC HH.两个未成对电子结合成共价键CHHC HH乙烯.即乙烯分子中碳碳之间为双键,乙烷分子中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
乙烯的电子式为。
2、乙烯的结构乙烯的结构式为,结构简式为CH2=CH2。
其分子中的2个碳原子和4个氢原子都处在同一平面上,它们彼此之间的键角为120°,空间结构为。
乙烯的两种分子模型如下图所示:要点二、乙烯的性质1、乙烯的物理性质乙烯是无色、稍有气味的气体,标准状况下的密度为1.25g·L-1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
【高清课堂:乙烯ID:402314&乙烯的化学性质】2、乙烯的化学性质与只含碳碳单键的烷烃相比,乙烯分子中因碳碳双键的存在而表现出较活泼的化学性质。
实验探究:装置:实验步骤与现象:实验步骤实验现象将气体通入酸性高锰酸钾溶液中溶液褪色将气体通入溴的四氯化碳溶液中溶液褪色用排水法收集气体验纯后,点燃火焰明亮,伴有黑烟结论一:石蜡油分解产生了能使高锰酸钾溶液、溴的四氯化碳溶液褪色的气态产物,由此可知产物中含有与烷烃性质(烷烃不能使酸性高锰酸钾溶液褪色)不同的烃。
结论二:研究表明,石蜡油分解的产物主要是乙烯和烷烃的混合物。
要点诠释:a.碎瓷片起催化作用。
b.高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c.酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d.酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化乙烯使酸性高锰酸钾溶液褪色的实质是乙烯被酸性高锰酸钾溶液氧化。
高中化学必修二优质学案:3.2.1 从天然气、石油和煤中获取燃料 石油裂解与乙烯

第2节 从化石燃料中获取有机化合物第1课时 从天然气、石油和煤中获取燃料 石油裂解与乙烯[知识梳理]知识点一 从天然气、石油和煤中获取燃料化石燃料又叫做矿石燃料、矿物燃料,上图就是天然气、煤、石油的三种应用,如何从中获取燃料呢?请学习下列知识点。
1.天然气和煤直接用作燃料 (1)天然气的主要成分:甲烷 ①存在:天然气、沼气、可燃冰等。
②物理性质③甲烷的燃烧现象:甲烷能够安静地燃烧,火焰明亮且呈淡蓝色。
化学方程式:CH 4+2O 2――→点燃CO 2+2H 2O 。
(2)煤直接燃烧煤可得到人们所需的能量,但也会带来大气污染物,如硫的氧化物,氮的氧化物,烟尘等。
2.从石油中获取燃料 (1)石油的组成①组成元素:主要是C 、H 两种元素,质量分数之和高达98%。
②主要物质:石油是由分子含有不同数目碳原子的烷烃、环烷烃等组成的复杂混合物。
(2)石油的炼制(3)裂化方程式(以十六烷为例): C 16H 34十六烷――→催化剂△C 8H 18辛烷+C 8H 16辛烯燃烧方程式(以辛烷为例):2C 8H 18+25O 2――→点燃16CO 2+18H 2O 知识点二 石油裂解与乙烯1.石油裂解(1)(2)石蜡分解的实验探究①实验装置②实验现象B处:溶液紫色褪去。
C处:溶液褪色。
D处:点燃时火焰明亮并伴有黑烟。
③实验结论Ⅰ.在炽热碎瓷片的作用下,石蜡油分解产生了能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色的气态产物。
Ⅱ.气态产物中含有与烷烃性质不同的烃,实际是烯烃和烷烃的混合物。
2.乙烯(1)组成与结构(2)物理性质(3)化学性质分析下列实验,总结乙烯的化学性质①乙烯的氧化反应a.乙烯的可燃性:乙烯在空气中燃烧的方程式为C2H4+3O2――→点燃2CO2+2H2O。
b.乙烯能被KMnO4(H+)溶液氧化。
②乙烯的加成反应乙烯能使溴水或溴的四氯化碳溶液褪色,发生加成反应。
Ⅰ.定义:有机化合物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应属于加成反应。
高中化学必修2之知识讲解_乙烯(基础)-
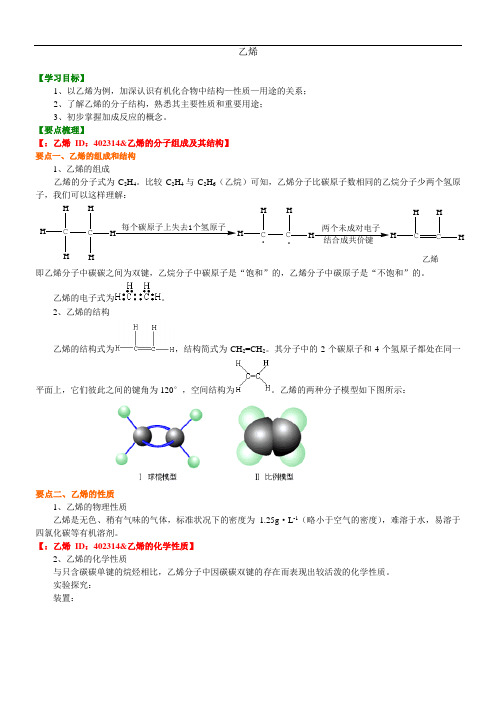
乙烯【学习目标】1、以乙烯为例,加深认识有机化合物中结构—性质—用途的关系;2、了解乙烯的分子结构,熟悉其主要性质和重要用途;3、初步掌握加成反应的概念。
【要点梳理】【:乙烯ID:402314&乙烯的分子组成及其结构】要点一、乙烯的组成和结构1、乙烯的组成乙烯的分子式为C2H4。
比较C 2H4与C2H6(乙烷)可知,乙烯分子比碳原子数相同的乙烷分子少两个氢原子,我们可以这样理解:C HHH C HHH每个碳原子上失去1个氢原子CHHC HH.两个未成对电子结合成共价键CHHC HH乙烯.即乙烯分子中碳碳之间为双键,乙烷分子中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
乙烯的电子式为。
2、乙烯的结构乙烯的结构式为,结构简式为CH2=CH2。
其分子中的2个碳原子和4个氢原子都处在同一平面上,它们彼此之间的键角为120°,空间结构为。
乙烯的两种分子模型如下图所示:要点二、乙烯的性质1、乙烯的物理性质乙烯是无色、稍有气味的气体,标准状况下的密度为1.25g·L-1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
【:乙烯ID:402314&乙烯的化学性质】2、乙烯的化学性质与只含碳碳单键的烷烃相比,乙烯分子中因碳碳双键的存在而表现出较活泼的化学性质。
实验探究:装置:实验步骤与现象:实验步骤实验现象将气体通入酸性高锰酸钾溶液中溶液褪色将气体通入溴的四氯化碳溶液中溶液褪色用排水法收集气体验纯后,点燃火焰明亮,伴有黑烟结论一:石蜡油分解产生了能使高锰酸钾溶液、溴的四氯化碳溶液褪色的气态产物,由此可知产物中含有与烷烃性质(烷烃不能使酸性高锰酸钾溶液褪色)不同的烃。
结论二:研究表明,石蜡油分解的产物主要是乙烯和烷烃的混合物。
要点诠释:a.碎瓷片起催化作用。
b.高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c.酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
2020-2021学年化学人教版必修2学案:3.2.1乙烯

第二节来自石油和煤的两种基本化工原料[激趣导读] 1864年,美国人发现一件奇怪的事情,煤气灯泄漏出的气体可使附近的树木提前落叶。
1892年,在亚速尔群岛,有个木匠在温室里无意中将美人蕉屑点燃,其烟雾使温室的菠萝一齐开了花。
1908年,美国有人将康乃馨移植到装有石油照明灯的芝加哥温室中,结果康乃馨一直没有开花。
针对上述事实,科学家们进行了大量的研究,结果发现原来这都是乙烯捣的鬼。
[目标] 1.掌握乙烯的分子结构、主要性质及重要应用。
2.掌握苯的分子结构特征、性质和主要用途。
3.掌握加成反应的特点。
4.理解物质结构与性质的关系。
第1课时乙烯一、烯烃的概念和组成1.概念:分子中含有一个碳碳双键的烃。
2.分子通式:C n H2n(n≥2),最简单的烯烃为乙烯。
二、乙烯1.烯烃的工业制取原理的实验2.乙烯的组成和结构3.乙烯的物理性质4.乙烯的化学性质(1)氧化反应①乙烯在空气中燃烧,火焰明亮,伴有黑烟,燃烧的化学方程式为CH 2===CH 2+3O 2――→点燃2CO 2+2H 2O。
②乙烯能被酸性KMnO 4溶液等氧化,使紫色KMnO 4溶液褪色。
(2)加成反应①概念:有机物分子中不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
②乙烯的加成反应a .乙烯使溴的四氯化碳溶液(或溴水)褪色,反应的化学方程式为:CH 2=== CH 2+Br 2―→CH 2Br —CH 2Br 。
b .乙烯与H 2O 的加成,反应的化学方程式为:CH 2=== CH 2+H 2O ――→催化剂加热、加压CH 3CH 2OH 。
c .乙烯与H 2的加成,反应的化学方程式为:CH 2===CH 2+H 2――→催化剂△CH 3CH 3。
d .乙烯与HCl 的加成,反应的化学方程式为:CH 2===CH 2+HCl ―→CH 3CH 2Cl 。
(3)加聚反应乙烯能发生自身的加聚反应生成高分子化合物聚乙烯(CH 2—CH 2),化学方程式为:n CH 2===CH 2――→催化剂CH 2—CH 2。
乙烷、乙烯的分子式、电子式、结构式和结构简式C 2 H 6共26页文档

B
希望在你手中 阳光总在风雨后 请相信有彩虹
谢谢!
CH2=CH2 -2H
C2H2
一、乙炔的分子组成和结构
分子式: C2H2 电子式:H∶C C∶H 结构式:H—C C—H 结构简式:HC CH 乙炔的空间结构是什么样的?
讨论:乙炔的空间结构是直线型,表征它结构
特征的碳碳叁键有什么特点呢?
乙炔、乙烯、乙烷键参数比较
乙烷 乙烯
乙炔
C—C
键长(10-10m): 1.54
三、乙炔的性质和用途
纯的乙炔是没有颜色、没有臭
物
理
味的气体。密度是1.16克/升,
性
比空气稍轻。微溶于水,易溶
质
于有机溶剂。
化
学
1. 氧化反应
性
(1) 在空气或在氧气中燃烧—完全
质 氧化 2C2H2 + 5O2 点燃 4CO2 + 2H2O
乙炔跟空气的混合物遇火会发生爆 炸,在生产和使用乙炔时,必须注 意安全。
书写下列方程式
催化剂
CHCH + H2
CH2=CH2
催化剂
CH2=CH2 + H2
CH3CH3
CHCH + HCl 催化剂 CH2=CHCl
3.乙炔的用途
(1)乙炔是一种重要的基本有机原料,可以 用来制备氯乙烯、聚氯乙烯和乙醛等。
CHCH + HCl 催化剂 CH2=CHCl
催化剂
nCH2=CH 加温、加压 CH2CH n
结构式为
C Ca
C
CaC2 + 2H2OC2H2 + Ca(OH)2
反应过程分析:
C C
Ca
+
乙烷乙烯分子式电子式结构式与结构简式CH

化 学 1. 氧化反应
性
(1) 在空气或在氧气中燃烧 —完全氧化
质
C2H2 + O2 → CO2 + H2O
(2) 被氧化剂氧化 使酸性KMnO4溶液褪色
把乙炔通入盛有Br2的CCl4溶液或溴水 的试管中,观察到溶液的颜色消失。
请写出相应的化学反应方程式
+
溴乙烯
1, 1, 2, 2—四溴乙烷
四、炔烃:
1、结构特点:含C≡C键,不饱和链烃。
2、通式: CnH2n-2 (n>2)
3、物理性质上的相似性和递变性: 与烷烃、烯烃相似。
4、主要的化学性质: 氧化反应;加成反应。
5、命名和同分异构体的书写: 同烯烃
炔烃的化学性质决定于其结构 中的叁键:
三键的化 学性质:
1:易氧化。(高锰酸 钾褪色)
三、乙炔的性质和用途
纯的乙炔是没有颜色、没有臭
物
理
味的气体。密度是1.16克/升,
性
比空气稍轻。微溶于水,易溶
质
于有机溶剂。
化
学
1. 氧化反应
性
(1) 在空气或在氧气中燃烧—完全
质 氧化 2C2H2 + 5O2 点燃 4CO2 + 2H2O
乙炔跟空气的混合物遇火会发生爆 炸,在生产和使用乙炔时,必须注 意安全。
为什么不用启普发生器制取乙炔?
因为碳化钙与水反应剧烈,启普 发生器不易控制反应;
反应放出的热量较多,容易使启 普发生器炸裂。
反应的产物中还有糊状的Ca(OH)2, 它能夹带未反应的碳化钙进入发生器 底部,或堵住球型漏斗和底部容器间的 空隙,使发生器失去作用。
制取时应注意:
(1)用分液漏斗代替简易装置中的长颈漏斗控 制流量;
