氧化还原反应与四种基本反应类型的关系
高考化学专题复习之氧化还原反应知识点总结
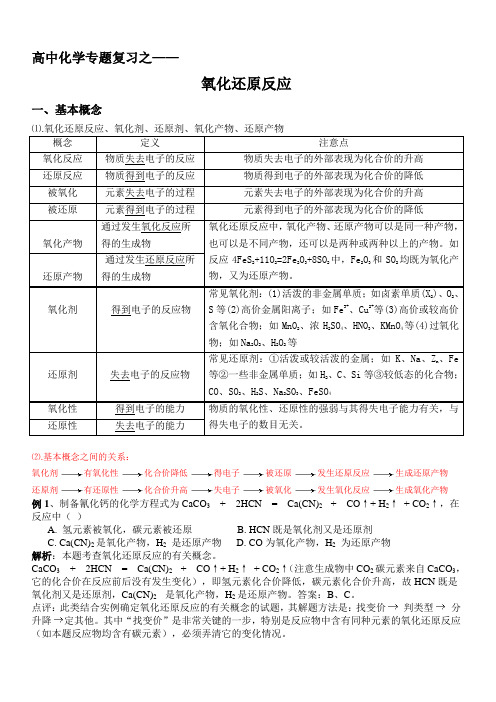
高中化学专题复习之——氧化还原反应一、基本概念⑴.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力⑵.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物例1、制备氰化钙的化学方程式为CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑,在反应中()A. 氢元素被氧化,碳元素被还原B. HCN既是氧化剂又是还原剂C. Ca(CN)2是氧化产物,H2是还原产物D. CO为氧化产物,H2为还原产物解析:本题考查氧化还原反应的有关概念。
CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑(注意生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。
氧化还原反应课件

在3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O反应中,若有 64gCu被氧化,则被还原的HNO3的质量 是( ) A.168g B.42g C.126g D.60g
总结
课后练习题:
1.请把符合要求的化学反应方程式的编号填入括号内: (1)既属于分解反应又是氧化还原反应的是( ) (2)属于化合反应,但不是氧化还原反应的是( ) (3)既属于化合反应,又是氧化还原反应的是( ) (4)属于分解反应,但不是氧化还原反应的是( ) (5)不属于四种基本反应类型的氧化还原反应的是( ) A. 2NaHCO3 = Na2CO3+ CO2 + CO2↑ B.2Na+ Cl2 = 2NaCl C.Zn+CuSO4=ZnSO4+Cu D. E.CaO+ CO2= CaCO3 F. 4FeS2+11O2 = 2Fe 2O3+8SO2
【4】分析下列氧化还原反应中化合价的变化关 系,注明电子转移方向和总数,并指出氧化剂 和还原剂,氧化产物与还原产物。 (1)2KMnO4=K2MnO4+MnO2+O2↑ (2)2Fe2O3+3C=4Fe+3CO2 (3)3NO2+H2O=2HNO3+NO (4)HgS+O2=Hg+SO2 (5)2H2S+SO2=3S+2H2O
五、氧化还原的基本规律及其作用:
1.守恒律:原子、电子转移、电荷守恒 还原剂失电子总数(或物质的量)= 氧化剂得电子总数(或物质的量) 作用:有关氧化还原反应的计算 配平氧化还原反应方程式
2.价态律:最高价、最低价、中间价 高价氧化低价还,中间价态两头转 元素处于最高价,只有氧化性;元素 处于最低价,只有还原性;元素处于中 间价,既氧化性又有还原性。 作用:判断物质的氧化性、还原性 金属单质只有还原性,非金属单质大 多数既有氧化性又有还原性
氧化还原反应的本质、特征与四大基本反应类型的关系

化学物质及其变化
专题五 考点
氧化还原反应
氧化还原反应的本质、特征与四大基本反 应类型的关系
1.氧化还原反应的本质:有电子转移(包括电子的得 失或偏移)。 2.氧化还原反应的特征:有元素化合价升降。
3.判断氧化还原反应的依据:凡是有元素化合价升 降或有电子转移的化学反应都属于氧化还原反应。 4.四大基本反应类型与氧化还原反应的关系。 置换反应全部属于氧化还原反应, 因为有单质参加和 另一种单质生成,化合价必然发生变化,故属于氧化还 原反应。
解析:反应时 Al 的化合价由 0 价变+3 价。Al 作还 原剂。 答案:A
2.(2015· 广州模拟)生产泡沫橡胶过程中,有如下反 应:2H2O2===2H2O+O2↑。该反应中 H2O2 是( A.既不是氧化剂,也不是还原剂 B.既是氧化剂又是还原剂 C.仅为氧化剂 D.仅为还原剂 )
解析:H2O2 中 O 的化合价既降低又升高,故 H2O2 既是氧化剂又是还原剂,故选 B。 答案:B
6.下列有关氧化还原反应的叙述中正确的是(
)
A. 有单质参加或有单质生成的反应一定是氧化还原 反应 B.氧化还原反应的本质是元素化合价的升降 C.失电子的反应物在反应中作氧化剂,反应中被还 原 D.金属单质在化学反应中一定作还原剂
解析: 有单质参加或有单质生成的反应不一定是氧化 还原反应,如同素异形体的相互转化,故 A 错;氧化还 原反应的本质是电子的转移,故 B 错;失电子的反应物 在反应中作还原剂,反应中被氧化,故 C 错;D 项正确。 答案:D
中,与氧化还原反应无关的是(
A.碳酸钠溶液中加入氯化钙溶液产生沉淀 B.铜粉在空气中加热变成黑色粉末 C.石灰石溶于盐酸并产生无色无味的气体 D.液氢在空气中变为氢气
新教材高中化学必修一难点:氧化还原反应

新教材高中化学必修一难点:氧化还原反应一、氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.氧化还原反应概念的发展二、氧化还原反应与四种基本反应类型1.四种基本类型的反应2.氧化还原反应与四种基本类型反应的关系①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2=2O3。
三、氧化还原反应的四对概念四、1.氧化剂与还原剂氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。
氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性氧化剂具有的得电子的性质称为氧化性;还原剂具有的失电子的性质称为还原性。
总之记住六字口诀:升失氧,降得还!解释:四、氧化还原反应电子转移表示方法双线桥法:(1)两条桥线从反应物指向生成物,且对准同种元素;(2)要标明“得”“失”电子,且数目要相等;(3)箭头不代表电子转移的方向。
单线桥法:(1)一条桥线表示不同元素原子得失电子的情况;(2)不需标明“得”“失”电子,只标明电子转移的数目;(3)箭头表示电子转移的方向;(4)单线桥箭头从还原剂指向氧化剂。
五、常见的氧化剂、还原剂常见的氧化剂(处于高价态的元素的单质或化合物):(1)活泼的非金属单质(F2、O2、Cl2、Br2、I2、O3等)(2)元素处于高价时的含氧酸(硝酸、浓硫酸)(3)元素处于高价时的盐:(KClO3、KMnO4、FeCl3)(4)过氧化物(H2O2、Na2O2)(5)其它(HClO)常见的还原剂(处于低价态的元素的单质或化合物):(1)活泼的金属单质:K、Na、Mg等;(2)非金属单质:H2、C、Si等;(3)低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
氧化还原及离子反应

氧化还原反应及离子反应一、四种基本反应类型:化合反应,分解反应,置换反应,复分解反应氧化还原反应和四种基本反应类型的关系二.氧化还原反应1.氧化还原反应:有电子转移的反应2. 氧化还原反应实质:电子发生转移判断依据:元素化合价发生变化氧化还原反应中概念及其相互关系如下:失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)1.氧化还原反应中电子转移的表示方法双线桥法表示电子转移的方向和数目注意:a.“e-”表示电子。
b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素,应标出“得”与“失”及得失电子的总数。
c.失去电子的反应物是还原剂,得到电子的反应物是氧化剂d.被氧化得到的产物是氧化产物,被还原得到的产物是还原产物2.氧化性、还原性强弱的判断(1)通过氧化还原反应比较:氧化剂+ 还原剂→ 氧化产物+还原产物氧化性:氧化剂> 氧化产物还原性:还原剂> 还原产物(2)从元素化合价考虑:最高价态——只有氧化性,如Fe3+、H2SO4、KMnO4等;中间价态——既具有氧化性又有还原性,如Fe2+、S、Cl2等;最低价态——只有还原性,如金属单质、Cl-、S2-等。
(3)根据其活泼性判断:①根据金属活泼性:对应单质的还原性逐渐减弱K Ca Na Mg AlZn FeSn Pb (H) Cu Hg Ag Pt Au对应的阳离子氧化性逐渐增强②根据非金属活泼性:对应单质的氧化性逐渐减弱Cl 2 Br 2 I 2 S对应的阴离子还原性逐渐增强(4) 根据反应条件进行判断:不同氧化剂氧化同一还原剂,所需反应条件越低,表明氧化剂的氧化剂越强;不同还原剂还原同一氧化剂,所需反应条件越低,表明还原剂的还原性越强。
如:2KMnO 4 + 16HCl (浓) = 2KCl + 2MnCl 2 + 5Cl 2↑ + 8H 2OMnO 2 + 4HCl(浓) =△= MnCl 2 + Cl 2↑ + 2H 2O前者常温下反应,后者微热条件下反应,故物质氧化性:KMnO 4 > MnO 2(5) 通过与同一物质反应的产物比较:如:2Fe + 3Cl 2 = 2FeCl 3 Fe + S = FeS 可得氧化性 Cl 2 > S3、氧化还原方程式的配平(a)配平依据:在氧化还原反应中,得失电子总数相等或化合价升降总数相等。
高考化学一轮复习第章化学物质及其变化第讲氧化还原反应课件新人教版

4.(2021·衡水模拟)现有下列三个反应:
①Cl2+FeI2===FeCl2+I2 ②2Fe2++Br2===2Fe3++2Br- ③Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O 下列说法正确的是( ) A.①②③中的氧化产物分别是 I2、Fe3+、CoCl2
√B.氧化性:Co2O3>Cl2>Fe3+
3.依据产物中元素价态的高低判断 (1)相同条件下,不同氧化剂作用于同一种还原剂时,氧化产物价态高的其 氧化性强。例如:
2.(2019·高考北京卷)下列除杂试剂选用正确且除杂过程不涉及氧化还原反
应的是( )
选项
物质(括号内为杂质)
除杂试剂
A
FeCl2 溶液(FeCl3)
Fe 粉
√B
NaCl 溶液(MgCl2)
C
Cl2(HCl)
NaOH 溶液、稀 HCl H2O、浓 H2SO4
D
NO(NO2)
H2O、无水 CaCl2
FeOn4-:Fe[+(8-n)]
Si3N4:Si(+4)、N(-3)
CuCl:Cu(+1)
Mg2B2O5·H2O:B(+3) MnO(OH):Mn(+3) VO+ 2 :V(+5) VO2+:V(+4)
S4O62-:S(+52) NaBH4:B(+3)、H(-1) Fe3O4:Fe(+2、+3) LiFePO4:Fe(+2)
C.根据反应①一定可以推理得到 Cl2+FeBr2===FeCl2+Br2 D.在反应③中,当有 1 mol Co2O3 参加反应时,有 1 mol HCl 被氧化
解析:三个反应中元素化合价升高所得的产物是 I2、Fe3+、Cl2,故 I2、 Fe3+、Cl2 是氧化产物,A 错误;氧化还原反应中,氧化剂的氧化性强于氧 化产物的氧化性,在反应①中,氧化性:Cl2>I2,在反应②中,氧化性: Br2>Fe3+,在反应③中,氧化性:Co2O3>Cl2,所以氧化性强弱顺序是 Co2O3 >Cl2>Br2>Fe3+,B 正确;根据氧化性强弱顺序:Cl2>Br2>Fe3+,Cl2 和 FeBr2 反应时,氯气优先氧化 Fe2+,再氧化 Br-,C 错误;在反应③中,当 有 1 mol Co2O3 参加反应时,生成 1 mol Cl2,有 6 mol HCl 参加反应,其中 2 mol HCl 被氧化,D 错误。
专题04 氧化还原反应的基本概念和规律(知识串讲+专题过关)-2022-2023学年高一化

专题04 氧化还原反应的基本概念和规律【知识梳理】【归纳总结】一.氧化还原反应的认识1.氧化还原反应的本质和特征2.氧化还原反应的基本概念【巧解巧记】升失氧、降得还,剂性一致,其他相反。
3.氧化还原反应与四种基本反应类型的关系二.氧化还原反应的表示方法1.双线桥法双线桥法是用两条线桥来表示氧化还原反应中化合价变化或电子转移方向和数目的方法。
方法如下:一条线箭头由氧化剂中得电子的原子指向还原产物中的同种元素的原子,并标明得到的电子数,另一条线箭头由还原剂中失电子的原子指向氧化产物中的同种元素的原子,并标明失去的电子数。
可概括为“标变价、画箭头、算数目、说变化”。
2.单线桥法单线桥法是用一条线桥来表示氧化还原反应中电子转移的方向和数目的方法。
方法如下:在反应物一侧,箭号起点为失电子原子,终点为得电子原子,在线上只标转移电子总数,不标“得到”“失去”。
三.氧化性、还原性强弱的比较方法1.依据氧化还原反应原理判断(1)氧化性强弱:氧化剂>氧化产物(2)还原性强弱:还原剂>还原产物2.依据元素活动性顺序判断(1)金属越活泼,其单质的还原性越强,对应阳离子的氧化性逐渐减弱。
(2)非金属越活泼,其单质氧化性越强,对应阴离子的还原性越弱。
F2、Cl2、Br2、I2、SF-、Cl-、Br-、I-、S2-由左至右,非金属单质的氧化性逐渐减弱;F-、Cl-、Br-、I-、S2-,由左至右,阴离子的还原性逐渐增强。
3.依据产物中元素价态的高低判断(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
例如:(2)相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
例如:4.依据影响因素判断(1)浓度:同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;还原性:浓HCl>稀HCl。
(2)温度:同一种物质,温度越高其氧化性越强。
氧化还原反应

4.常见的氧化剂和还原剂氧化剂:①活泼的非金属单质:如F2、Cl2、Br2、O2、O3②元素处于高化合价时的氧化物:如MnO2③元素处于高化合价时的含氧酸:如HNO3 、浓H2SO4、HClO4④元素处于高化合价时的盐:如KMnO4 、KClO3、FeCl3、⑤过氧化物:如Na2O2、H2O2还原剂:①活泼的金属:如Na、Al 、Zn、Fe②某些非金属单质:如H2 、C 、Si③元素处于低化合价时的氧化物:如CO、SO2④元素处于低化合价时的阴离子:如SO32-、S2-、I -、Br -、Cl-⑤元素处于低化合价时的阳离子:如Fe2+例2.判断下列各物质的变化中标有下划线的元素是被氧化,还是被还原?发生氧化反应,还是还原反应?反应物做氧化剂还是还原剂?(1)FeCl2FeCl3(2)H2SO4H2(3)HCl Cl2三、氧化还原反应的规律1.氧化性和还原性的强弱规律①根据金属活动顺序表判断失电子能力逐渐减弱,还原性逐渐减弱Na Mg Al Zn Fe (H) Cu Hg AgNa+ Mg 2+Al 3+Zn 2+ Fe 2+(H+) Cu 2+Hg 2+Ag +其阳离子得电子能力逐渐增强,氧化性逐渐增强得电子能力逐渐减弱,氧化性逐渐减弱F Cl Br I SF –Cl-Br - I - S2-其阴离子失电子能力逐渐增强,还原性逐渐增强②根据反应进行的方向判断:氧化剂的氧化性>氧化产物的氧化性;还原剂的还原性>还原产物的还原性③根据氧化还原程度的大小判断a.同一物质,被氧化的程度(化合价变化)越大,氧化剂的氧化性越强。
如:2Fe+3Cl2点燃2FeCl3 氧化性:Cl2 >S2222KClO3 + 6HCl(浓)= KCl + 3Cl2↑ + 3H2O2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O则以上三个反应中氧化剂的氧化能力由强到弱的顺序是:KMnO4>KClO3>MnO2例3.已知:①2FeCl3 + 2KI = 2FeCl2 + I2↓+2KCl ②2FeCl2 + Cl2 = 2FeCl3判断下列物质的氧化性由强到弱的顺序是()A. FeCl3>Cl2 >I2B. Cl2 >FeCl3 >I2C. I2 >Cl2 >FeCl3D. Cl2 >I2 >FeCl32.氧化还原反应的基本规律①价态律:A.元素处于最高价,只有氧化性(如:Fe 3+、KMnO4、H2SO4等)B.元素处于最低价,只有还原性(如:S2-、I - 等)金属元素无负价,所以金属单质只有还原性。
