海水的综合利用(原创)详解
海水资源的综合利用

②氧化:向浓缩的海水中通入适量的 Cl2 ,将Br -氧化为 Br2,反
应的离子方程式为Cl2+2Br-===Br2+2Cl-;
③富集:利用溴的挥发性,通入热空气和水蒸气,吹出的溴蒸气
用 SO2 吸收。反应的化学方程式为 Br2 + SO2 + 2H2O===2HBr +
H2SO4;
④提取:再用Cl2将HBr氧化得到产品溴。
③MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2 ④Mg(OH)2+2HCl===MgCl2+2H2O HCl ⑤MgCl2· 6H2O=====MgCl2+6H2O △ 电解 ⑥MgCl2(熔融)=====Mg+Cl2↑
(3)海水提溴
①浓缩:海水晒盐和海水淡化的过程中副产物Br-得到浓缩;
蒸馏法历史最久,技术、工艺比较完善,是目前海水淡化的主要
方法。蒸馏淡化过程的实质如同水蒸气的形成,使海水受热蒸发
形成水蒸气,水蒸气在一定条件下遇冷形成不带咸味的水,但蒸
馏法的弊端是消耗能量多并在仪器里产生大量的锅垢。
(2)冷冻法
冷冻法,即冷冻海水使之结冰,在液态水变成固态冰的同时盐被
分离出去。冷冻法与蒸馏法相比,耗能低、结垢轻,但得到的淡
特别提示
SO4-等杂 海水晒盐得到的是粗盐,含有Ca2+、Mg2+、
2
质,精制后得到 NaCl 饱和溶液,精制时通常在其中依次加入过
量的 BaCl2 溶液、过量的 NaOH 溶液和过量的 Na2CO3 溶液,过滤 后,再加适量盐酸调节至中性即可。
(2)海水提镁 反应流程:
有关反应的化学方程式: 高温 ①CaCO3=====CaO+CO2↑ ②CaO+H2O===Ca(OH)2
+ 2H2O 。 ________
海水资源的综合利用

1.海水中的化学资源是指海水中所含具有经济价 值的化学物质。海水的主要成分有Na+、Mg2+、 Ca2+、K+、Cl-、SO42-,这6种成分占海水成分的 99.5%以上。通常所说的海盐主要指钠盐、镁盐、 钾盐和钙盐,钠盐在海盐中产量最大,应用最广 泛,人们把氯化钠称为百味之王,化工之母,其 次还有硫酸钠、碳酸氢钠和碳酸钠;镁的含量仅 次于氯化钠,海水中的镁总量约2000×10t;
氯化钠的应用: 1.含氯化钠0.9%的水称为生理盐水,因为它与血浆 有相同的渗透压。 2.食品业和渔业用于盐腌,在烹调菜肴中加入食盐 可以除掉原料的一些异味,增加美味,这就是食 盐的提鲜作用。 3.氯碱工业:电解饱和食盐水。 4.候氏联合制碱法。 5.电解熔融氯化钠和氯化钙的混合物制取金属钠。 氯化钙用作助熔剂,可将氯化钠的熔点降低至 700℃以下。钙的还原性不及钠,不会引进杂质。
2.溴是海水中重要的非金属元素.地球上 99%的溴元素以Br-的形式存在于海水中, 所以人们也把溴称为“海洋元素”。 3.碘在自然界中含量稀少,在地壳的含量 位居第47位。除在海水中含量较高(海带、 贝类)以外,在大部分土壤、岩石、水 的含量都很低。
4.氯化钠主要来自海水,由海水(平均含2.4% 氯化钠)引入盐田,经日晒干燥 ,浓缩结晶, 制得粗品,然后精制。
4.离子交换法:用阴阳离子交换树脂除去海水中的 多余盐分的方法。 5.反渗透淡化法:该法在压力推动下使薄膜脱盐, 除用于海水脱盐外,还广泛用于苦咸水的淡化。 反渗透淡化发展迅速,其装机容量仅次于海水蒸 馏而居第二位。
二、海水中化学资源的提取
海水中蕴含着几乎所有的化学元素,总储量很大, 但是很多元素富集程度却很低。例如,金的储量 约为5×107吨,但是1吨海水中仅有4×10-6克。
从海水中提取重水2海水的综合利用1了解海水的综合利用

蒸馏法
电解法 重水的提取方法 化学交换法
吸附法
常用的、比较经济的化学交换法: 硫化氢—水双温交换法 H2O(l)+HDS(g) HDO(l)+ H2S(g)
课堂小结
1.了解海水中盐的开发和利用。 2.海水提溴和海水提镁得原 理和简单过程。 3.从海水中提取重水的方法和流程。
4. 知道食盐水电解工艺和主要设备- 石棉隔膜电解槽。能用简单的装置电解食 盐水并解释原理。
(2)海水资源还包括:能量、生物、矿物及 空间资源,等等。 ◆利用潮汐能量发电; ◆各种化学物质被综合利用(海水中平均含盐 3.5%,含多种 矿物质,如钠、钙、钾、溴、碘、 锶等) ; ◆海洋生物为人类提供丰富的食物和保健用品 (海洋中有大量的生物,是人类食物的来源之 一); ◆海水还是人类未来重要的淡水来源; ◆新的能源和人类的空间资源; ◆大海也是人类智慧的来源和情感的寄托之 一……
不是所有海岸都可以晒盐,作为盐 田必须具备的条件是: •有平坦宽阔的海滩,且潮汐落差大; •气候干燥、多风、少雨; •远离海岸入海口,避免海水被淡水冲稀。
日晒法从海水制盐
随着科学和技术的进步,还可以用 电渗析法、冷冻法制盐。此种方法,不仅 可以制盐,同时也可以得到淡水。
美国学者估计每日钠的需要量
6.能耗低
7.污染少
二、海水提溴 从海水中提出来的溴约占世界产 量的1/3.
吹出法是常用的海水提溴法。
吹出发:用氯气氧化海水中的Br-,使 其生成Br2,然后用空气或水蒸气吹出。
1.氯化
氯化即氯气置换溴离子,使其成 为单质。请写出氯化的离子方程式。 Cl2+2Br-=Br2+2Cl此反应在PH=3.5的酸性条件下效果最 佳。
海水的综合利用

不用水洗 酒精浸泡
取样处理
转化为无 机灰烬
灼烧
溶解
过滤
浸取I-
验证
实验过程
先氧化 后检验
海水是一座巨大的液体资源宝 库,合理环保的开发利用海水 资源是实现人类可持续发展的 重要方向。
一些对纯度要求较高的不活泼金属 也可以采用电解其盐溶液的方法来 进行冶炼,例如:
通电 2CuSO4+2H2O===2Cu+2H2SO4+O2↑
其它的石油加工 石油经过催化重整,可以使链状烃 转化为环状烃,获得苯、甲苯等重 要化工基本原料。
3.聚合反应和高分子材料 由低分子(相对分子质量小)生成 高分子(相对分子质量巨大)的反 应叫做聚合反应。
聚乙烯是由成千上万个乙烯分子在一定条件 下发生聚合反应生成的相对分子质量巨大的 高分子。相对分子质量巨大是高分子的基本 特征,也是它们与低分子化合物的根本区别。 高分子有天然的,如蛋白质、纤维素、淀粉 等,也有人工合成的,如聚乙烯等。三大人 工合成的高分子材料:塑料、合成橡胶和合 成纤维。
⑤用四氯化碳(或苯)萃取吸收塔 内的溶液中的溴单质。
(2)进行从海带中提取碘实验的反 应原理及应注意的问题
①反应原理:海带中的碘元素主要 以I-的形式存在,提取时用适当的氧 化剂将其氧化成I2,再萃取出来。
如用H2O2做氧化剂,反应的离子 方程式是: 2I-+H2O2+2H+=I2+2H2O
海带不要用水洗,以免洗去海带中 的碘;用干海带从而易于燃烧;灼 烧海带的地方要注意通风。
化学资源 海水资源 生物资源
能源 ……….
海水资源的分布特点:
1、海水资源的广阔性 2、海水资源的多样性 3、海水资源的分散性
海水的综合利用

四.海水提镁
五.海水中提取重水(D2O) 重水熔点为 3.8℃ 沸点是101.4℃ 比重是1.1,比普通水重10%, 盐类在重水中的溶解度很小,溶液 的导电性也非常低 具有吸水的本领 对生物体有麻痹作用
Br2易挥发,用空气或水蒸汽把其 吹出来
3.吸收 通入SO2把Br2还原#43;Br2+2H2O=2HBr+H2SO4 作用:重要的制药原料,如红药 水,镇静,催眠的三溴片, 消炎镇痛针剂,激素等药 物中都含有溴。
溴还可以制造熏蒸剂、杀虫剂、 抗爆剂。在汽车的汽油中加入二 溴乙烯,可以降低油耗30%。溴 还是精炼石油,制造染料不可缺 少的原料。
一. 海洋资源
海洋化学资源
海洋生物资源 海底矿物资源
海洋能源
二.海水中盐的开发和利用 1.海水制盐
2.食盐资源的利用 原理:电解饱和
食盐水 2NaCl+2H2O =2NaOH+H2↑+Cl2 ↑
氯 碱 工 业 产 品
三.海水提溴
1.氯化 把海水酸化后(pH=3.5)用氯 气把Br-氧化成Br2 2.吹出
海水的综合利用PPT课件
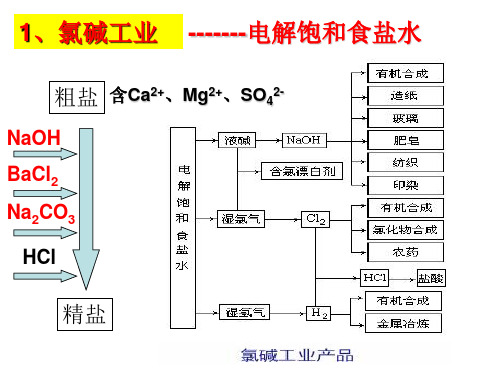
粗盐 含Ca2+、Mg2+、SO42-
NaOH BaCl2 Na2CO3
HCl
精盐
2、Mg的提取
海水的综合利用可以制备金属镁,其流程如下 所示:
海 蒸发 水
粗盐
母液 (苦卤)
精盐
Mg(OH)2
盐酸 浓缩
MgCl2.6H2O
ห้องสมุดไป่ตู้
脱水
贝 煅烧 壳
CaO
水 石灰乳
电解
4、I2的提取
海带中提取碘单质
干海带 1 灼烧 坩埚
6
I2
蒸馏
2 水浸 灰烬 3 过滤
有机层
5 萃取
滤液 4 Cl2 溶液I
习题: 1、在已经提取氯化钠、溴、镁等化学物质的富 碘卤水中,采用以下工艺流程生产单质碘。
4 稀硫酸浸洗
Ag 丙
5 加HNO3
丁
I-
1 2
加AgNO3甲
过滤水
3加
适量Fe
Ag
Mg
MgCl2
(1)若在空气中加热MgCl2.6H2O,生成的 是Mg(OH)Cl或MgO,写出有关反应的化 学方程式_____加_热______.
MgCl2+6H2O===Mg(OH)Cl+HCl↑+5H2O
(2)用电解法制取金属镁时,需要无水氯化 镁.在干燥的HCl气流中加热MgCl2.6H2O, 能得到无水MgCl2其原因是_________.
(4)实验室检验I2的方法是?
将I2加入淀粉溶液中,溶液显蓝色.
(5)甲物质见光易变黑,其原因是___________ ____________(用化学反应方程式表示)
海水资源的综合利用

2.从海水中提取物质的方法 ⑴.从海水中提取食盐的主要工艺流程
从海水中 制取盐的方法 主要有:盐田 法、电渗析法 和冷冻法。
思考:
盐田法 制得的粗盐中含较多的氯化 镁和氯化钙及泥沙,请设计实验除 2+、Mg2+离 去NaCl中混有的泥沙、Ca 子的方法(需要仪器及实验步骤)
能源:海水运动中蕴藏着巨大的能量,包括潮汐
能资源、波浪能资源、海流能资源、温差和盐差 能资源、海上水能资源,它们都属于可再生能源, 而且没有污染。 空间资源:海洋可利用空间包括海上、海中、海底 三个部分。海洋空间利用已从传统的交通运输扩大 到生产、通信、电力输送、储藏、文化娱乐等诸多 领域。我国拥有18000公里的大陆海岸线,管辖的 海域面积近300万平方公里。
先将样品溶解,加稍过量的氢氧化 钙,再加入稍过量的碳酸钠溶液,过滤; 在滤液中加入稍过量的盐酸,蒸发结晶 即可。
(2).从海带中提取碘的实验 ①反应原理
海带中的碘元素主要以I-的形式存在,提取时 用适当的氧化剂将其氧化成I2,再萃取出来。 用H2O2做氧化剂,反应的离子方程式是:
__________________________________ ②提取流程 含碘元素试剂 含 碘 单 质 的溶液 的溶液 灼烧 海 溶解 海 带 过滤 带 残 灰 含碘单质的 渣 有机溶液
第一节
开发利用金属矿物和海水资源
二、海水资源的开发利用
一、海水中蕴藏的资源及其开发意义
海洋水资源:海水中水的储量约为1.3×109亿吨, 约占全球总水量的97%。 化学资源:含元素80多种,海洋资源中,利用潜力最大 的是海水中的化学资源。目前,在陆地上发现的100 多种化学元素,在海水中已找到80多种,其中70多 种可供提取。如,氯化钠(即食盐)有4亿亿吨,镁约 有1800万亿吨,钾有500万亿吨,溴约有90万 亿吨,核燃料约40亿吨-50亿吨。
海水的综合利用归纳

海水的综合利用归纳南靖一中沈建忠2010、09、15海水中平均含盐3.5%,含多种矿物质,如钠、钙、钾、溴、碘、锶等。
海水资源包括:能量、生物、化学、矿物、及空间资源。
利用潮汐能量发电,各种化学物质被综合利用,海水还是人类未来重要的淡水来源、新的能源和人类的空间资源。
问题1:海水的综合利用有哪些方面?(1)海水的直接利用;(2)海水的淡化;(3)制盐和以盐为原料的盐化工;(4)提取海水中溶存的有用元素。
一、海水中水资源的利用——获取淡水1、途径:通过海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
2、海水淡化的方法及其特点:海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
原理:蒸溜法分离海水;优点:蒸馏法的历史最久,技术和工艺也比较完善;缺点:成本较高,难推广应用。
二、海水中的化学资源1、特点:种类多、总储量大、富集程度低含80多种元素,以氢、氧、氯、钠、镁、硫、钙、钾等较多。
被称为“元素的故乡”。
海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。
氘有50亿吨足够人类用上千万年2、从海水中提取物质的方法(1)从海水中提取食盐如何制盐?NaCl、海水晒盐A 、粗盐的成份及精制:a 、粗盐:含较多的氯化镁和氯化钙及泥沙b 、提纯实验步骤:溶解、过滤、结晶。
(请说说:过滤操作的要点;玻璃棒的使用;结晶操作要点;)c 、请设计实验室除去NaCl 中混有的Ca 2+、Mg 2+离子的方法(需要仪器及实验步骤):(答案:溶解,加稍过量的氢氧化钙,再加入稍过量的碳酸钠溶液,过滤;在滤液中加入稍过量的盐酸,蒸发结晶。
)B 、海水晒盐后的“卤水”中还有哪些盐含量较高?氯化镁 碘化钾 溴化钾 (2)海水提取镁试剂①溶液Mg(OH)2沉淀试剂②MgCl 2溶液Mg无水MgCl 2熔融电解(1)Ca(OH)2(2)过滤(3)盐酸(4)MgCl 2(熔融)电解Mg + Cl 2 ↑海水(含Mg 2+)过量(3)、海带中提取碘的实验 原理: I - —— I 2 检验I 2: 用淀粉溶液检验,看它是否变蓝。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
海水 日晒
食盐
熔融电解
水 饱和食盐水
NH3、CO2
H2O NaHCO3
电解
Na
Cl2 Cl2
K K.Na合金 (原子反应堆导热剂)
H2 NaOH (造纸、制肥皂等)
△
Na2CO3
Br2 (富集的方法)
食卤
△ MgO (耐火材料)
过滤 Mg(OH)2
高温
CaCO3
CaO
(贝壳)
MgCl2 (aq)
MgCl2(s) 熔
Mg (焰火,照明弹)
Cl2
海带中碘的存在形式:有机碘化物
干海带中含碘量: 0.3%--0.5%,有的高达 1%,约比海水中的碘 浓度提高了10万倍!
3.海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。 实验室里从海带中提取碘的流程如下:
(1)灼烧海带的步骤中,除需要三角架外,还需要用到的硅酸盐质的实验仪器是
12
水,重结晶
精盐
冷过 却滤
电解槽 氯气
海 蒸发
水
母液
Mg(OH)2
盐酸 浓缩
MgCl26H2O 脱水 MgCl2 电解 Mg
贝壳
烧成 石灰
↑ 步骤Ⅲ
(3)在步骤Ⅲ中需保持盐酸过量,主要原因是
(结合离子方程式简要说明):
Mg2++2H2O Mg(OH)2+2H+ 抑制MgCl2水解 __________________________________
其中调节pH4-5的目的是__除_去_过__量的Na2CO3和NaOH
11
水,重结晶
精盐
冷过 却滤
海 蒸发 水
母液
贝壳
Mg(OH)2
盐酸 浓缩
MgCl26H2O 脱水
↑
烧成
步骤Ⅲ
石灰
MgCl2 电解 Mg
电解槽 氯气
(2)生产过程中,产生的Mg(OH) 2中常会混有 C__a_(O__H加_)_2入_,_M_如_g_C何_l2除_,_去_充__分_反__应__,__过__滤_______
+-
离子交换法
阳离子交换树脂:HR+Na+=NaR+H+ 阴离子交换树脂:ROH+Cl-=RCl+OH-
H++OH-=H2O
与化工生产相结合,提高经济效益:
海水的综合利用 海水淡化
粗盐的
电解食盐
的方法
精制
8
积极开展海水化学物质的提取利用
海水化学资源综合利用,是形成产业链、实 现资源综合利用和社会可持续发展的体现。 海水化学资源综合利用技术,是从海水中提 取各种化学元素(化学品)及其深加工技 术 。主要包括海水制盐、苦卤化工,提取 钾、镁、溴、硝、锂、铀及其深加工等,现 在已逐步 向海洋精细化工方向发展。
CaCO3
CaO
(贝壳)
MgCl2 (aq)
MgCl2(s) 熔
Mg (焰火,照明弹)
Cl2
水,重结晶
精盐
冷过 却滤
电解槽 氯气
海 蒸发 水
母液
贝壳
Mg(OH)2
盐酸 浓缩
MgCl26H2O 脱水
↑
烧成
步骤Ⅲ
石灰
MgCl2 电解 Mg
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42- 等杂质离子,欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42- 离子,请从N提aO供H的B试aC剂l2 中Na选2C出O3a所代表的试剂,按滴加顺序 依次是____B_a_C_l_2 __N_a_O_H___Na2CO3 (提供的试剂Ba:Cl饱2 和NaN2CaO2C3 ON3a溶OH液 饱和K2CO3溶液 NaOH 溶液 BaCl2溶液 Ba(NO3)2溶液)
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原 为Br—,其目的为 富集溴元素 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95
%,有关反应的离子方程式为
,
Br2+SO2+2H2O=4H++SO42-+2Br-
由此反应可知,除环境保护外,在工业生产中应解 决的主要问题是 强酸对设备。的严重腐蚀
海水资源的开发利用 海水资源的开发利用
海水资源的开发利用
海水中资源的分类:
海水资源
水资源 化学资源 生物资源
能源 ……….
海水资源的分布特点:
1、海水资源的广阔性 2、海水资源的多样性
3、海水资源的分散性
总之,海洋是一个远未完全开发的 巨大化学资源宝库!!!
海水的淡化:
其他淡化技术:
电渗析法
③实验装置气密性良好,要达到提纯溴的目的,操 作中如何控制关键条件:控制温度计。b的温度,并收集59℃时的馏分
④C中液体产物颜色为 深红棕色,为除去该产物中仍 残留的少量Cl2,可向其中加入NaBr溶液,充分 反应后,再进行的分离操作是 分液(或蒸馏) 。
我国的海水化学元素提取主要是: TiCl4 Ti
___B__D___E__
(在空白处填写标号字母)
A、烧杯 B、瓷坩埚 C、表面皿 D、泥三角 E、酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①
,③
。
写出过程②中有关反应的离子方程式:
。
(3)提取碘的过程中,可供选择的有机试剂是_________(填字母标号)
14
例5:海水是巨大的资源宝库,在海水淡化及综合 利用方面,天津市位居全国前列。从海水中提取食 盐和溴的过程如下:
(1)请列举海水淡化的两种方法:
、。
蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种
(2)将NaCl溶液进行电解,在电解槽中可直接得 到的产品有H2、 Cl2 、 NaOH 或H2、 NaClO 。
13
水,重结晶
精盐
冷过 却滤
海 蒸发 水
母液
贝壳
Mg(OH)2
盐酸 浓缩
MgCl26H2O 脱水 MgCl2 电解 Mg
烧成
提镁
石灰
电解槽 氯气
(4)实验室用惰性电极电解100mL0.1mol/LNaCl 溶液,若阴极得到112 mL气体(标准状况),则 所得溶液的pH为___1_3______(忽略溶液的体积变 化)。
(5)某化学研究性学习小组为了解从工业溴 中提纯溴的方法,查阅了有关资料:Br2的 沸点为59℃,微溶于水,有毒性和强腐蚀性。 他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称: 冷凝管
。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶 管,其原因为 Br2腐蚀橡皮。
我国的海水化学元素提取主要是: TiCl4 Ti
海水 日晒
食盐
熔融电解
水 饱和食盐水
NH3、CO2
H2O NaHCO3
电解
Na
Cl2 Cl2
K K.Na合金 (原子反应堆导热剂)
H2 NaOH (造纸、制肥皂等)
△
Na2CO3
Br2 (富集的方法)
食卤
△ MgO (耐火材料)
过滤 Mg(OH)2
高温
