免疫层析标记物及其标记技术
pct免疫层析实验原理

pct免疫层析实验原理PCT(procalcitonin,降钙素原)是一种临床上常用的生物标记物,用于评估感染性疾病的情况。
PCT免疫层析实验是一种常用的检测PCT浓度的方法。
本文将详细介绍PCT免疫层析实验的原理。
PCT是一种由C-AMP基因编码的前降钙素原,是甲状腺C细胞分泌的激素。
在健康人体内,PCT的水平非常低,一般不超过0.1 ng/ml。
然而,在感染性疾病中,炎症反应可以刺激PCT的分泌,导致其浓度显著升高。
PCT的浓度与感染的严重程度有关,因此可以用于判断感染的程度及疾病的预后。
PCT浓度较低时可能是炎症反应的正常生理反应,但是当PCT浓度超过0.5 ng/ml时,通常表示存在严重感染。
此外,PCT浓度还可用于区分病毒感染和细菌感染,对于指导抗生素的使用也具有重要的临床意义。
PCT免疫层析实验是一种常用于检测PCT浓度的方法。
其原理是利用抗体与目标物(PCT)之间的特异性结合来实现检测。
一般来说,PCT免疫层析实验包括以下几个步骤:1.样品处理:将待检测的样品加入试剂盒中,与试剂中的溶剂混合,使样品与试剂中的抗体充分接触。
2.抗体结合:待测样品中的PCT与试剂中的抗体发生特异性结合,形成一个PCT-抗体复合物。
3.免疫层析:将待测样品通过一张免疫层析膜,该膜上含有特定的抗体。
在免疫层析膜的一端,还存在一个检测线(T线),这是由于抗体-抗原结合后,PCT抗原与免疫层析膜上的抗体结合,并迁移到检测线上。
4.定量分析:等待一定时间后,读取结果。
如果在T线上出现了一个明显的颜色线条,则说明样品中存在PCT,并且颜色的强弱可以提示PCT的浓度水平。
PCT免疫层析实验原理的关键在于抗体的特异性。
抗体是由免疫动物(如小鼠)经免疫刺激后产生的。
免疫动物的体内会参与抗原与抗体的结合,从而免疫动物就可以识别出这个抗原。
当该抗体与其专一性的抗原重结合后,就会产生浑浊效应。
通过测定浑浊度的高低,可间接确定抗原的浓度。
时间分辨荧光免疫层析 技术原理

时间分辨荧光免疫层析技术原理
时间分辨荧光免疫层析技术(TRFIA)是一种非同位素免疫分析技术,利用
镧系元素标记抗原或抗体,通过时间分辨技术测量荧光。
具体来说,当含有待测抗原(抗体)的样品滴在加样区时,待测样品中的抗原(抗体)与结合垫中的荧光纳米微球标记的抗体(抗原)结合并通过毛细作用向前层析。
当达到检测区后,与检测线上固定的抗体(抗原)结合,形成微粒-抗体-抗原-抗体夹心复合物并被固定在检测线上,而多余的荧光微
球标记物继续向前层析,与固定在质控线上的二抗结合。
反应结束后,用紫外光源(340nm)对检测区扫描检测,检测线和质控线
上荧光纳米微球发出高强度的荧光(615nm),且衰变时间也较长。
通过
测量延缓时间,待样品基质中自然发生的短寿命荧光(1-10ns)全部衰变后,再测量稀土元素的特异性荧光,这样就可以排除非特异本底荧光的干扰。
通过检测线和质控线荧光强度的强弱及其比值,即可分析出样品中待测物的浓度。
这种技术具有高灵敏度、高特异性和可定量分析等特点。
以上内容仅供参考,如需更多信息,建议查阅时间分辨荧光免疫层析相关文献或咨询该领域专家。
纳米颗粒在免疫层析技术中的应用

纳米颗粒在免疫层析技术中的应用纳米颗粒又称为超微颗粒,是指颗粒大小为1-100nm的粒子。
纳米颗粒具有大的比表面积,从而导致其光、热、磁敏感特性和表面稳定性不同于正常的粒子,因而在生物和医疗领域有广阔的应用前景。
目前已经用于免疫层析标志物的纳米材料包括胶体金、镧系元素、量子点、荧光乳胶、荧光微球、磁珠等几类。
免疫层析技术是通过标记物来得到结果分析信号的,因此,一种灵敏度高、稳定性好的标记物,可以大幅度提高其检测性能。
目前应用和研究的热点主要是胶体金免疫层析技术、荧光免疫层析技术、磁珠免疫层析技术等。
1胶体金免疫层析技术胶体金免疫标记技术是以胶体金作为示踪标志物应用于抗原抗体反应的一种免疫标记技术。
胶体金,又称为胶体纳米金,金纳米颗粒在水溶液中呈胶体状,因此称为胶体金。
胶体金颗粒具有纳米材料所特有的三大效应:表面效应、小尺寸效应和宏观量子隧道效应,具有很大的比表面积,独特的光学、导电、导热等物理特性以及良好的生物相容性,对蛋白质有较强的吸附能力,可以与免疫球蛋白、毒素、酶、糖蛋白、抗生素、激素、牛血清白蛋白、多肽化合物等非共价结合,同时,胶体金具有高电子密度特性,即金标物在相应配体处大量聚集,肉眼可见红色或粉色斑点,因而,目前多用于定性或半定量的快速免疫检测方法。
优点:简单、快速、准确、无污染、检测不依赖昂贵的激光检测仪器,只需普通光学仪器,甚至肉眼即可辨别。
目前,市场上已经有检测各种成分(如各种病原体、标志物等)的胶体金免疫层析试纸条试剂盒。
缺点:这灵敏度不高,主要用于定性或半定量,对一些肿瘤标志物、神经性肽、心血管疾病标志物的检测,其灵敏度是远远不够。
2荧光免疫层析技术荧光纳米材料由于其独特的结构和光、电、磁性质,使其在标记检测方面有着极大的应用价值。
荧光免疫层析技术结合了荧光免疫技术和层析技术的优点,是当前研究的热点2.1 量子点层析技术量子点(QuantumDots,QDs)又称无机纳米半导体晶体,是主要由ⅡB族~ⅥA族(如CdSe,CdTe,CdS,ZnSe等)或ⅢA族~ⅤA族(InP,InAs等)元素构成的能够产生荧光的半导体纳米颗粒。
免疫层析标记物及其标记技术

原胶乳
免疫胶乳
荧光胶乳
荧光胶乳颗粒粒度均一、单分散性好,有较好的生物相容性;形成 微球后染料荧光猝灭大大减少,发射强而稳定。
荧光乳胶层析法比一般的胶体金等固相免疫灵敏10~100倍,可以 有效排除背景色的干扰,且能够对待测物进行定量测定。
荧光胶乳颗粒的缺点是荧光染料系物理掺杂,容易发生泄漏,同时 高分子胶乳颗粒的表面修饰不够灵活,且由于多数具有输水性质, 而易发生非特异性吸附。
QDs激发谱宽而发射谱窄,并且具有较大的Stokes位移,都在很大 程度上提高检测的准确性;
QDs荧光寿命长,即不易衰变,稳定性高,可重复检测。 QDs在制备、修饰及抗原抗体标记等环节受到技术要求制约,结合
物稳定性也有待提高,并且检测时需紫外光作为激发光,仪器设备 要求和成本都较高。
免疫磁珠
上转磷光颗粒
上转磷光材料( up-convertingphosphor,UCP) 是新近发展起来的 由 2 种稀土金属元素(分别作为光吸收子和发射子)掺杂于氧化硫 等惰性材料中构成的一类能上转发光产生磷光的纳米级示踪材料。
上转磷光颗粒
天然生物材料不具备上转发光的特性,其发光信号不受检测环境的影 响,故样品本底低而灵敏度高,非常适合定量检测。
免疫磁珠(immunomagnetic beads,IMB) 是包被有单克隆抗体的 磁性微球,可与含有相应抗原的靶物质特异性结合形成复合物,是 近年来发展起来的一项新的免疫学技术。磁性免疫层析技术利用超 顺磁性纳米微粒作为标记物,由高灵敏度磁性检测仪测量包被了免 疫复合物的磁性微粒所产生的局部磁场效应,而得出待测分析物的 um dots, QDs)又称荧光半导体纳米颗粒,用于生物 探针的量子点主要由第二副族和第六主族的元素组成,如硒化镉( CdSe)、硫化锌(ZnS)、碲化镉(CdTe)、硫化镉(CdS)等。 粒径多介于1~10 nm,极小的粒径,外观似点状,故得名为量子点。
免疫层析各种方法法原理
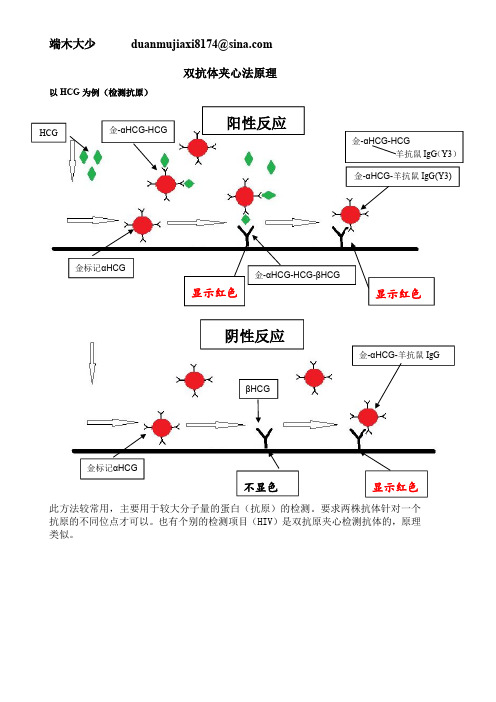
双抗体夹心法原理以HCG 为例(检测抗原)此方法较常用,主要用于较大分子量的蛋白(抗原)的检测。
要求两株抗体针对一个抗原的不同位点才可以。
也有个别的检测项目(HIV)是双抗原夹心检测抗体的,原理类似。
HCG 金标记αHCG 金-αHCG-HCG 金-αHCG-HCG -βHCG金-αHCG -羊抗鼠IgG(Y3)金-αHCG-HCG羊抗鼠IgG (Y3)显示红色显示红色金标记αHCG不显色显示红色金-αHCG -羊抗鼠IgG阴性反应阳性反应βHCG以吗啡为例(检测抗原)此方法主要用于小分子抗原(毒品、农药、肽链等)的检测。
由于抗原分子量小不能直接固定于NC 膜上,常常用化学方法把小分子偶联到BSA 等大分子物质上再固定于NC 膜上。
此结果与双抗原夹心法相反,阴性CT 两条都是红线,阳性只有C 线一条红线,T 线不显色。
金-吗啡抗体-吗啡吗啡-BSA 金标记吗啡抗体显示红色不显色金-吗啡抗体-吗啡羊抗鼠尿液(含吗啡)显示红色显示红色金标记吗啡抗体金-吗啡抗体-羊抗鼠阴性尿液抗体-吗阴性反应阳性反应金标记吗啡抗体-吗啡-BSA乙肝E 抗体为例金标记e 抗体e 抗原e 抗体金标记e 抗体-e 抗原-e 抗体金标记e 抗体-e 抗原-e 抗体-羊抗鼠不显色显示红色金标记e 抗体e 抗原金标记e 抗体-e 抗原金标记e 抗体-e 抗原-e 抗体显示红色显示红色金标记e 抗体-e 抗原羊抗鼠阳性反应阴性反应间接法原理检测抗体此方法主要用于血清中抗体检测,纯化或者重组的抗原固定于NC 膜上,标记多为蛋白A(ProteinA 或叫SPA,与抗体Fc 端结合而与其它蛋白质不结合)或者鼠抗人(如检测为IgM,则标记为鼠抗人IgM)。
此方法要求胶体金过量(待测样品往往含有大量多种抗体,所检测抗体所占份额很小),一般来说样品再加入前需要稀释或者加极少量后再加样品缓冲液。
一般斑点免疫渗滤法使用也是间接法。
显示红色显示红色金标记SPA 目的抗体杂抗体阳性反应抗原杂抗体金标记SPA 抗原不显色显示红色阴性反应。
时间分辨荧光免疫层析技术简介

• 测向流层析 • 垂直流层析(渗滤法)
免疫层析技术原理
侧向流层析
• 固定相:固定有检测线和控制线的纤维层析材料(NC膜) • 流动相:测试液 • 移动:毛细作用 • 结合:游离态待测物在固相捕获线处发生特异性免疫反应
图1 典型侧向流免疫层析试纸条构造(来源:Merck Estapor)
时间分辨荧光免疫层析技术简介
主要内容
1
免疫层析技术原理
2
免工疫作问标题记机材解决料方介案绍
3
时间分辨荧光分析法
4
应用实例
免疫层析技术原理
免疫层析技术是建立在层析技术和抗原-抗体特异性免疫反应基础上的一 项新兴免疫检测技术。
发展阶段:
• 初期:定性检测 • 新阶段:半定量、定量检测(信号放大、信号转换)
• 荧光寿命(Fluorescence lifetime):荧光物质被激发后所产生的荧光衰减到一定程度所用的 时间。
• 荧光猝灭(Fluorescence quenching):荧光物质在某些理化因素(如紫外线照射、高温、 某些硝基化合物、重氮化合物、重金属、卤素阴离子等)的作用下,激发态分子的电子不能 回复到基态,所吸收的能量无法以荧光的形式发射,从而导致荧光减弱甚至消退的现象。引 起荧光猝灭的物质称为猝灭剂,常用于消除不需要的荧光。
表1 几种常见的荧光物质
荧光物质
最大吸收光谱
异硫氰酸荧光素 (FITC)
490~495nm
四乙基罗丹明 (RB200) 四甲基异硫氰酸罗丹明 (TRITC) 藻红蛋白(PE) 7-氨基-4-甲基香豆素
570~575nm 550nm 490-560nm 354nm
Alexa Fluor、CF Dye等新一代荧光染料系列 多种区段供选
第5章 常见免疫学检测技术-胶体金免疫层析

夹心法反应演示
阳性
阴性
(三)胶体金免疫测定技术
§ (2)胶体金免疫层析
©②间接法检测抗体
间接法反应演示
阳性
阴性
(三)胶体金免疫测定技术
§ (2)胶体金免疫层析
©③间接竞争法
竞争抑制法反应演示
阴性
弱阳性
阳性
检测线颜色强度与样品浓度负相关
竞争法结果判断
(三)胶体金免疫测定技术
ª 2.胶体金免疫层析试纸条制作 § (1)试剂、耗材准备 § (2)金标抗体的制备 § (3)试纸条的组装 § (4)试纸条的优化 § (5)样品检测及分析
ª 2.胶体金(免三疫)层胶析体试金纸免条疫制作测定技术
§ (1)试剂、耗材准备
• 硝酸纤维素膜的参数:孔径、对称性、层析速度、表面 活性剂、蛋白结合力、强度、表面质量、厚度、批间均 一性等
• um 指的是膜孔径,但膜在生产过程中,由于干燥成型 等过程的非绝对均一,膜的孔径也是非均一的,不同厂 家膜孔径标准无法统一衡量
(三)胶体金免疫测定技术
ª 1.主要形式(基本原理) § 斑点金免疫渗滤/dot immunogold filtration
assay, DIGFA § 胶体金免疫层析/immunochromatography assay,
ICA--试纸条
(三)胶体金免疫测定技术
§ (1)斑点金免疫渗滤
原 • 以硝酸纤维素膜作为固相载体、包被抗 理 原或抗体
(二)胶体金的制备
® 一般采用还原法,常用的还原剂有柠檬酸钠、鞣 酸、抗坏血酸、白磷、硼氢化钠等
ª 以柠檬酸三钠还原法为例 § 取0.01% HAuCl4 溶液100 mL 搅拌、加热、回
流,沸腾2 min, 迅速一次加入一定量的 1% 柠 檬酸三钠水溶液(现配),保持低沸,经由蓝、 灰、至呈现透明的橙红色停止加热。回流冷却至 室温(应为原体积,否则应用蒸馏水恢复体积) § 加入柠檬酸钠的量不同,胶体金颗粒大小不同
荧光微球免疫层析原理 trfia

荧光微球免疫层析原理 trfia荧光微球免疫层析法(TRFIA)是一种高灵敏度、高特异性、容易操作和自动化程度高的免疫分析技术。
TRFIA采用荧光微球作为标记物,通过对微球上特异性抗体和样品中特定抗原的结合进行荧光检测,从而实现对该抗原的检测和定量。
TRFIA的原理与传统的免疫层析法基本相同,但是它采用荧光检测方式,比传统的免疫层析法具有更高的灵敏度和特异性。
荧光微球免疫层析法主要分为荧光微球的制备和修饰、试剂的配制以及荧光微球免疫层析的操作等几个部分。
荧光微球的制备和修饰荧光微球通常由聚合物微球和荧光分子组成。
聚合物微球可以通过乳化聚合、溶剂挥发法、乾燥共沉淀法、凝胶聚合、微波聚合等方法制备。
荧光分子则是一种具有荧光特性的化合物,可以将荧光分子与聚合物微球表面的官能团进行共价修饰得到。
通常荧光微球的表面会修饰一定量的活性官能团,如羧酸、氨基、疏水基团等,以便于进行进一步的修饰。
比如,荧光微球表面修饰具有特异性的抗体、酶、核酸等生物大分子,从而用于特异性的检测和定量抗原、抗体等生物分子。
试剂的配制TRFIA试剂包括荧光微球悬液、标准品、稀释液和样品等。
其中荧光微球悬液需要根据不同的试剂盒和具体实验要求来进行配制。
标准品根据需要,可以选择进口标准品、自制标准品等,以确保标准品具有较高的纯度和稳定性。
稀释液通常是一种可以增加检测敏感性的缓冲液,如PBS、BSA溶液等。
样品包括体液、组织、细胞等等。
与传统免疫层析法相似的是,TRFIA试剂的配制需要严格控制稀释倍数、样品加入量等因素,以确保实验结果的可靠性和准确性。
荧光微球免疫层析的操作荧光微球免疫层析的操作步骤较为简单,包括:添加标准品和样品、加入荧光微球悬液、荧光检测和数据处理等。
在实验操作的过程中,需要注意荧光微球悬液的均匀悬浮和标准品与样品的混匀等因素,以确保实验结果的精确性和稳定性。
1. 高灵敏度:荧光微球标记物的灵敏度较高,可以在低浓度的样品中进行检测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胶体金与蛋白质的结合
• 确定所用蛋白比例(一般15~20ug/mL胶体金),加入BSA,PEG等稳定剂。 免疫胶体金的纯化 • 超速离心,复溶液保存。
胶乳标记技术
采用羧基化(COOH)的荧光微球,微球大小在200~500nm(F4、
F1、F2)。
其标记的大致流程如下: • 将荧光微球进行清洗,并更换为标记所需缓冲液; • 加入EDC和Sulfo-NHS进行活化; • 加入待标记蛋白经行交联;
量子点
QDs的发射光谱可以通过改变QDs的尺寸大小来控制,用单一波长
的光即可激发产生多种不同颜色的荧光,被认为是最适合作为多标
记检测的标记物; QDs激发谱宽而发射谱窄,并且具有较大的Stokes位移,都在很大
程度上提高检测的准确性;
QDs荧光寿命长,即不易衰变,稳定性高,可重复检测。 QDs在制备、修饰及抗原抗体标记等环节受到技术要求制约,结合 物稳定性也有待提高,并且检测时需紫外光作为激发光,仪器设备 要求和成本都较高。
高分子胶乳颗粒的表面修饰不够灵活,且由于多数具有输水性质,
而易发生非特异性吸附。
上转磷光颗粒
上转磷光材料( up-convertingphosphor,UCP) 是新近发展起来的
由 2 种稀土金属元素(分别作为光吸收子和发射子)掺杂于氧化硫 等惰性材料中构成的一类能上转发光产生磷光的纳米级示踪材料。
免疫磁珠
免疫磁珠(immunomagnetic beads,IMB) 是包被有单克隆抗体的 磁性微球,可与含有相应抗原的靶物质特异性结合形成复合物,是 近年来发展起来的一项新的免疫学技术。磁性免疫层析技术利用超
顺磁性纳米微粒作为标记物,由高灵敏度磁性检测仪测量包被了免
疫复合物的磁性微粒所产生的局部磁场效应,而得出待测分析物的 定量结果。
胶体金 胶体金是由氯金酸(HAuCl4)在还原剂如柠檬酸钠、白磷、抗 坏血酸、鞣酸等作用下,可聚合成一定大小的金颗粒,并由 于静电作用成为一种稳定的胶体状态,形成带负电的疏水胶 溶液,由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金
胶体金标记蛋白质的过程是蛋白被动吸附到金颗粒表面的过程。由 于蛋白分子牢固地结合在金颗粒表面,形成一个蛋白层,阻止了胶 体金颗粒的相互接触,而使胶体金处于稳定状态。 静电作用力 富含赖氨酸、精氨酸
答:羧基微球的活化所需时间很短,一般以10-20分钟为宜,长时间的活
化反而会降低偶联效率。
胶乳标记过程中常见问题
3、问:胶乳微球与抗体偶联后,当时没发现有凝集,但隔夜后发现有凝集
,这是什么原因?如何控制和避免?
答:偶联效率低,当体系中蛋白不足或是其它原因,使微球表面在交联后还 空出许多反应基团时,这些基团又可以与相连微球上的蛋白反应,所以有聚 集。可以加一些阻断剂BSA,另外,也可提高微球的交联率。但为什么是过 一段时间后才出现凝集呢,这是因为微球偶联上蛋白后,相互之间由于携带
非极性氨基酸(色氨酸、
作用力
疏水作用力
亮氨酸、缬氨酸、苯丙氨
酸)
配位键结合力
含硫氨基酸(半胱氨酸和 甲硫氨酸)
胶体金
胶体金免疫层析技术优点
几乎可标记所有的蛋白分子,过程简单,效率高,用量少,基本不改
变被标记蛋白的活性。
检测结果直接用颜色显示,肉眼判断容易,不需要特别仪器设备,操 作简便。
胶体金免疫层析技术不足
免疫层析标记物及其标记技术
定量技术部:张赛
1
2标记物
免疫层析标记技术 胶乳标记过程中常见问题
免疫层析技术概况
免疫层析技术概况
免疫层析测定法(Immunochromtogaphic Assay,简称ICA) 是出现于20世纪80年代初期,将免疫标记技术与层析技术结 合的一种新型检测技术。
荧光激发光波长范围较宽,发射光谱峰范围窄,是类线光谱,有利于 降低本底荧光强度,提高分辨率。 激发光和发射光之间有一个较大的Stokes位移,有利于排除非特异荧
光的干扰,增强测量的准确性。
标记离子螯合物产生的荧光强度高,寿命长,有利于消除样品及环境 中荧光物质对检测结果的影响。
量子点
量子点(quantum dots, QDs)又称荧光半导体纳米颗粒,用于生物 探针的量子点主要由第二副族和第六主族的元素组成,如硒化镉( CdSe)、硫化锌(ZnS)、碲化镉(CdTe)、硫化镉(CdS)等。 粒径多介于1~10 nm,极小的粒径,外观似点状,故得名为量子点。
原胶乳
免疫胶乳
荧光胶乳
荧光胶乳颗粒粒度均一、单分散性好,有较好的生物相容性;形成
微球后染料荧光猝灭大大减少,发射强而稳定。 荧光乳胶层析法比一般的胶体金等固相免疫灵敏10~100倍,可以 有效排除背景色的干扰,且能够对待测物进行定量测定。 荧光胶乳颗粒的缺点是荧光染料系物理掺杂,容易发生泄漏,同时
• 封闭未反应的微球活性表面;
• 采用适当的保存液保存。
胶乳标记技术
EDC/NHS活化反应原理
胶乳标记技术
荧光胶乳标记过程的优化
活化缓冲液种类、离子强度、pH MES、醋酸盐缓冲液、PBS、硼酸盐缓冲液等 EDC及Sulfo-NHS用量及活化时间 EDC -20℃保存,易潮解,称量快速,NHS 4℃保存,现用现配
上转磷光颗粒
天然生物材料不具备上转发光的特性,其发光信号不受检测环境的影 响,故样品本底低而灵敏度高,非常适合定量检测。 与易淬灭的荧光素标记物不同,UCP 不存在光学衰减且化学惰性强,
不受样品腐蚀或标记物自身衰变等影响,具有稳定的发光特性,可长
期存放和重复检测。
军事医学科学院微生物流行病研究所、北京热景生物技术公司,已 经在UPT技术平台上研制成功多项快速定量检测试剂并产业化。
时间分辨荧光纳米粒子
时间分辨荧光免疫分析法是用镧系元素标记抗原或抗体,根据镧系元 素铕(Eu3+)、铽(Te3+)及钐(Sm3+)、镝(De3+)等螯合物的发光特点,用时
间分辨技术测量荧光,同时检测波长和时间两个参数进行信号分辨,
可有效地排除非特异荧光的干扰,极大地提高了分析灵敏度。
时间分辨荧光纳米粒子
蛋白标记浓度及反应时间
封闭剂种类、浓度及封闭时间 乙醇胺、 BSA、酪蛋白、非离子型表面活性剂、“Irrelevant”IgG、明 胶 、PEG 标记保存液
胶乳标记过程中常见问题
胶乳标记过程中常见问题
1、问:如何选择胶乳微球的粒径?
答:一般选择粒径小的胶乳微球,则需要的抗体量就多,精密度和线性 相对较好,而选择粒径大的胶乳微球性,则所需抗体少,精密度和线性 相对较差,相对于小球,大球的灵敏度较好。 2、问:蛋白(抗体)与微球偶联前,是不是微球的活化时间越长,效率 越好?
同种电荷的关系,比较稳定,只有当偶尔相互碰撞,遇上彼此的反应基团时
才能结合。
胶乳标记过程中常见问题
4、问:由于抗体不只是FC的氨基酸上有NH2,是不是表示它可以在任何 方向与EDCA活化微球偶联呢?如果是这样,是不是会影响抗体与抗原的
特异性反应?
答:由于抗体的空间折叠方式和FC端疏水性强,因此偶联反应的绝大多数 发生在Fc端,对抗体与抗原的结合的影响不大。 5、问:在使用离心方法偶联乳胶微球,一般需要多大的(相对)离心力? 答:需要多大的离心力和离心时间跟所使用的乳胶微球粒径有关,13000 r/min 时F2需要15min,F1需要20 min,F4需要25min,粒径越小所需时间 越长,离心力越大。
待 测 物
层析方向
T
免疫反应
C
免疫层析技术基本原理示意图
免疫层析技术概况
胶体金免疫层析技术
荧光胶乳标记免疫层析
标记物稳定性差,结果靠肉眼观测,检测灵敏度低, 只能用于定性或半定量检测。 上转磷光标记免疫层析
新型免疫层析技术
时间分辨荧光免疫层析 量子点标记免疫层析 纳米磁珠标记免疫层析
免疫层析标记物
采用物理吸附的方法结合,抗原/抗体容易从金纳米颗粒表面脱落下
来,标记物不稳定。 只能给出定性或半定量的结果,由于仪器的限制,目前还未能准确的
定量。
荧光胶乳
荧光胶乳是指将荧光染料通过物理吸附法、自组装法、化学键合 法、共聚法、包埋法等方法吸附或包埋到粒子内而形成的直径在 纳米至微米级(0.01~10 μm)范围内,受激发光源激发能发出荧 光的固体微粒。
免疫磁珠
免疫层析标记技术
免疫层析标记技术
胶体金标记技术
蛋白质的预处理: • 蛋白质应先对低离子强度的水透析,去除盐类成份。盐类成份能影响胶体金 对蛋白质的吸附,并可使胶体金聚沉; • 用微孔滤膜或超速离心除去蛋白质溶液中的细小微粒。
蛋白与胶体金结合最佳pH确定
• 0.1mol/LK2CO3调pH,原则上可选择待标记蛋白质等电点,也可略偏碱。
