常用缓冲溶液的配制和PH计校正溶液配置方法
常用缓冲溶液的配制及PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)10.Tris–盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100三羟甲基氨基甲烷(Tris )HOCH2 CH2OH CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
PH计校准及缓冲液配置

标准缓冲溶液(均用pH标准缓冲物质配制)1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pH=4.003)。
苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下:a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。
保存于聚乙烯瓶中。
b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。
保存于聚乙烯瓶中。
1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pH=6.864):磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH 标准缓冲物质分别包装)两种。
配制方法如下:a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。
b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。
1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413):磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。
保存于聚乙烯瓶中。
1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。
(推荐)常用缓冲溶液的配制和PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
227.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量 = 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量 = 156.03,0.2 mol/L溶液为31.21克/升。
Na2HPO4·2H2O分子量 = 178.05,1/15M溶液为11.876克/升。
KH2PO4分子量 = 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M)X毫升0.2M K2PO4 + Y毫升0.2N NaOH加水稀释至29毫升9.巴比妥钠-盐酸缓冲液(18℃)巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升10.Tris–盐酸缓冲液(0.05M,25℃)50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100CHOCH2 NH2分子量=121.14;0.1M溶液为12.114克/升。
常用缓冲溶液的配制和PH计校正溶液配置方法之欧阳道创编
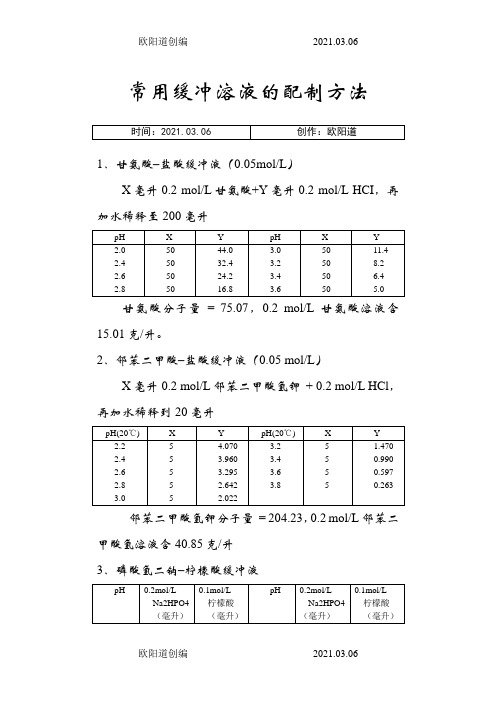
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾+ 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C6H8O7·H2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O :分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na2Ac·3H2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na2HPO4·12H2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na2HPO4·2H2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
PH计校准及缓冲液配置
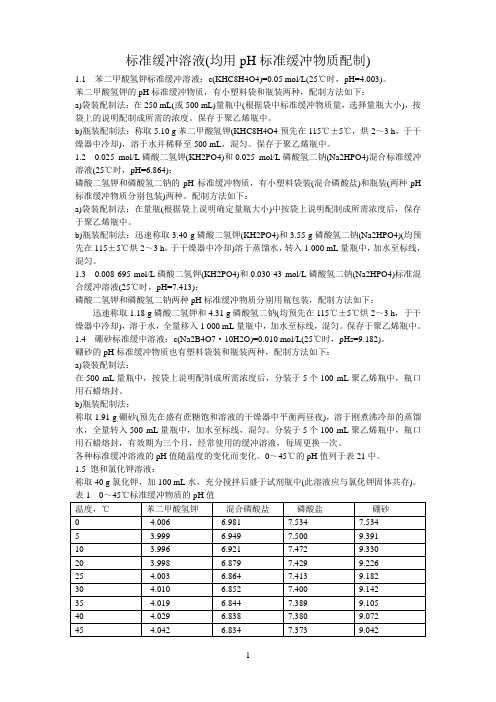
标准缓冲溶液(均用pH标准缓冲物质配制)1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pH=4.003)。
苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下:a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。
保存于聚乙烯瓶中。
b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。
保存于聚乙烯瓶中。
1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pH=6.864):磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH 标准缓冲物质分别包装)两种。
配制方法如下:a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。
b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。
1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413):磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。
保存于聚乙烯瓶中。
1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。
pH计校准方法和标准缓冲液配置

pH计校准方法和标准缓冲液配置本文分享pH计校准所需工具、标准缓冲液配置方法,以及pH计校准方法、步骤及开展pH计校准工作的注意事项。
掌握这些pH计校准技能,对仪表人用好酸度计实惠多多。
pH计的应定期检定校准,使精密度和准确度符合要求。
怎么校准,或者说是怎样校正酸度计。
以下是昌晖仪表制造有限公司整理出来的资料。
有直接用配置好的标准缓冲液校准,有的需要自己配置标准缓冲液再校准,下面就看看这两种不同的前提,相同的校准方法步骤,供需要的朋友参考。
pH计校准所需工具/原料标准缓冲液(应选择与供试液pH值接近的标准缓冲液),目前标准溶液有7种,在我国一般使用以下3种溶液:(pH值在25时)①邻苯二甲酸氢钾(KHC8H4O4)4.003pH;0.05M②混合磷酸盐(Na2HPO4):磷酸二氢钾和磷酸氢二钠混合盐溶液6.864 pH;0.025M③硼砂(Na2B4O7·10H2O)9.182 pH:0.01M这三种标准缓冲液的配置方法如下:①pH4,邻苯二甲酸氢钾标准缓冲液精密称取在115±5干燥2-3小时的邻苯二甲酸氢钾[KHC8H4O4]10.12g,加水使溶解并稀释至1000ml。
②pH7,磷酸盐标准缓冲液(pH7.4)精密称取在115±5干燥2-3小时的无水磷酸氢二钠4.303g与磷酸二氢钾1.179g,加水使溶解并稀释至1000ml。
另补充:磷酸盐标准缓冲液(pH6.8)精密称取在115±5干燥2-3小时的无水磷酸氢二钠3.533g与磷酸二氢钾3.387g,加水使溶解并稀释至1000ml。
③pH9,硼砂标准缓冲液精密称取硼砂[Na2B4O7·10H2O]3.80g(注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免与空气中二氧化碳接触。
pH计校准步骤/方法1、实验室使用的pH计校准方法①常用的实验室PH计仪器校正时,要把仪器的斜率调到最大,并拨开电极上部的橡胶塞,使小孔露出,否则在进行校正时,会产生负压,泞致溶液不能正常进行离子交换,会使测量数据不准确。
常用缓冲溶液的配制和PH计校正溶液配置方法之欧阳德创编
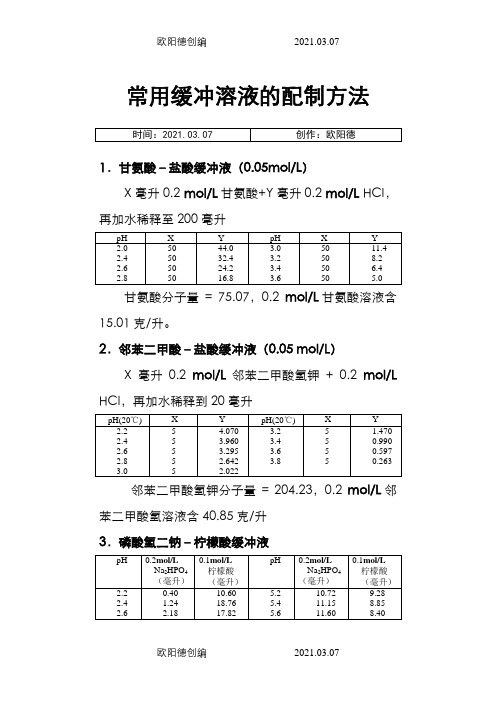
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2mol/L邻苯二甲酸氢钾+ 0.2mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)Na2Ac·3H2O分子量 = 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2mol/L 溶液为71.64克/升。
Na2HPO4·2H2O分子量 = 156.03,0.2 mol/L溶液为31.21克/升。
常用缓冲溶液的配制和PH计校正溶液配置方法之欧阳引擎创编

常用缓冲溶液的配制方法欧阳引擎(2021.01.01)1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾+ 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L 溶液为28.40克/升。
Na2HPO4·2H2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升。
C4H2O7·H2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C6H8O7·H2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na2Ac·3H2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用缓冲溶液得配制方法
1.甘氨酸–盐酸缓冲液(0、05mol/L)
X毫升0、2 mol/L甘氨酸+Y毫升0、2 mol/L HCI,再加水稀释至200毫升
2.邻苯二甲酸–盐酸缓冲液(0、05mol/L)
X毫升0、2mol/L邻苯二甲酸氢钾+ 0、2 mol/LHCl,再加水稀释到20毫升
邻苯二甲酸氢钾分子量= 204、23,0、2 mol/L邻苯二甲酸氢溶液含40、85克/升
24
Na2HPO4·2H2O分子量=178、05,0、2 mol/L溶液含35、01克/升。
C4H2O7·H2O分子量=210、14,0、1 mol/L溶液为21、01克/升。
①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠
溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0、1 mol/L)
柠檬酸C6H8O7·H2O:分子量210、14,0、1mol/L溶液为21、01克/升。
柠檬酸钠Na3C6H5O7·2H2O:分子量294、12,0、1 mol/L溶液为29、41克/毫升。
Na2Ac·3H2O分子量= 136、09,0、2mol/L溶液为27、22克/升。
7.磷酸盐缓冲液
242
Na2HPO4·12H2O分子量= 358、22,0、2mol/L溶液为71、64克/升。
Na2HPO4·2H2O分子量= 156、03,0、2mol/L溶液为31、21克/升。
Na2HPO4·2H2O分子量= 178、05,1/15M溶液为11、876克/升。
KH2PO4分子量=136、09,1/15M溶液为9、078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0、05M)
9.巴比妥钠-盐酸缓冲液(18℃)
10.Tris–盐酸缓冲液(0、05M,25℃)
50毫升0、1M三羟甲基氨基甲烷(Tris)溶液与X毫升0、1N盐酸混匀后,加水稀释至100
三羟甲基氨基甲烷(Tr is)H OCH2 CH2OH C
HOCH 2 NH 2
分子量=121、14;
0、 1M 溶液为12、114克/升。
T ris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
2472硼酸H2BO 3,分子量=61、84,0、2M 溶液为12、37克/升。
硼砂易失去结晶水,必须在带塞得瓶中保存。
硼砂Na 2B 4O 7·10H 2O,分子量=381、43;0、05M 溶液(=0、2M 硼酸根)含19、07克/升。
硼酸H 2BO 3,分子量=61、84, 0、2M 溶液为12、37克/升。
硼砂ﻩ易失去结晶水,必须在带塞得瓶中保存。
1
2.甘氨酸–氢氧化钠缓冲液(0、05M )
甘氨酸分子量=75、07;0、2M 溶液含15、01克/升。
13.硼砂-氢氧化钠缓冲液(0、05M硼酸根)
硼砂Na2B4O7·10H2O,分子量=381、43;0、05M溶液为19、07克/升。
14.碳酸钠-碳酸氢钠缓冲液(0、1M)
2+2+
Na2CO2·10H2O分子量=286、2;0、1M溶液为28、62克/升。
N2HCO3分子量=84、0;0、1M溶液为8、40克/升。
PH计校正溶液配置得标准方法
1)pH4,邻苯二甲酸氢钾标准缓冲液:ﻫ精密称取在115±5℃干燥2~3小时得邻苯二甲酸氢钾[KHC8H4O4]10、12g,加水使溶解并稀释至1000ml。
ﻫ2)pH7,磷酸盐标准缓冲液(pH7、4):
精密称取在115±5℃干燥2~3小时得无水磷酸氢二钠4、303g与磷酸二氢钾1、179g,加水使溶解并稀释至1000ml。
另补充:磷酸盐标准缓冲液(pH6、8) 精密称取在115±5℃干燥2~3小时得无水磷酸氢二钠3、533g与磷酸二氢钾3、387g,加水使溶解并稀释至1000ml。
ﻫ3)pH9,硼砂标准缓冲液:ﻫ精密称取硼砂[Na2B4O7·10H2O]3、80g(注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免与空气中二氧化碳接触。
