中考化学总复习第一篇考点聚焦第13讲构成物质的微粒元素PPT课件
合集下载
初三化学《构成物质的微粒》单元复习课课件ppt

4、离子符号: 阳离子:Mg2+ 阴离子:Cl-
三、离子
5、离子符号的意义:
表示一种离子 离子符号
表示一个离子
6、离子符号里的数字的意义:
2Mg2+
表示每个镁离子带2个 单位的正电荷
表示2个镁离子
三、离子
(1)离子的形成
原子: Na +11 2 8 1 失一个电子
离子: Na+ +11 2 8
Cl +17 2 8 7 得一个电子
第三单元 构成物质的微粒
单元复习课
知识网络
定义
组成
纯净物
物 构成
质
混合物
元素
存在 符号
意义
写法 常见元素的化合价
周期表简介
分子
构分
成裂
原子 结构
质子
原子核 中子
得得
失 电
失 电
核外电子 原子结构示意图
子 子 质量表示方法
相对原子质量
离子 阳离子
阴离子
一、物质的构成
构成
物质 组 成 元素
构
构
总
宏观概念
四、元素
1、定义:质子数(即核电荷数)相同的一类原子的 总称 注意事项: ①“一类原子”指的化学变化中不能再分的粒子
②原子的质子数(即核电荷数)决定元素种类
元素——是一类原子的总称,只能讲 ③ 种类,不能讲个数。
原子——是一种粒子,有种类、个数
四、元素
2、地壳中含量较多的几种元素 含量前五位:氧、硅、铝、铁、钙
四、元素
3、元素符号书写的要求: ①由一个字母表示的元素符号要大写; ②由两个字母表示的元素符号,第一个字母大写 ,第 二个字母小写
三、离子
5、离子符号的意义:
表示一种离子 离子符号
表示一个离子
6、离子符号里的数字的意义:
2Mg2+
表示每个镁离子带2个 单位的正电荷
表示2个镁离子
三、离子
(1)离子的形成
原子: Na +11 2 8 1 失一个电子
离子: Na+ +11 2 8
Cl +17 2 8 7 得一个电子
第三单元 构成物质的微粒
单元复习课
知识网络
定义
组成
纯净物
物 构成
质
混合物
元素
存在 符号
意义
写法 常见元素的化合价
周期表简介
分子
构分
成裂
原子 结构
质子
原子核 中子
得得
失 电
失 电
核外电子 原子结构示意图
子 子 质量表示方法
相对原子质量
离子 阳离子
阴离子
一、物质的构成
构成
物质 组 成 元素
构
构
总
宏观概念
四、元素
1、定义:质子数(即核电荷数)相同的一类原子的 总称 注意事项: ①“一类原子”指的化学变化中不能再分的粒子
②原子的质子数(即核电荷数)决定元素种类
元素——是一类原子的总称,只能讲 ③ 种类,不能讲个数。
原子——是一种粒子,有种类、个数
四、元素
2、地壳中含量较多的几种元素 含量前五位:氧、硅、铝、铁、钙
四、元素
3、元素符号书写的要求: ①由一个字母表示的元素符号要大写; ②由两个字母表示的元素符号,第一个字母大写 ,第 二个字母小写
广东中考化学 第一部分 二、构成物质的微粒 课件(共31张PPT)

用离子符号表示,在
离子符号前加数字
(1要省略)表示 “__几__个__某__离__子_____” 如2个氢离子___2_H_+__ 1个碳酸根离子_C_O__32_
(1)都是构成物质的粒子 相 (2)都具有粒子的基本性质:质量和体积都___很__小____、都在不断___运__动____、粒子 同 之间有___间__隔____
二、构成物质的微粒
课标与中考
1.认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒。 2.能用微粒的观点解释某些常见的现象。 3.知道原子是由原子核和核外电子构成的。 4.知道原子可以结合成分子、同一元素的原子和离子可以互相转化。 5.初步认识核外电子在化学反应中的作用。
年份 2017 2018 2019 2020
3.最外层电子数与化学性质的关系:
最外层电子数 最外层电子数<4
最外层电子数≥4
最外层电子数= 8(只有一个电子层
的为2)
是否稳定 不稳定
不稳定
化学性质
易___失__去____最 外层电子
易___得__到____电 子,使最外层 达到稳定结构
稳定
不易得也不易失电 子
原子种类 一般为__金__属____原子
【例题 2】(2020·青岛中考)下列对宏观事实的微观解释不正确的是( B )
A.水通电生成氢气和氧气——化学反应中分子发生了改变 B.压瘪的乒乓球在热水中能鼓起来——温度升高,分子变大 C.端午时节粽飘香——分子不断运动 D.一氧化碳和二氧化碳的化学性质不同——不同种分子的性质不同 【易错点】(1)微粒的质量和体积不会随温度或压强的变化而变化,当物体发生三态 变化或者体积出现变化时,是微粒之间的间隔改变了,而分子本身的大小不变。 (2)如果分子本身发生了变化,那么该变化一定是化学变化。 (3)分子、原子在固态中,依然在不断运动。
2020中考化学复习专题构成物质的微粒(共33张PPT)【精美版】

考点帮 分子的性质
考点1 考点2 考点3 考点4
易失分点
物体热胀冷缩现象的原因分析 物体的热胀冷缩现象,是物质微粒间的间隔受热时增大,遇冷时缩小的 缘故,粒子的大小不会发生改变。例如:水烧开后易把壶盖顶起,是因为 受热后水分子间间隔变大;水银温度计受热液柱上升,是因为受热后汞 原子间间隔变大。
分子的性质
本内容适合人教版 九年级化学
中考第一轮复习
构成物质的微粒
主讲人 杨老师
构成物质的微粒
1.构成物质的基本粒子 构成物质的基本粒子有分子、原子、离子。
分子 原子 离子
得分巧记 由离子构成的物质目前只需记住两种物质:氯化钠[由钠离子(Na+)和氯离 子(Cl-)构成]和硫酸铜[由铜离子(Cu2+)和硫酸根离子(SO42-)构成]。
2020中考化学复习专题构成物质的微 粒(共33 张PPT) 【精美 版】
构成物质的微粒
2.分子和原子 化学性质
化学变化
原子
构成物质的微粒
易失分点 分子和原子概念的理解误区
分子只能保持物质的化学性质,不能保持物质的物理性质。在化学 变化中,分子可以再分,原子不可以再分。若离开了化学变化这一范 围,分子、原子都是可以再分的,分子可以分成原子,原子又可以分 成质子、中子和电子。
1.分子的性质
2020中考化学复习专题构成物质的微 粒(共33 张PPT) 【精美 版】
分子的性质
2.用微粒的观点解释
不发生 (1)物质的变化:由分子构成的物质在发生物理变化时,构成物质的分子______(填
发生 “发生”或“不发生”,下同)变化;发生化学变化时,构成物质的分子_____变化。
原子 原子 (2)化学变化的实质:反应物的分子分解为_____,_____又重新组合形成新的分子。
中考化学备考复习课件——构成物质的微粒(共18张PPT)

最外层电子数_小__于_4的原子,在化学反应中容易_失__去_ 电子,形成_阳__离子;最外层电子数一般大于等于4 相互 的原子,在化学反应中容易_得__到__电子,形成_阴__离 转化 子;最外层电子数等于8或2的原子,在化学反应中 _难__得___失__电__子__,不易形成离子。这就说明原子的化 学性质与__最__外__层__电__子__数__有关
考点解读
·变式训练
1.(2018•滨州市)事物的宏观表象是由其微观性质决 定的。下列事实及对这些事实的解释中,二者不相符的 是( B ) A.成熟的菠萝会散发出浓浓的香味,说明分子在不断
地运动 B.水沸腾时能掀开壶盖,说明分子的大小随温度升高
而增大 C.50mL水和50mL酒精混合后总体积小于100mL,说明
Байду номын сангаас点解读
考点1 用微粒的观点解释常见的现象 ·核心例题
【例1】(2018•济宁市)从分子、原子角度对下面一些 现象和变化的解释,合理的是( D ) A.花香四溢——分子很小,质量也很小 B.热胀冷缩——温度变化,分子或原子大小发生变化 C.滴水成冰——温度降低,分子间隔变小,停止运动 D.食品变质——分子发生变化,分子性质发生变化 解花动小物大变解分运食故香 分 , 质 小 化 子 动 品 选析析四散故的),总的变项::溢 到 选 热 随 故 是 , 质D解, 周 项 胀 温 选 在 故 ,释是 围 冷 度 项 不 选 是A正解由 的 缩 断 项 由B解确释于 空 , 变 的 于C释解。错分气是化运分错释误子中因而动子误错。是,为改的发。误不不分变,生。断是子,滴变运因或分水化动为原子成,,分子或冰分花子间原子,香很的子性分的 小 间 大 质子微 , 隔 小 发仍粒 质 ( 没 生在通 量 而 有 变不过 也 不 发 化断运 很 是 生 ,的
考点解读
·变式训练
1.(2018•滨州市)事物的宏观表象是由其微观性质决 定的。下列事实及对这些事实的解释中,二者不相符的 是( B ) A.成熟的菠萝会散发出浓浓的香味,说明分子在不断
地运动 B.水沸腾时能掀开壶盖,说明分子的大小随温度升高
而增大 C.50mL水和50mL酒精混合后总体积小于100mL,说明
Байду номын сангаас点解读
考点1 用微粒的观点解释常见的现象 ·核心例题
【例1】(2018•济宁市)从分子、原子角度对下面一些 现象和变化的解释,合理的是( D ) A.花香四溢——分子很小,质量也很小 B.热胀冷缩——温度变化,分子或原子大小发生变化 C.滴水成冰——温度降低,分子间隔变小,停止运动 D.食品变质——分子发生变化,分子性质发生变化 解花动小物大变解分运食故香 分 , 质 小 化 子 动 品 选析析四散故的),总的变项::溢 到 选 热 随 故 是 , 质D解, 周 项 胀 温 选 在 故 ,释是 围 冷 度 项 不 选 是A正解由 的 缩 断 项 由B解确释于 空 , 变 的 于C释解。错分气是化运分错释误子中因而动子误错。是,为改的发。误不不分变,生。断是子,滴变运因或分水化动为原子成,,分子或冰分花子间原子,香很的子性分的 小 间 大 质子微 , 隔 小 发仍粒 质 ( 没 生在通 量 而 有 变不过 也 不 发 化断运 很 是 生 ,的
中考化学复习:粒子构成物质化学课件PPT

符号 化学式
元素符号
离子符号
构成的 物质举 CO2由_分_子__构成 例
Fe由原__子__构成
NaCl由____构 成 离子
(1)都具有粒子的基本性质(非常小、在不停地运__动__着、粒 相同点 子之间有__间__隔____等)
(2)都能保持由它们直接构成的物质的化学性质
相互关 系
考点聚焦
冀考探究
第13课时┃ 粒子构成物质
考点聚焦
冀考探究
第13课时┃ 粒子构成物质
粒子的基本特性 命题角度:粒子的基本特性与生活实际的联系。 例4 用分子的观点对下列现象解释不正确的是( B ) A.氧气被压缩装入钢瓶——分子间有间隔 B.破碎的玻璃无法复原——分子间存在斥力 C.闻到路边怡人的花香——分子不停地运动 D.两块表面平滑的铅块紧压后会结合起来——分子间存在引力
考点聚焦
冀考探究
第13课时┃ 粒子构成物质
[方法点拨] 解题的关键是要将粒子的基本性质与宏观现象对 应起来。当物质发生体积或状态变化时,主要是与粒子之间的 间隔发生变化有关;一些扩散现象(如溶解、蒸发、挥发等)与 粒子的不停运动有关。
考点聚焦
冀考探究
15.能力是练出来的,潜能是逼出来的,习惯是养成的,我的成功是一步步走出来的。 83.一个人的脚步再大,也永远无法丈量完脚下的道路。人生有限,道路无限,要想在有限的生命中多走一程,就时刻别停下脚步,别浪费分秒时间。 33.优胜劣汰,适者生存。 69.一份信心,一份努力,一份成功;十分信心,十分努力,十分成功。 16.每一个优秀的人,都有一段沉默的时光。那一段时光,是付出了很多努力,忍受了很多的孤独和寂寞,不抱怨不诉苦,只有自己知道。而当日后说起时,连自己都能被感动的日子。 18.我们不是没有好的机会,而是没有好的观念。 61.人类的幸福和欢乐在于奋斗,而最有价值的是为理想而奋斗。 20.没有比人更高的山,没有比心更宽的海,人是世界的主宰。 86.嚣张冷酷狂躁冷漠,不是善良人用的字眼;坚强充实自由奋斗进取与悲观的人无缘。 4.每个人都在努力,并不是只有你满腹委屈。 35.不要只为一个人而活,你的人生,还可以拥有全世界。 30.生活有两大误区:一是生活给人看,二是看别人生活。 68.你要记住你不是为别人而活,你是为自己而活。 98.治天下者必先立其志。
中考化学基础总复习构成物质的微粒物质的元素组成物质的分类课件

点
一个该原子的质量
透 析
相对原子质量=
一个
C-12
原子的质量
×
1 12
主要集中在原子核 上。②相对原子质 量≈质子数+中子数。
知 识 体 系
梳 考点四 微粒结构示意图及离子符号中数字的含义
理
1.微粒结构示意图
内容
命
其中圆圈表示 原子核 ;圈内的数字表示核内质子数,图中17表
题
热
示氯原子的核内质子数
(填“正确”或“错误”)
集气瓶中
知
识
体
系 梳
[答案] (一)(2)不能 错误 红 正确
理
[解析] (一)(2)将其中一片干燥滤纸放入收集满氨气的集气瓶中,滤纸不变色,
说明氨气不能使酚酞变红,猜想二错误;在另一片滤纸上滴几滴蒸馏水,再放入
命
收集满氨气的集气瓶中,滤纸变成红色,说明氨气溶解在水中形成氨水,氨水能
命
燃烧生成水,化学反应中分子可以再分,而原子不可分,故B选项不符合题意;自
题 热
然界中水的天然循环是通过水的三态变化实现的,属于物理变化,在这个过程
点 透
中,水分子不断运动且分子间的间隔发生了变化,故C选项符合题意;食物变质
析
发生了化学变化,生成了新物质,食物中的分子种类发生了改变,分子的性质也
发生了变化,故D选项不符合题意。
命
分子的质量和体积都很小。
题 热
(7)1 mL水中约含有3.3×1022个水分子:
分子之。间有间隔
点 透
(8)将50 mL水和50 mL酒精相混合,为什么总体积小于100
析
mL?____同_种__分__子__化__学_性_ 质相同
2019中考化学必备复习 第一部分 物质构成的奥秘 第1节 构成物质的微粒课件

第一部分 物质构成的奥秘
第1节 构成物质的微粒
考纲要求
1. 物质的微粒性(认识) 2. 分子、原子、离子等都是构成物质的微粒(知道) 3. 用微粒的观点解释某些常见的现象(理解) 4. 原子是由原子核和核外电子构成的(知道) 5. 原子可以结合成分子,同一种元素的原子和离子 可以相互转化(知道) 6. 核外电子在化学反应中的作用(认识)
A.缉毒犬能根据气味发现毒品,是由于分子不断运动
B.石灰石能被研磨成粉末,说明分子很小
C.变瘪的乒乓球放入热水中能鼓起来,是由于分子受
热变大
D.降温能使水结成冰,是因为在低温下水分子静止不动
3.下列物质中,由原子直接构成的是
A.铜
B.水
(A )
C.氯化钠
D.二氧化碳
h
11
4.原子序数为94的钚(Pu)是一种核原料,该元素
h
7
(2)分子、原子的联系:分子由_原_子__构成;分子、原子都
可以直接构成物质。
(3)在化学变化中,原子的种类不变,指的是原子核不
发生变化,但核外电子(一般是最外层电子)可能得失。
(4)原子的质量主要集中在______上,相对原子质量
≈______+______。 3.质离子子数 中子数
原子核
(1)定义:带电的原子或原子团。
h
5
(5)表示方法:原子用_元__素_符__号__表示。如氢原子:H。 (6)原子的构成:
质子 中子
(质子数=_核__电_荷__数__=_原_子__序__数__=_核__外__电_子__数__)
h
6
(7)原子结构示意图:
相似 元素的种类
稳定
失
不稳定
得
第1节 构成物质的微粒
考纲要求
1. 物质的微粒性(认识) 2. 分子、原子、离子等都是构成物质的微粒(知道) 3. 用微粒的观点解释某些常见的现象(理解) 4. 原子是由原子核和核外电子构成的(知道) 5. 原子可以结合成分子,同一种元素的原子和离子 可以相互转化(知道) 6. 核外电子在化学反应中的作用(认识)
A.缉毒犬能根据气味发现毒品,是由于分子不断运动
B.石灰石能被研磨成粉末,说明分子很小
C.变瘪的乒乓球放入热水中能鼓起来,是由于分子受
热变大
D.降温能使水结成冰,是因为在低温下水分子静止不动
3.下列物质中,由原子直接构成的是
A.铜
B.水
(A )
C.氯化钠
D.二氧化碳
h
11
4.原子序数为94的钚(Pu)是一种核原料,该元素
h
7
(2)分子、原子的联系:分子由_原_子__构成;分子、原子都
可以直接构成物质。
(3)在化学变化中,原子的种类不变,指的是原子核不
发生变化,但核外电子(一般是最外层电子)可能得失。
(4)原子的质量主要集中在______上,相对原子质量
≈______+______。 3.质离子子数 中子数
原子核
(1)定义:带电的原子或原子团。
h
5
(5)表示方法:原子用_元__素_符__号__表示。如氢原子:H。 (6)原子的构成:
质子 中子
(质子数=_核__电_荷__数__=_原_子__序__数__=_核__外__电_子__数__)
h
6
(7)原子结构示意图:
相似 元素的种类
稳定
失
不稳定
得
微粒元素 九年级科学课件
通过了金箔,极少数α粒子发生偏转或被弹回,根据上述现
象有同学得出了以下结论,你认为其中合理的是( D)
A、金原子是实心球体,紧密结合排列
B、金原子核不带电
C、金原子质量与α粒子相当
D、相对金原子而言金原子核体积很小
3、若用“ ”表示氢原子,用“ ”表示氧原子,
则保持水的化学性质的最小粒子可表示为C( )
分子和原子的关系
不同点 在化学变化中,分子可分,原子不可分
相同点 都能构成物质
联系
分子
分割 组合
原子
分子是由原子构成的
水分子 氢原子 氧原子 氢分子 氧分子
分子模型
NH3氨气
O3臭氧
SO3三氧化硫 CO2 二氧化碳
水分子
甲烷分子
C60分子
分子的基本性质
1 、分子之间有空隙 2、分子在不停地作无规则的的运动。 3、分子之间存在引力和斥力
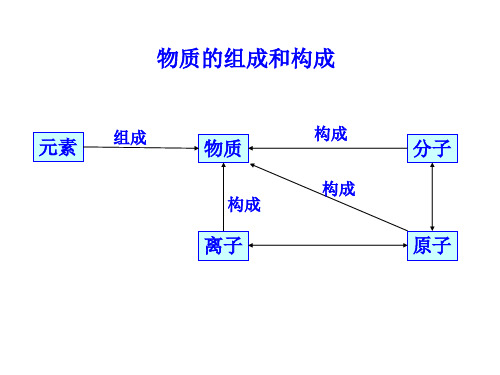
物质的组成和构成
元素 组成
物质
构成
离子
构成 构成
分子 原子
● 原子的概念 ● 原子的结构 ● 相对原子量 ● 原子模型的发展
●学习目标
水通电分解
原子的结构
电性 相对质量
质子 带正电 1
夸
原子核
克
不
原 子
中子 不带电 1
构 成
显 电 性
核外电子
带负电 1/1840
原子序数=核电荷数=核内质子数=核外电子数 只有氕原子没有中子.
● ⑴ Fe2O3 + CO= Fe + CO2
● ⑵ Al + CuSO4= Al2(SO4)3 + Cu
1 3 ● ⑶ C2H2 + O2= H2O + CO2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-
1
-
2
-
3
-
4
-
5
-
6
-
7
-
8
-
9
-
10
-
11
-
12
-
13
-
14
-
15
-
16
-
17
-
18
-
19
1.识图:
-
20
2.根据结构示意图判断原子和离子 a.质子数-电子数=0,为原子; b.质子数-电子数>0,为阳离子; c.质子数-电子数<0,为阴离子。 3.原子结构示意图与元素周期表 a.等量关系:质子数=核电荷数=原子序数=核外电子数。 b.得失电子情况:一般情况下,最外层电子数<4时,易失去最外层 电子,形成阳离子;最外层电子数≥4时,易得到电子,形成阴离子,故 元素的化学性质与原子的最外层电子数关系南京)下列粒子结构示意图中,表示阳离子的是( )
【解析】核内质子数>核外电子数,表示阳离子;核内质子数=核外 电子数,表示原子;核内质子数<核外电子数,表示阴离子。故选B。
【答案】B
-
22
-
23
-
24
1
-
2
-
3
-
4
-
5
-
6
-
7
-
8
-
9
-
10
-
11
-
12
-
13
-
14
-
15
-
16
-
17
-
18
-
19
1.识图:
-
20
2.根据结构示意图判断原子和离子 a.质子数-电子数=0,为原子; b.质子数-电子数>0,为阳离子; c.质子数-电子数<0,为阴离子。 3.原子结构示意图与元素周期表 a.等量关系:质子数=核电荷数=原子序数=核外电子数。 b.得失电子情况:一般情况下,最外层电子数<4时,易失去最外层 电子,形成阳离子;最外层电子数≥4时,易得到电子,形成阴离子,故 元素的化学性质与原子的最外层电子数关系南京)下列粒子结构示意图中,表示阳离子的是( )
【解析】核内质子数>核外电子数,表示阳离子;核内质子数=核外 电子数,表示原子;核内质子数<核外电子数,表示阴离子。故选B。
【答案】B
-
22
-
23
-
24
