第7章 配位平衡和配位滴定法
18-药用化学基础-第七章-配位平衡与配位滴定法

H 2[PtCl6]
酸
[Cu(NH3)4] (OH)2 碱
配 合 物
[Cu(NH3)4] SO4 [Ni(CO)4]
盐
电中性
2、配合物的组成
❀ 配合物的组成: [ Cu ( NH 3 ) 4 ] SO4
中心原子 配体 配位数
内界(配离子)
外界
配合物
(1)内界与外界:
①内界:具有一定稳定性的结构单元。
③举例:
形成体
(中心离子或中心原子)
[Cu(NH3)4]2+ [Fe(CN)6]3Cu2+ Fe3+ Pt2+ Fe原子 Si4+
[PtCl2(NH3)I2]
[Fe(CO)5] [SiF6 ]2-
(3)配位体和配位原子:
①配位体:(配体)
在配合物中,与中心离子(或原子) 相结合的分子或离子,称为配位体,简 称配体。 例如:
(4)配位数
直接与中心离子(或原子)结合的配位原子的数目。 配位数=配位键数目 配合物 [Cu(NH3)4] 2+ [Cu(en)2] 2+ [Co(en)2(NH3) Cl] 2+ 配位数 4 4 6 配位原子 N N N、N、Cl
练习:
一、指出下列配合物的配位原子和配位数: 配合物 配位原子 Cl、N N N N Cl、N 配位数 4 6
通常K稳较大,为书写方便常用lgK稳来表示。 (2)lgK稳的影响因素:
①配体的电荷越高,配离子的lgK稳值越大。
②配体的半径越小,配离子的lgK稳值越大。
6、配离子稳定常数的应用: 计算配合物中有关离子的浓度。 例7-1:
在含有0.10 mol/L [Cu(NH3)4]2+ 配离子溶 液中,当NH3浓度分别为 (1)1.0 mol/L, (2)2.0 mol/L 时, 处于平衡状态时游离Cu2+的浓度分别是 多少? (已知 [Cu(NH3)4]2+ 的 K稳=2.1×1013)
配位平衡与配位滴定法共37页PPT

谢谢!
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
配位平衡与配位滴定法
26、机遇对于பைடு நூலகம்准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
大专第7章配位滴定

多,故可以消除干扰。
解
蔽
滴定完毕,将被掩蔽的离子释放出来。 如测定铜合金中的铅锌时, 用KCN掩蔽铜离子与锌离子。而铅离子不被掩蔽 用EDTA滴定完铅离子后,可再加入甲醛,则 Zn(CN)42-被解蔽而释放出Zn2+。再用EDTA继续滴 定Zn2+
第四节、金属指示剂
一、金属离子指示剂作用原理: 金属离子指示剂:配位滴定中,能与金属 离子生成有色配合物从而指示滴定终点
2 2
⑤三乙基四胺六乙酸(TTHA):
HOOCCH2 HOOCCH2 N (CH2)2 N (CH2)2 N (CH2)2 N CH2COOH CH2COOH
三、乙二胺四乙酸(EDTA)的性质
(一)EDTA的结构、性
HOOCCH2 HOOCCH2 CH2COOH CH2COOH
Cu2+-NH3 络合物
第一节
概 述
一、定义 配位滴定法:配位反应为基础 配位反应:金属离子与配位剂生成配合物 配位剂:无机配位剂 有机配位剂 配合物:简单配合物 螯合物
例:用AgNO3溶液滴定CNˉ,反应如下: Ag + + 2CNˉ === [Ag(CN)2]ˉ 滴定至化学计量点时,再加一滴AgNO3 溶液,则: Ag + + [Ag(CN)2]ˉ === Ag[Ag(CN)2]↓ 生成白色的Ag[Ag(CN)2]沉淀,指示终点到达。
(二)指示剂的僵化:计量点时指示剂变色缓慢 产生原因: MIn溶解度小→与EDTA置换速度缓慢→终点拖后 消除方法: 加入有机溶剂或加热→ 提高MIn溶解度 →加快置换速度
四、常用金属离子指示剂
1. 铬黑T(EBT) 终点:酒红→纯蓝 pH﹤6 pH=7~11 pH ﹥12 紫红色 蓝色 橙色 适宜的pH:7.0~11.0(碱性区) 缓冲体系:NH3-NH4Cl
配位滴定法习题

第7章 配位滴定法一、考试大纲要求(一)掌握1.掌握EDTA 滴定法的基本原理,能正确选择滴定条件。
2.掌握指示剂变色原理。
3.掌握EDTA 标准溶液的配制、标定。
(二)熟悉1、熟悉常用金属指示剂变色范围和使用条件。
2、熟悉Ca 2+、Mg 2+、Zn 2+、Al 3+等离子的测定。
(三)了解了解滴定终点误差。
二、重点与难点(一)重点1.配合物的条件稳定常数:条件稳定常数的计算和应用。
2.配位滴定法滴定曲线:滴定曲线的计算、突跃范围、化学计量点pM /值。
3.金属指示剂:变色原理、应用条件、应用对象。
4.标准溶液的配制与标定:基准物、标定条件。
5.滴定方式:滴定方式的选择、条件控制和应用范围。
(二)难点1.配位反应的副反应及副反应系数:副反应类型、副反应系数的计算。
2.滴定条件的选择:滴定终点误差、酸度的选择、掩蔽剂的选择。
三、主要公式1.金属-EDTA 配合物的稳定常数 ]][[][Y M MY K MY =2.累积稳定常数 nn n n L M ML K K K L M ML K K L M ML K ]][[][]][[][]][[][212221211======βββ3.各级配合物的浓度与游离金属离子浓度[M]和游离配合剂浓度[L]的关系nn n L M ML L M ML L M ML ]][[][]][[][]][[][2221βββ===4.副反应系数 ][][Y Y Y '=α 5.弱酸的酸效应系数6656546543654326543212345(H)6[H ][H ][H ][H ][H ]1[H ]Y a a a a a a a a a a a a a a a a a a a a a K K K K K K K K K K K K K K K K K K K K K α++++++=++++++6.共存离子效应系数 NY N Y K N ][1)(+=α7.滴定体系中同时发生酸效应和共存离子效应,则总的副反应系数 1)()(-+=NY Y H Y Y ααα 8.单一金属离子M 的副反应系数 n n L M L L L ][][][1221)(βββα++++= 9.多种金属离子的总副反应系数 )1()()(21P L M L M M -+++= ααα10.条件稳定常数:]][[][Y M Y M K MY'''=' MY Y M MY MYK K αααlg lg lg lg lg +--=' 11.化学计量点时金属离子的浓度 )lg (21][)()(MYsp M MYsp M sp K pC M p K C M '+=''=' 12.终点时金属离子的浓度 ()p lg lg t MIn In H M K α=- 13.林邦(Ringbom )误差公式 %1001010)(//⨯'-=∆-∆MYsp M pMpM K C TE四、例题详解1.在pH =10.0的缓冲介质中,以0.01000mol/L 的EDTA 滴定50.00mL 同浓度金属离子M 2+溶液,已知在此条件下配位反应进行完全,当加入EDTA 溶液从49.95mL 到50.05mL 时,计量点前后的pM 改变了2个单位,计算配位化合物MY 2—的稳定常数K MY 为若干。
化学分析-配位滴定
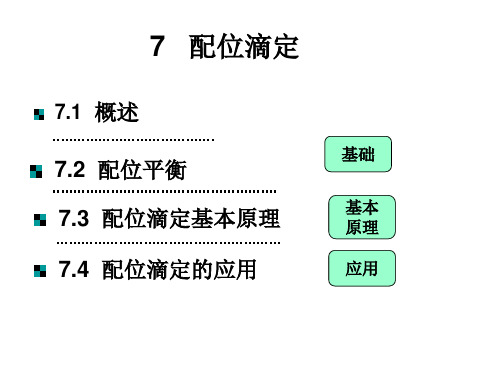
7.1 概述
基础
7.2 配位平衡
7.3 配位滴定基本原理
基本 原理
7.4 配位滴定的应用
应用
5.1 概述
1. 配位滴定法:以配位反应为基础的滴定分析方法
2.配位滴定中应用氨羧配位剂
EDTA最常用
氨基二乙酸
O H2 C C OH N C C OH H2
O
O
C
H2C N
O
H2 C
CH2
H2C OC O
[OH-] 增大, αM(OH) 增大 (酸性溶液中αM(OH) 忽略)
通过加缓冲溶液,控制酸度来避免
例:Zn + Y =
OH-
NH3 …
H+
Zn(OH)+ Zn(NH3)2+ HY
●
●
●
●
●
●
●
●
●
Zn(OH)
2 4
Zn(NH 3 )42
H6Y
Ca2+
CaY
αZn(OH)
Zn(NH 3 ) αY(H) αY(Ca)
ZnY
H+
ZnHY
OH-
ZnOHY
αZnY(H) αZnY(OH)
Zn
[Zn' ] [Zn]
Zn(OH ) Zn(NH3 ) 1
Y
[Y' ] [Y]
ZnY
[(ZnY) '] [ZnY]
Y (H ) Y (N ) 1
小结
★副反应系数--定量衡量副反应进行的程度
3 MY配合物的条件稳定常数
1 配位反应的主反应和副反应
M+ Y =
配位滴定法-PPT课件全

[Ca’]1 =
0.02
0.1000(初始钙浓度) 20.00+19.98
= 0.02 0.1000(初始钙浓度) / 2 39.98 / 2
0.02
C sp ca2
39.98 / 2
1.0
103
C sp ca2
PCa’1
3.0
log
C sp ca2
滴定至100.1%时
[Ca’]2
=
[CaY [Y’]2 K
sp
100%
cM(SP)
稳定常数定义可知
化学计量点时:
K' MY
[MY ]sp [M ']sp[Y ']sp
滴定终点时:
K' MY
[MY ]ep [M ']ep[Y ']ep
取对数后分别为
pM
' sp
pYs'p
lg
K
' MY
lg[MY ]sp
pM
' ep
pYe'p
lg
K
' MY
lg[MY ]ep
接近化学计量点 [MY ]sp [MY ]ep
pM ' pY ' 0
化学计量点时[MY] sp
CM (sp)
K' MY
[MY ]sp [M ']sp[Y ']sp
所以 [M ']sp =[Y ']sp =
CM (sp) K'
MY
Y' M'
TE(%) ep
ep 100%
cM(sp)
Y' 10pY' M' 10pM'
国家开放大学电大《无机及分析化学》学习重点及试题解答
.
应用化工技术专业
无机及分析化学期末复习指导
Word文档资料
《无机及分析化学》考核说明
第一部分课程考核的有关说明
一、考核对象
本课程考核对象为:大学开放教育应用化工技术专业(专科)课程开放试点的学生。
二、考核方式
本课程采用形成性考核和终结性考试相结合的方式。
三、考核依据
《无机及分析化学》。
四、课程总成绩的记分方法
由于无机及分析化学课程包括理论教学和实验教学两部分,所以形成性考核应视平时作业和实验的完成情况及学习情况给分,计占课程总成绩的30%。
1
终结性考试为对学生所学本课程知识的掌握程度而进行的考核,它占总成绩的70%。
课程总成绩按百分制记分,60分为及格。
即以上两个成绩累计60分以上(包括60分)为考核通过。
五、形成性考核要求及形式
形成性考核采取平时作业和实验的完成情况及学习情况给分。
作业由中央电大统一布置、下发专门设计的综合性作业,办学单位教师批改、判分,中央电大抽查、监督。
六、终结性考试要求及形式
1.考试要求本课程的考试重点是无机及分析化学的基础理论、基本知识、重要化合物的性质、化学分析的基本方法。
考试要求分三个层次:掌握、理解(或熟悉)、了解。
2.组卷原则在教学大纲和考核说明所规定的要求和内容范围之内命题,根据本课程的教学要求,在终结性考试中,掌握的内容约占总分的60~70%,理解(或熟悉)的内容约占总分的20~30%,了解的内容约占总分的10%;
2。
配位滴定法
1
K1
[ ML ] [ M ][ L ]
2
K 1K
2
[ ML 2 ] [ M ][ L ] 2
n
K 1K
2
K
n
[ ML n ] [ M ][ L ] n
可方便地计算出各级配合物的浓度
[ ML ] 1[ M ][ L ] [ ML 2 ] 2 [ M ][ L ]2
[ ML n ] n [ M ][ L ]n
配位滴定法
§1 概述 配位滴定法:以配位反应为基础的滴定分析
分析方法 配位滴定反应必须具备的条件: 1、反应定量进行
2、生成的配合物有足够的稳定性 CMKMY′≥106
3、反应迅速,有适当的方法确定终点
一、EDTA的性质及其配合物
一、乙二胺四乙酸的性质与离解
H HO O2 2C C O OC C NH H -2-C C 2 H -H NC C2 2 C H C HO OO O
1[H][H]2 [H]3 [H]4
[H]5
Ka6
K K K K K K K K K K K K K K a6 a5
a6 a5 a4
a6 a5 a4 a3
a6 a5 a4 a3 a2
[H]6
K K K K K K a6 a5 a4 a3 a2 a1
[Y']为平衡后所有未与配位的EDTA总浓度 [Y4-]为EDTA有效浓度
在酸性溶液中形成六元酸H6Y2+ Y 4- H 3H - 2 Y 2H - 3 Y -H 4 Y H 5 Y +H 6 Y 2
各种形式的分布与pH有关,只有Y4才与金属离子生成配合物
EDTA常用H4Y表示,难溶于水和一般有机溶 剂,易溶于碱液,生成相应的盐,故商品常为乙
配位滴定法
VM M' MY' cM VM VY
滴定曲线的计算
假设:Y滴定M cM——M的初始浓度
VM——初始体积(ml)
cY——Y的初始浓度 VY——加入的Y的体积
VY Y' MY' cY VM VY
MY' K' MY M'Y'
第五章
第五章
配位滴定法
化学分析
累积稳定常数:MLn型配合物
M + L ML + L
…..
ML ML2
[ML] K1 [M][L]
[ML2 ] K2 [ML][L]
[MLn ] Kn [MLn -1 ][L]
MLn-1 + L
MLn
第五章
配位滴定法
化学分析
累积稳定常数() : 将逐级稳定常数相乘得到。
pCu(SP) 2.00
第五章
配位滴定法
化学分析
第二步:
计算Cu2+的副反应系数M(配位效应:NH3,OH-)
1 NH3 SP 0.20 0.10(mol/L ) 2 2 3 4 α Cu(NH 3 ) 1 β1 NH3 β 2 NH3 β 3 NH3 β 4 NH3 1 104.13 0.10 107.61 0.102 1010.48 0.103 1012.59 0.104 108.62
第五章
配位滴定法
化学分析
小结:
pH
pH pH
<1 , 以 H6Y 的型体存在。
>10.26, 主 要以Y4-形式存在。 ≥12 时,几 乎完全以Y4-形式 存在。
七章节配位滴定法
第四节、 EDTA滴定法原理
一 .EDTA滴定曲线 在配位滴定过程中,随着配位剂的加入, 由于配合物的形成,溶液中金属离子的浓 度不断减少,如以pM为纵坐标,加入配位 剂的量为横坐标作图,可以得到与酸碱滴 定相类似的滴定曲线。
现以pH=12时,0.01000 mol/L EDTA标准 溶液滴定20.00ml 0.01000mol/L(Ca2+ ) 溶液 为例,计算pCa的变化情况。
(2)滴定开始至等量点前,溶液中未被滴定的 Ca2+与反应产物CaY同时存在。
严格地说,溶液中的Ca2+既来自剩余的Ca2+, 又来自CaY的离解。
考虑到lgK’f(CaY)数值较大,CaY的离解甚微, 且溶液中Ca2+对CaY的离解又起抑制作用, 故可忽略CaY的离解,近似地用剩余的Ca2+ 来计算溶液中Ca2+的浓度。
2、EDTA与金属离子形成的螯合物
由于EDTA的阴离子Y4-的结构具有两个氨基氮原子和四个 羧基氧原,它既可以作为四齿配位,也可以作为六齿配位 体。
由于大多数金属离子的配位数为4或6,这样EDTA不仅能 和绝大多数的金属离子起配位反应,而且一个EDTA能满 足一个金属离于的配位要求。
在一般情况下,EDTA与金属离子起配位反应时,不论金 属离子是二价、零价还是四价,均形成1:1的配合物。
Kf(MY) [[M M]cYY] 1105110205 108 则:lgK'f(MY) 8
三.酸效应曲线及其应用
当滴定不同的金属离子时,对稳定性高的配合物,溶液的酸 度稍高也能准确地进行滴定,但对稳定性稍差的配合物, 酸度若高于某一数值时就不能准确滴定.因此,滴定不同的 金属离子时,所允许的最低pH值(或称最高酸度)不同,若超 过这一最低pH就不能进行准确滴定.其 pH就是滴定某一 金属离子所允许的最低pH. lgK’f(MY)= lgKf(MY)-lgaYH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本章主要内容: 第一节 配位化合物的基本概念 第二节 配位平衡 第三节 配位滴定法
配位化合物的生物医药应用
实验
CuSO4溶液 适量氨水
(浅蓝色)
乙醇
[Cu(NH3)4]SO4晶体
(深蓝色)
Cu2(OH)2SO4
↓
过量氨水
(蓝色)
[Cu(NH3)4]2+
(深蓝色)
N
N
N
N
名称 草酸根
乙二胺
邻菲罗啉
联吡啶 乙二胺 四乙酸
缩写符号 (OX) (en)
(o-phen) (bpy)
(H4edta)
CH2 H2N
CH2 NH2
NN
乙二胺(en)
联吡啶(bpy)
O O 2–
N
N
1,10-二氮菲(邻菲咯啉)
CC
O• •
O• •
C2O42-
3.配体数和配位数
配体数:配合物中配体的总数 配位数:与中心原子结合成键的配位原子的数目 单基配体形成的配合物:
配体命名顺序
同类配体中配位原子相同,较少原子数的配体在前, 较多原子数的配体列后
例:[Pt(NH3)2 (NH2OH)NO2]Cl 氯化一硝基 ·二氨·一羟胺合铂(Ⅱ)
配离子为阴离子,则在配离子与外界阳离子之间用
“酸”字连接;若外界为氢离子,则在配离子之后缀以
“酸”字,即“某酸”。
K[Al(OH)4]
1、配合物的命名顺序 内外界顺序与一般无机化合物的命名原则相同。 阴离子名称在前,阳离子名称在后。
2、内界(配离子)的命名顺序
配体数
配体名称
合
(汉字数字) (不同配体间用圆点·分开)
中心原子名称 中心原子氧化值 (加括号的大写罗马数字)
[Cu (NH3) 4] SO4
硫酸 四氨 合 铜 (Ⅱ)
K [ Pt Cl5 (NH3) ] 五氯·一氨合铂(Ⅳ)酸钾
单基配合物是指由单基配位体与中心离子结合而 形成的配合物。一般没有环状结构。
多基配合物是多基配体的两个或两个以上的配位 原子与一个中心离子形成具有环状结构的配合物, 俗称螯合物。 常用的有机配位剂为氨羧配位剂:乙二胺四乙酸 (EDTA)
螯合物和螯合效应
螯合物(Chelate)是中心原子与多基配体形成的具 有环状结构的一类配合物。
配位平衡之间的移动总是向生成配离子稳定性大的 方向进行.
第三节 配位滴定法
配位滴定法:以配位反应为基础,以配位剂为标 准溶液直接或间接滴定被测物质含量的滴定分析 方法。 配位滴定反应需具备的条件: 1. 配位反应生成的配位化合物必须稳定且可溶; 2. 配位反应必须按一定的反应式定量进行; 3. 配位反应速率要快; 4. 有合适的指示剂确定滴定终点。
Kf=K1.K2......Kn
二、配位平衡的移动
M n xL
ML(xn-x)
水解
酸效
效应沉淀 应
效应 氧化
还原
效应
1酸度的影响 2沉淀的影响 3 氧化还原的影响
(1)配位平衡与酸碱平衡
酸效应: 增大溶液[H+]浓度,导致平衡移动,配离子 稳定性降低
Cu2+ + 4NH3
+ 4H+
[Cu(NH3)4]2+
原子:
H2[PtCl6]
六氯合铂(Ⅳ)酸
Na2[Ni(CN)4]
四氰合镍(Ⅱ)酸钠
[Co(NH3)6]Cl3
三氯化六氨合钴(Ⅲ)
[CoCl2(NH3)3H2O]Cl
氯化二氯·三氨·一水合钴(Ⅲ)
[Pt(NH2)(NO2)(NH3)2] 一胺基·一硝基·二氨合铂(Ⅱ)
四、配位化合物的类型
配位化合物根据配体的种类分为单基配合物和 多基配合物两种。
Ag+ Cl- AgCl NH3
[Ag(NH3)2]+ Br-
CN-
AgBr
[Ag(CN)2]-
反应朝哪个方向移动,取决于沉淀剂与配体争夺金属 离子的能力
Kf越大,Ksp也越大,反应朝配位平衡方向移动 Kf越小,Ksp也越小,反应朝沉淀平衡方向移动
AgCl+2NH3
[Ag(NH3)2]++Cl-
4NH4+
溶液的酸度越强,配离子越不稳定;
配离子的Kf越大,抗酸能力越强.
水解效应:因[OH-]浓度增加,金属离子与OH-结 合致使配离子解离的作用
M + mL
nOH-
MLm
M(OH)n
在不产生氢氧化物沉淀的前提下,适当提高溶液的pH 以保证配离子的稳定性。
(2) 配位平衡与沉淀溶解平衡
配体数=配位数 多基配体形成的配合物:
配体数<配位数 例:[Cu (NH3) 4] SO4:配体数 4
配位数 4
[Cu (en) 2] SO4: 配体数 2 配位数 4
4.配离子的电荷
配离子的电荷数等于中心原子和配体总电荷的代数和。
例:[Cu (NH3) 4] 2+
+2
[AlF6]3-
-3
三、配位化合物的命名
配位单元:金属离子(或原子)与一定数目的中性 分子或阴离子以配位键相结合生成的复杂离子或分子。 配位物:含有配位单元的化合物统称配位化合物, 简称配合物。
例:[Cu(NH3)4]2+、[Fe(CN)6]3-、[Ni(CO)4]
二、配位化合物的组成
1.中心原子 位于配合物的中心 具有空的电子轨道 能接受孤对电子 多为副族的金属离子和原子
[Ni(CO)4] [PtCl4(NH3)2]
四羰基合镍 四氯·二氨·合铂
配合物的命名
类型
化学式
配位酸
H[BF4] H3[AlF6]
配位碱 [Zn(NH3)4](OH)2 [Cr(OH)(H2O)5](OH)2
配 位 盐 中性分 子
K[Al(OH)4]
[Co(NH3)5(H2O)]Cl3 [Pt(NH3)6][PtCl4]
配体命名顺序
先无机,后有机 例: [Cr(en)2Cl2]Cl 氯化二氯 ·二(乙二胺)合铬(Ⅲ)
先阴离子配体,后中性分子配体 例:[Co(NH3)4Cl2]Cl 氯化二氯·四氨合钴(Ⅲ)
同类配体,按配位原子的元素符号在英文字母表中 的顺序排列
例:[Co(NH3)5H2O]Cl3 氯化五氨 ·一水合钴(Ⅲ)
乙二胺四乙酸在溶液中的六级解离平衡
OH-
OH-
H6Y2+
H5Y+
H+
H+
OH-
H4Y
H+
OH-
H3Y-#43;
HY3-
H+
Y4-
各型体浓度取决于溶液pH值
pH < 1 pH 2.67~6.16 pH > 10.26
H6Y2+ 主要:H2Y2-(pH≈4.5) Y4-(最佳配位型体)
碱性溶液
EDTA各种型式的分布系数与溶液pH的关系
7种型体中,与金属离子直接发生配位反应的是Y4-,酸度越低,EDTA的配位能 力越强。
EDTA在水中的溶解度很小,室温下溶解度为0.02g/100mL水, 故常用它的二钠盐Na2H2Y·2H2O(EDTA二钠)。该二钠盐在 22℃时,溶解度为11.1g/100mL水,浓度约为0.3mol/L。由于 EDTA酸实际应用较小,故习惯上将常用二钠盐Na2H2Y·2H2O 称为EDTA。
CH3
[Cd(en)2]2+ 五元环 K稳=1.7 1010
二(乙酰丙酮)合铜 六元环 K稳= 2.8 1015
螯合环的数目: 螯合环的数目越多,稳定性越大
金属离子形成螯合物后,其颜色、氧化还 原稳定性、溶解性等均发生了很大的变化,且 大都可以溶解于有机溶剂中。利用这些特性, 可以进行沉淀、溶剂的萃取分离等工作。
AgBr+2NH3
K
1
1
1.8105
Ksp[ AgBr] K f [ Ag(NH3 )2 ] 5 1013 1.1107
(3) 配位平衡与氧化还原平衡
2Fe3 6C2O42 2[Fe(C2O4 )3 ]3
2I
平衡移动方向
2Fe2 I 2
工业应用:湿法炼金
四羟基合铝 (Ⅲ)酸钾
H[BF4]
四氟合硼(Ⅲ)酸
配离子为阳离子,若配合物的外界是一个复杂的含
氧酸根离子,便叫“某酸某”,若是一个简单的阴离
子,一般叫“某化某”。
[Cu(NH3)4]SO4 [Zn(NH3)4](OH)2
硫酸四氨合铜(II) 氢氧化四氨合锌(II)
没有外界的配合物 中心原子的氧化数可不必标明。如:
[Ni(CO)4] [PtCl2(NH3)2]
命名 四氟合硼(Ⅲ)酸 六氟合铝(Ⅲ)酸
氢氧化四氨合锌(II) 氢氧化一羟基五水合铬(Ⅲ)
四羟基合铝 (Ⅲ)酸钾 三氯化五氨一水合钴(Ⅲ) 四氯合铂(II)酸六氨合铂(II)
四羰基合镍 二氯二氨合铂(II)
1、命名下列配合物,并指出中心离子的配位数和配体的配
中性分子 配体
配位原子
常见单基配体
H2O 水
NH3
CO
氨
羰基
O
N
C
CH3NH2 甲胺
N
阴离子 配体
配位原子 阴离子配体
配位原子
F氟 F
CN氰基
C
Cl氯 Cl NO2硝基
N
Br-
I-
OH-
溴
碘
羟基
Br
I
O
ONO- SCN-
NCS-
亚硝酸根 硫氰酸根 异硫氰酸根
