第4章 萃取法.
溶剂萃取(精)

1. 螯合物萃取体系
螯合物萃取是分析化学中应用最广泛的萃 取体系,所用的萃取剂为螯合剂。可用做萃取 剂的螯合剂与试样中的被萃取金属离子生成四 元、五元或六元环状螯合物很稳定,因而萃取 灵敏度很高,可用于萃取浓度很低的金属离子, 在分离同时达到富集的效果。
萃取过程
① 萃取剂在两相中分配平衡 ② 水相中萃取剂电离平衡 ③ 萃取剂与萃取离子络合平衡 ④ 内络盐在两相中分配平衡
(CH3)2N
S
N(CH3)2 +
[BF4] -
N
主要萃取条件:配位阴离子、酸性溶液和惰性溶剂
高分子量胺萃取
高分子量胺(本身是液体,有时溶在稀释剂中)
与酸反应生成的盐难溶于水,但易溶于有机溶剂
而被萃取。
质子加成反应
R3 N有机 H A R3 NH A有 机
因此,高分子胺可用于水溶液中酸的萃取。
V(有机)
)2
DV(有机) V(水)
经n次萃取后水相中剩余溶质质量:
mn
m0
(
V(有机)
)n
DV(有机) V(水)
n次萃取后的萃取效率E为:
E
1
(
V(水) DV(有机)
)n V(水)
以CCl4萃取20mL水溶液中的I2,已知 碘在水与CCl4的分配比为85,试比较用 20mL CCl4 一次萃取及每次用 10mL CCl4 分两次萃取的萃取效率。
D cA总 (有机) cA总 (水)
3.萃取百分率
萃取百分率:被萃取物在有机相中的量占 它在两相中的A在两相中的总量
100%
4.萃取效率
设:萃取体系中水相的体积为V水, 有机相的体积为V有,则萃取效率可从下 式计算:
精细化工产品的纯化技术研究

精细化工产品的纯化技术研究第一章:绪论精细化工产品是化工领域中的一种高附加值产品,具有广泛的应用领域,例如医药、食品、电子、光学等。
然而,精细化工产品的开发和生产常常受到纯度和杂质等因素的影响。
因此,发展有效的纯化技术对于提高精细化工产品的质量和产量至关重要。
本文旨在探讨精细化工产品的纯化技术,分析不同的纯化方法及其应用范围以及优缺点,以期为精细化工产品的开发和生产提供有价值的参考。
第二章:晶体分离法晶体分离法是一种常用的纯化技术,其原理是通过晶体的溶解度规律实现分离纯化目标产物。
通常使用的晶体分离方法包括溶剂结晶、蒸馏结晶和半块结晶法等。
溶剂结晶法适用于产物和溶剂溶解度差异较大的情况。
该方法具有操作简单、晶体生长速度快的特点。
但同时也存在晶体形态不规则、杂质难以去除等缺点。
蒸馏结晶法适用于产物和杂质的沸点相差较大的情况。
该方法具有高纯度、操作简单的特点。
但需要专业设备,且对操作人员要求较高。
半块结晶法是一种半固态的结晶方法,通过设置界面将溶剂与产物分离。
该方法具有产物纯度高、操作简单等优点,但需要专业的实验室仪器,并且需要对产物的溶解度曲线作出准确的预估。
第三章:萃取法萃取法是一种常用的化学分离方法,通过不同物质在不同溶剂中的溶解度差异实现目标物质的分离。
通常使用的萃取方法包括固相萃取、液-液萃取和超临界萃取等。
固相萃取法适用于目标物质在混合物中的含量较低的情况。
该方法具有操作简单、分离效果好等特点,但受取样量限制。
液-液萃取法是一种经典的分离技术,它利用产物在另一种溶剂中的特定溶解度实现目标物质的分离。
该方法适用于目标物质与其他成分的溶解度比较大的情况。
该方法出样方式简单,操作灵活。
超临界萃取法广泛应用于精细化工产品的制备中。
这种方法不仅可以实现产物的高效纯化,而且操作简单、反应快速,是一种高效、环保的新型萃取技术。
第四章:膜分离法膜分离法是一种具有高效性和低耗能特点的纯化技术,它通过半透膜的分离效应实现物质的分离。
化工原理(下)第4章液液萃取

组成在等腰直角三角形坐标图上的表示方法
二、各组分量之间的关系-杠杆规则
M = MA + MB
M A OB M B OA
MA
M
O 和点
MB
A
差点
B
差点
M A OB M AB M B OA M AB
杠杆规则
A
xS zS
液相 R r kg xA、xS、xB
液相 E e kg yA、yS、yB
用质量比 计算方便
YA K A X A
分 配 系 数
萃余相中溶 质的质量比
萃取相中溶 质的质量比
三、分配曲线
以xA为横坐标,yA为纵坐标,在直角坐标图上, 每一对共轭相可得一个点,将这些点联结起来,得 到曲线称为分配曲线。
溶解度曲线 分配曲线
y yx
P P
x
分配曲线的作法
第4章 液-液萃取
一、以质量分数表示的平衡方程
气液平衡方程 液液平衡方程
萃取相中 溶质分数
yA k A xA yA k A xA
分配 系数 萃余相中 溶质分数
yA kA xA
yB kB xB
二、以质量比表示的平衡方程
若 S与 B完全不互溶
萃取相中不含 B,S 的量不变
萃余相中不含 S ,B 的量不变 液液平衡方程
三角形坐标图
组成的表示方法
液-液萃取过程也是以相际的平衡为极限 三元体系难以用直角坐标系来表示 三元体系的相平衡关系用三角坐标图来表示 在三角形坐标图中常用质量百分率或质量分 率表示混合物的组成 少数采用体积分率或摩尔分率表示的 本教程中均采用质量百分率或质量分率
化工原理下4-1液液萃取(精)

液相E(萃取相) (S + A+微量B)
液相R(萃余相) (B + 微量A、S)
示例:用苯萃取分离醋酸和水混合物
2
二、萃取操作流程
萃取操作流程示意图
3
三、萃取过程的分类
1. 按有无化学反应分类
萃取
物理萃取√
化学萃取
2. 按萃取级数分类
萃取
单级萃取
多级萃取√
多级逆流萃取 多级并流萃取
4
三、萃取过程的分类
3. 按萃取技术分类
4. 按萃取组分数目分类
萃取
单溶剂萃取√
双溶剂萃取 膜萃取 超临界萃取 凝胶萃取 反向胶团萃取
萃取
单组分萃取 √
多组分萃取
5
四、萃取操作的应用
萃取操作应用场合:
①相对挥发度 = 1 物系的分离;
②溶质浓度很低 ,且为难挥发组分物系的分离; ③恒沸物系的分离; ④热敏性物系的分离。
17
由辅助曲线求联结线
E1
R1
E2
R2
两种溶解度曲线的互换
18
三、萃取平衡相图——溶解度曲线
2. 温度对溶解度曲线的影响
~ ~ 温度 T
溶解度
不互溶区
不利于萃 取操作
19
四、萃取过程在平衡相图上的表示
将定量的
纯溶剂 S 加入
y E
到A、B两组
分的原料液 F 中,该萃取过 程可在平衡相
F
ME
xR R
yE
图上表示。
xR
ቤተ መጻሕፍቲ ባይዱ20
五、萃取平衡方程
1.以质量分数表示的平衡方程
气液平衡方程 液液平衡方程
中药化学第四章中药化学成分的分离技术

K=CU/CL CU:上层浓度,CL:下层浓度。 若有两种成份时(A,B),则A,B各有其分
配系数KA,KB,则两者差别越大,分离效果越 好。
如,KA=10说明振摇一次平衡后,A则有90 %以上溶于上层溶液中。
而KB=0.l时,振摇一次平衡后,B则有90% 以上溶于下层中,过样A和B两成份就有较大程 度分离,连续分离萃取几次,就可能达到A,B 的全部分离。
仪器装置
该装置有3个部分组成。 输液部分。包括微型泵、移动相溶剂储槽和试样
液注射器。 萃取部分。由300~500根内径约2 mm、长度为
20~40 cm的萃取管连接而成。 收集检出部分。包括检出器及分步自动收集仪。
适用范围
目前DCCC法广泛用于皂苷、生物碱、酸性成分、蛋 白质、糖类等天然产物的分离和精制,特别是用于 皂苷类的分离,并取得良好效果。
三、铅盐沉淀法
原理 此法是利用中性醋酸铅和碱式醋酸铅在水和 稀醇溶液中能与许多天然药物化学成分生成 难溶性的铅盐或铅络合物沉淀的性质,使有 效成分和杂质分离。此法既可使杂质生成铅 盐沉淀除去,又可以使有效成分生成铅盐沉 淀。
铅盐沉淀法适用范围
中性醋酸盐(Pb(Ac)2)可用于沉淀天然药物成 分中的有机酸、蛋白质、氨基酸、黏液质、 鞣质、树脂、酸性皂苷、部分黄酮苷、蒽醌 苷、香豆素苷和某些色素等具有羧基、邻二 酚羟基的酸性或酚性物质。
氯仿:乙醚 由 某些苷类,如强心苷
乙酸乙酯
小 某些苷类,如黄酮苷
正丁醇
到 某些苷类,如皂苷,黄酮苷
丙酮、乙醇 大 极性很大的苷、糖类、氨基酸、某些生物
碱盐
水
蛋白质、黏液质、果胶、糖类、无机盐
(强亲水性)
二、适用范围
此法是早年研究天然药物有效成分的一种最重要的 方法,主要用于分离提纯含有极性不同的各种化 学成分的中药提取液。目前仍是最常用的方法,
化工原理(天大版)---(下册)第四章 萃取

选择性系数与kA、kB有关。 kA越大, kB越小,就越大, 说明:
A、B的分离也就越容易 凡是影响kA、kB的因素都影响(温度、组成) 若 =1,则萃取相和萃余相在脱除溶剂S后将具有相同的 组成,并且等于原料液的组成,故没有分离能力 萃取剂的选择性越高,对A的溶解能力就大,则一定的分离 任务,可越少萃取剂用量,降低回收溶剂操作的能耗,并且 可获得高纯度的产品A 当组分B、S完全不互溶时,则选择性系数趋于无穷大,这 是最理想的情况。
MF FN F ( xF xM ) (4 7) SF F xM y S MS NB
R'
B
(b)
S
EM
M ( xM x R ) 其中yE、xM、xR 由相图读出 y E xR R) 把4-6、4-7代入4-9得: E F ( xF x 其中xF、x' 'R、y''E由相图读出 y E x R R F E
表达了溶质在两个平衡液相中的分配关系。 A值愈大,萃取分离的效果 愈好 A值与联结线的斜率有关 不同的物系具有不同的分配系数 A值 同一物系, A值随温度和组成而变。 一定温度下,仅当溶质组成范围变化不大时, A值才可视为常数 Y KX 式中:Y——萃取相E中溶质A的质量比组成;
X ——萃余相R中溶质A的质量比组成; K——以质量比表示相组成时的分配系数
4.2.2 液-液相平衡关系
3、分配系数和分配曲线
分配曲线:若以xA为横坐标,以yA为纵坐标,则可在x-y直角坐标图上得到
表示互成平衡的一对共轭相组成的点N。将这些点联结起来即可得到曲线 ONP,称为分配曲线
曲线上的P点即为临界混溶点。 分配曲线表达了溶质A在互成平衡的E相与R相中的分配关系。若已知某液相组成, 则可由分配曲线求出其共轭相的组成。 若在分层区内y均大于x,即分配系数 A >1,则分配曲线位于y=x直线的上方,反 之则位于y=x直线的下方。 若随着溶质A组成的变化,联结线倾斜的方向发生改变,则分配曲线将与对角线出 现交点,这种物系称为等溶度体系
制药工艺学复习资料

第一章生物药物概述1、我国药物的三大药源指的是化学药物、生物药物、中草药。
2、现代生物药物已形成四大类型,包括基因工程药物、基因药物、天然生物药物、医学生物制品。
一、药物、生物药物、生物制品、药物:用于预防、治疗或诊断疾病或调节机体生理功能、促进机体康复保健的物质,有4大类:预防药、治疗药、诊断药和康复保健药。
生物药物:是利用生物体、生物组织、细胞或其成分,综合应用生物与医学、生物化学与分子生物学、微生物学与免疫学、物理化学与工程学和药学的原理与方法进行加工、制造而成的一大类预防、诊断、治疗和康复保健的制品。
生物制品:是应用普通的或以基因工程、细胞工程、蛋白质工程、发酵工程等生物技术获得的微生物、细胞与各种动物和人源的组织和液体等生物材料制备的,用于人类疾病预防、治疗和诊断的药品。
生化药物:指从生物体(动物、植物、和微生物中获得的天然存在的生化活性物质(或者合成、半合成的天然物质类似物)。
基因重组药物与基因药物有什么区别?基因重组药物:应用基因工程和蛋白质工程技术制造的重组活性多肽、蛋白质与其修饰物。
基因药物:以基因物质(RNA或DNA与其衍生物)作为治疗的物质基础,包括基因治疗用的重组目的DNA片段、重组疫苗、反义药物和核酶等。
生物药物有那些作用特点?药理学特性:1、活性强: 体内存在的天然活性物质。
2、治疗针对性强,基于生理生化机制。
3、毒副作用一般较少,营养价值高。
第二章生物制药工艺技术基础1、生化活性物质浓缩可采用的方法有盐析浓缩、有机溶剂沉淀浓缩、葡聚糖凝聚浓缩、聚乙二醇浓缩、超滤浓缩2、生化活性物质常用的干燥方法有喷雾干燥、冷冻干燥、、减压干燥等3、冷冻干燥是在低温、低压条件下,利用水的化学性能而进行的一种干燥方法。
4、固定化酶常采用的方法可分为吸附法、包埋法、共价结合法和交联法四大类1、由于目的蛋白质和杂蛋白分子量差别较大,拟根据分子量大小分离纯化并获得目的蛋白质,可采用( C )A、SDS凝胶电泳 B、盐析法 C、凝胶过滤 D、吸附层析2、分离纯化早期,由于提取液中成分复杂,目的物浓度稀,因而易采用( A ) A、分离量大分辨率低的方法 B、分离量小分辨率低的方法C、分离量小分辨率高的方法D、各种方法都试验一下,根据试验结果确定(重点)简述生物活性物质分离纯化的主要原理。
萃取
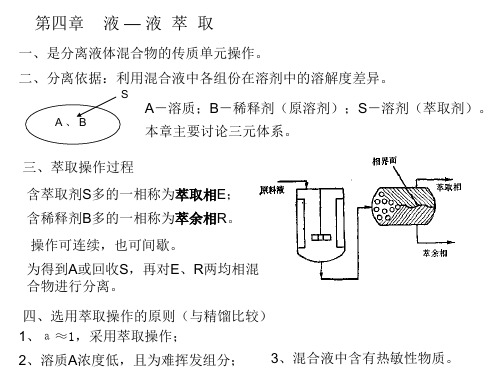
3、混合液中含有热敏性物质。
第一节
三元体系的液 - 液相平衡与萃取操作原理
4-1-1
组成在三角形相图上的表示方法
采用等边三角形、等腰直角三角形。 识图:
4-1-2 液 - 液相平衡关系在三角形相图上的表示 三元系统的三种情况: 1、 A
B
S
2、 A
B
部分互溶
3、 A
B
部分互溶
S
S
第Ⅰ类物系。 主要讨论此类物系。
一、溶解度曲线和联结线 设:第一类物系的第二种情况。 1、溶解度曲线 C′、D′、F′、G′、H′称混溶点(或分层 点)。 LCDFGHJ为实验温度下的溶解度曲线。 平衡时,两个液层称为共轭相。 联结共轭相组成坐标的直线称为联结线。 B
R L C D F D‘ ·· · C‘ F‘ G‘ H‘ A
第Ⅱ类物系。
5、作图
Y 分配曲线
E1 E2 E3 YS O X3 X2 X1 XF L X 斜率=-B/S
第n级:Yn= - B X n ( B X n -1 YS ) 操作线方程
S S
如此重复,直到xn≤规定值时为止。
操作线数目=理论级数。
4-2-3
多级逆流接触萃取的计算
1、多级逆流接触萃取流程
萃取剂循环使用(含有少量A和B), 最终R中可达到的最低xR受yS限制。 最终E中可达到的最高y1受xF限制。 2、已知F、xF、最终萃余相组成xn,S量和yS经济权衡选定,求理论级数。 一、组分B和S部分互溶时的图解计算法 1、在三角形坐标图上逐级图解法 图解步骤: 1)选S,确定T、P。根据平衡数据绘出溶解度曲线和辅助曲线。 2)据xF和yS定出F和S点,再由溶剂比S/F在FS连线上确定和点M。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
E 44.5
1/ 2 22 .25 1
若用1/4体积的醋酸丁酯进行二级错流萃取,则
理论收率
22.25 1 1 100 % 95.7% 22.25 1
1/ 4 E1 E 2 44.5 11.125 1
2 11.125 1 1 1 100% 99.32% 11.125 111.125 1
第四章 萃取法
2019/3/29
1
第一节 溶剂萃取法
广义的溶剂萃取法 (solvent extraction) 包括液 - 固萃取和液 液萃取:
液-固萃取又称浸取、浸提
液-液萃取指用一种溶剂(有 机溶剂)将目的产物从另一 种溶剂(如发酵液)中提取 出来的方法。
2019/3/29
2
溶剂萃取法优点: ①操作可连续化,速度快,生产周期短; ②对热敏物质破坏少;
若改用1/3体积丁醇萃取,
18 1 100 % 94 .7% 18 1
理论收率:
1/ 3 E 18 6 1
6 1 100 % 85.7% 6 1
2019/3/29
20
(二)多级错流萃取
2019/3/29
21
2019/3/29
22
萃余率:
1 n 100% E1 1E 2 1En 1
2019/3/29 14
(四)、分离因素
料液中的溶质并非是单一的组分,除了所需产物(A)外,还存在有 杂质(B)。分离因素(separation factor),常用表示,其定义为:在 同一萃取体系内两种溶质在同样条件下分配系数的比值
CA1 / CB1 KA β CA 2 / CB 2 KB
萃取相中溶质总量 M 1V 1 V1 E K表 萃余相中溶质总量 M 2V 2 V2
2019/3/29 12
萃取因素不是常数,与相比、萃取剂浓度、温度、 pH 、溶质在萃取 相和萃余相中的解离情况有关。
2019/3/29
13
萃取率
生产上用萃取率来表示一种萃取剂对某种溶质的萃取能力。
萃取相中溶质总量 n 100% 原始料液中溶质总量 M1V1 = 100% M1V1 +M 2 V2 E = 100% E+1
(一)单级萃取
2019/3/29
17
萃取因素E为
萃取相中溶质总量 C1VS VS 1 E K K 萃余相中溶质总量 C 2VF VF m
式中 VF——料液体积;Vs——萃取剂的体积;C1——溶质在萃取液 的浓度; C2——溶质在萃余相的浓度; K——表观分配系数; m——浓缩倍数
2019/3/29
2019/3/29
5
萃取一般指用有机溶剂将物质从水相转移到有机相的过程。
反萃取(stripping或back extraction)是将萃取液与反萃取剂(一般为水 溶液)相接触,使被萃入有机相的溶质转入水相的过程,可看作是 萃取的逆过程。
2019/3/29
7
(二)、分配定律
能斯特分配定律:在一定温度、一定压力下,某一溶质在互不相溶 的两种溶剂间分配时,达到平衡后,在两相中的活度之比为一常 数。如果是稀溶液,可以用浓度代替活度,即:
2019/3/29 15
二、溶剂萃取法的基本原理
抗生素在不同的pH条件下,可以有不同的化学状态,其分配系数 亦有差别,若适度改变pH,可将抗生素自水相转入有机相,或从 有机相再转入水相,这样反复萃取,可以达到浓缩和提纯的目的
AH
Ko
有机相 Kp
AH
2019/3/29
A + H+
水相
16
三、萃取方法和理论收率的计算
K 称为分配系数≈ K表
CL 萃取相浓度 K CR 萃余相浓度
2019/3/29
8
应用分配定律时,须符合下列条件: ①必须是稀溶液,即适用于接近理想溶液的萃取体系; ②溶质对溶剂的互溶度没有影响; ③溶质在两相中必须是同一分子形式,即不发生缔合或解离。
此时,分配系数为常数,与溶质总浓度、相比无关,只与溶质在有 机相中的溶解度有关。
2019/3/29
9
在实际萃取过程中,溶质的浓度比较大此时分配 在两相中的溶质只能用活度表示;溶质在两相 的分子形式常常并不相同,仍然采用类似分配 定律的公式作为基本公式。这时候溶质在萃取 相和萃余相中的浓度,实际上是以各种化学形 式进行分配的溶质总浓度,它们的比值以分配 比(distribution ratio)表示:
18
萃余率:
萃余液中溶质总量 1 100% 100% 原始料液中溶质总 100 % E 1 E 1
2019/3/29 19
例如: 洁霉素在20℃和pH10.0时表观分配系数(丁醇/水)为18。用等量 的丁醇萃取料液中的洁霉素,计算可得理论收率
CL CL1 CL2 CL3 CLn D K表 CR CR1 CR2 CR3 CRn
2019/3/29
10
D——分配比,不是常数:溶质浓度、萃余相酸碱度、萃取剂浓度、 温度……变化
2019/3/29
11
(三)、萃取因素
萃取因素也称萃取比,其定义为被萃取溶质进入萃取相的总量与 该溶质在萃余相中总量之比。通常以E表示。若以Vl和V2分别表示 萃取相和萃余相的体积,M1 和M2 分别表示溶质在萃取相和萃余 相中的平衡浓度。萃取因素(E)为:
③采用多级萃取时,溶质浓缩倍数大、纯化度高。
缺点: 由于有机溶剂使用量大,对设备和安全要求高,需要各项防火防爆 等措施。
2019/3/29
4
一、基本概念
(一)萃取与反萃取 被提取的溶液称为料液,其中欲提取的物质称溶质,而用以进行萃 取的溶剂称为萃取剂(extractant) 达到萃取平衡后,大部分溶质转移到萃取剂中,这种含有溶质的 萃取剂溶液称为萃取液,而被萃取出溶质以后的料液称为萃余液。
n
理论收率
E 1
1
n
100%
1 E 1 1 1 n 1 100% 100% n n E 1 E 1
n
2019/3/29 23
红霉素在 pH 9.8时的分配系数(醋酸丁酯 /水)为44.5,若用1/2体积 的醋酸丁酯进行单级萃取,则: 理论收率
