等效平衡高考题
2018年全国卷高考化学总复习《等效平衡》专题训练(含解析)

2018年全国卷高考化学总复习《等效平衡》专题训练选择题(每题有1-2个选项符合题意)1.在1L密闭容器中加入2molA和1molB,在一定温度下发生下列反应:2A(g)+B(g) 3C(g)+D(g),达到平衡时容器内D的百分含量为a%。
若保持容器体积和温度不变,分别通入下列几组物质达到平衡时容器内D的百分含量也为a%的是()A.3molC和1molD B.2molA、1molB和3molCC.4molC和1molD D.1.9molA、0.95molB、0.15molC和0.05molD2.在一个容积固定的密闭容器中充入,建立如下平衡:H2(g)+I2 (g) 2HI(g),测得HI的转化率为a%。
其他条件不变,在上述平衡体系中再充入1mol HI,待平衡建立时HI的转化率为b%,则a与b的关系为()A.a>b B.a<b C.a=b D.无法确定3.在恒温时,一固定容积的容器内发生如下反应:2NO 2(g)N2O4(g),达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数()A.不变B.增大C.减小D.无法判断4.恒温恒压条件下,可逆反应2SO 2+O22SO3在密闭容器中进行,起始时充入1mol SO3,达到平衡时,SO2的百分含量为ω%,若再充入1mol SO3,再次达到新的平衡时,SO2的的百分含量为()A.大于ω% B.小于ω% C.等于ω% D.无法确定5.在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g) C(g)+3D(g)现分别从两条途径建立平衡:I. A、B的起始量均为2mol;II. C、D的起始量分别为2mol 和6mol。
下列叙述不正确的是()A.I、II两途径最终达到平衡时,体系内混合气体的体积分数相同B.I、II两途径最终达到平衡时,体系内混合气体的体积分数不同C.达到平衡时,途径I的和途径II体系内混合气体平均相对分子质量相同D.达到平衡时,途径I的气体密度为途径II密度的1/26.一定温度下,将a mol PCl 5通往一容积不变的密闭容器中达如下平衡:PCl5(g)PCl3(g)+Cl2(g),此时平衡混合气体的压强为P1,再向容器中通入a mol PCl5,恒温下再度达到平衡后压强变为P2,则P1与P2的关系是()A.2P1=P2B.2P1>P2C.2P1<P2D.P1=2P2 7.在温度、容积相同的3个密闭容器,按不同方式投入反应物,保持恒温、恒容,测得反―1A .2c 1>c 3B .a +b =92.4C .2p 2<p 1D .α1+α3<18.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生反应:2CH 3OH(g)⇌CH 3OCH 3(g)+H 2O(g)下列说法正确的是( )A .该反应的正反应为放热反应B .达到平衡时,容器Ⅰ中的CH 3OH 体积分数比容器Ⅱ中的小C .容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长D .若起始时向容器Ⅰ中充入CH 3OH 0.15mol 、CH 3OCH 3 0.15mol 和H 2O 0.10mol ,则反应将向正反应方向进行 9.体积完全相同的两个容器A 和B ,已知A 装有SO 2和O 2各1 g ,B 装有SO 2和O 2各2 g ,在相同温度下反应达到平衡时A 中SO 2的转化率为a%,B 中SO 2的转化率为b%,则A 、B 两容器中SO 2转化率的关系正确的是( )A .a%>b%B .a%=b%C .a%<b%D .2a%=b% 【答案与解析】 一、选择题 1. 【答案】 AD【解析】此题属等效平衡中的第一种情况,T 、V 一定且m +n ≠p +q ,用“极限转换法”作出判断,将各选项中的物质的量换算成从正反应开始时A 和B 的物质的量。
等效平衡的三种情况-高考化学培优练习

等效平衡的三种情况一.等效平衡的三种情况1.恒温恒容—(△n(g)≠0) 投料换算成相同物质表示时量相同典例1.在恒温恒容的密闭容器,发生反应:3A(g)+B(g)x C(g)。
Ⅰ.将3mol A 和2 mol B在一定条件下反应,达平衡时C的体积分数为a;Ⅱ.若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是()A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大B.若向Ⅰ平衡体系中再加入3mol A和2mol B,C的体积分数若大于a,可断定x>4 C.若x=2,则Ⅱ体系起始物质的量应满足3n(B)>n(A)+3D.若Ⅱ体系起始物质的量满足3n(C)+8n(A)=12n(B),则可判断x=42.恒温恒容— (△n(g)=0)投料换算成相同物质表示时等比例典例2.某温度时,发生反应2HI(g)H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mol I2,分别达到平衡时,以下关系正确的是()A.平衡时,各容器的压强:②=①=③B.平衡时,I2的浓度:②>①>③C.平衡时,I2的体积分数:②=①=③D.从反应开始到达平衡的时间:①>②=③3.恒温恒压—投料换算成相同物质表示时等比例典例3.已知:T℃时,2H(g)+Y(g)2I(g) ΔH=-196.6 kJ·mol-1。
T℃时,在一压强恒定的密闭容器中,加入4mol H和2mol Y,反应达到平衡后,放出354 kJ的热量。
若在上面的平衡体系中,再加入1mol I气体,T℃时达到新的平衡,此时气体H的物质的量为( )A.0.8mol B.0.6mol C.0.5mol D.0.2mol二.对点增分集训1.在恒温恒压的密闭容器中投入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)2SO 3(g)。
等效平衡例题

0
0.5
2g-8m
1.5a (g-3m)a
7
[评注] 比较例2、例3的异同:例2为定T、 V情况下,反应前后气体分子数不变的可 逆反应的等效平衡问题;例3为定T、p情 况下,反应前后气体分子数改变的可逆反 应的等效平衡的问题,解答问题的方法完 全相同。对于例3若N2 、H2 、NH3的加入 量用x、y、z。(mo1)表示,不难导出,达 到等效平衡时,x、y、z应满足的一般条件 是:y=4x,z≥0(当x、y均大于0时,z才能 为0)
8
(3)a、b、c必须满足的一般条件是(请用两个方程式表
示,其中一个只含a和c,另一个只含b和c):
a +c=2
、 b +0.5c=1
。(全国高考题) 3
Ⅱ类:在定T、V情况下, 对于反应前后气体分子数 不变的可逆反应,只要反 应物(或生成物)的物质的 量的比例与原平衡相同, 则二平衡等效。
4
[例2] 在一个固定体积的密闭容器中,保持一定 温度进行以下反应:H2 (g)十 Br2 (g)
平衡状态。
现在该容器中维持温度不变,令a、b、c分别代表初始加
入的SO2 、O2和SO3的物质的量(mo1)。如a、b、c取不同 的数值,它们必须满足一定的相互关系,才能保证达到
平衡时,反应混合物中三种气体的体积分数仍跟上述平
衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c= 2 。
(2)若a=0.5,则b= 0.25 和C= 1.5 。
条件下,只改变起始加入情况,只要 通过可逆反应的化学计量数比换算成 平衡式左右两边同一边物质的物质的 量与原平衡相同,则二平衡等效。
2
例1: 在一定温度下,把2molSO2 和1mo1O2通人一个一
高中化学高考总复习《等效平衡》知识讲解及巩固练习题(含答案解析)
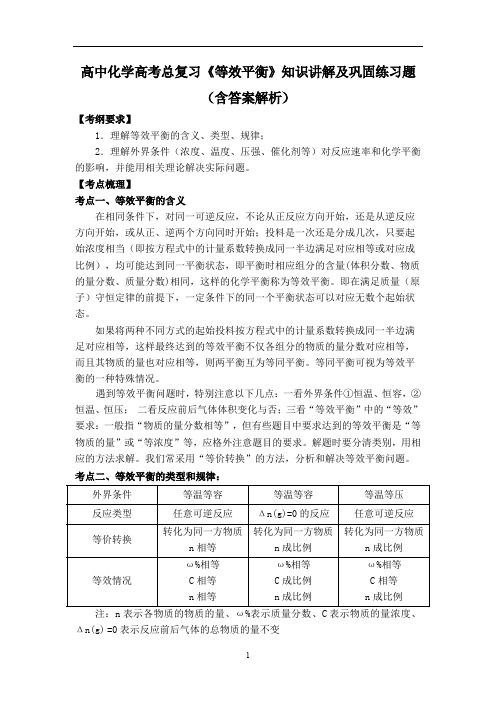
n 相等
n 成比例
n 成比例
ω%相等
ω%相等
ω%相等
等效情况
C 相等
C 成比例
C 相等
n 相等
n 成比例
n 成比例
注:n 表示各物质的物质的量、ω%表示质量分数、C 表示物质的量浓度、
Δn(g) =0 表示反应前后气体的总物质的量不变
1
要点诠释: 等效平衡的解题方法与技巧是:明确等效平衡的种类:一是恒温恒容下的等
【答案】 恒 压 恒
(2)
9
3a
(3)
0.4
1.2
x、y、z 取值必须满足的一般条件:(2 分)y=3x(x≥0);z
≥0
(x、y、z 不同时为
0)
(5)
2
5
(6) 0.75
0.5
容 x、y、z 取值必须满足的一般条件(一个只含 x、z,另一个只
含 y、z):(2 分)2x+z=2;
(2 分)2y+3z
达到平衡前 v(正)>v(逆) D.相同温度下,起始时向容器中充入 2.0molPCl3、2.0molCl2,达到平衡时,PCl3
的转化率小于 80%
【思路点拨】注意容器体积为 2.0L,所给数据为物质的量。
【答案】C
【解析】A.反应在前 50 s 内的平均速率应该是前 50 s 内 PCl3 浓度变化与时间的 比值,而不是 PCl3 物质的量的变化与时间的比值。 B.相同温度下,起始时向容器中充入 1.0molPCl5、0.20molPCl3 和 0.20molCl2 应
=6.
a 与 b 的关系是: a>b
类型二:恒温恒容下,对于反应前后气体体积没有变化的反应来说(即△V=0 的 体系):等价转化后,只要反应物(或生成物)的物质的量的比例与原平衡起 始态相同,两平衡等效。 例 2、在一个固定容积的密闭容器中,保持一定的温度进行以下反应:
等效平衡高考题

1已知:H2(g) + 12(g) =^2HI(g) A H v0。
有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。
欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是()A .甲、乙提高相同温度B .甲中加入0.1 mol He,乙不变C.甲降低温度,乙不变D.甲增加0.1 mol H2,乙增加0.1 mol I22 .向绝热恒容密闭容器中通入SO2和NO2,—定条件下使反应SQ(g) + NO2(g) SQ(g) + NO(g)达到平衡,正反应速率随时间变化的示意图如右图所示。
由图可得出的正确结论是(11年天津)A. 反应在c点达到平衡状态B. 反应物浓度:a点小于b点C. 反应物的总能量低于生成物的总能量匕十 ,D. A —=△ t2时,SO2的转化率:a~b段小于b~c段二〕.二:;3 .在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g) —2c(g) ;H K0x(g)+3y(g) L 2z(g);H2<0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误..的是A .等压时,通入惰性气体,c的物质的量不变B .等压时,通入z气体,反应器中温度升高C .等容时,通入惰性气体,各反应速率不变D .等容时,通入z气体,y的物质的量浓度增大4. 向某密闭容器中充入1molCO和2molH 20(g),发生反应:CO + H2O (g) 一^。
2+ H2。
当反应达到平衡时,CO的体积分数为X。
若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是A . 0.5molCO + 2molH 20(g) + 1molCO2 + 1molH 2B . 1molCO + 1molH 2O(g) + 1molCO 2 + 1molH 2C. 0.5molCO + 1.5molH 2O(g) + 0.4molCO 2+ 0.4molH 2D . 0.5molCO + 1.5molH 2O(g) + 0.5molCO 2+ 0.5molH 25. 在恒容密闭容器中存在下列平衡:CO(g) +H2O(g) ?_t CO2(g) + H2(g)。
高考化学等效平衡复习测试题

高考化学等效平衡复习测试题化学平衡---题型一:可逆反应在恒温恒容或恒温恒压条件下建立等效平衡的条件【例题1】在一个体积固定....的密闭容器中加入2 mol A和1 mol B,发生反应2A(g) + B(g)3C(g)+D(g),达到平衡时C的浓度为a mol·L-1。
若维持容器体积..和温度不变,按下列四种配比作为起始物质,达到平衡后,C 的浓度仍为a mol·L-1的是()A.4molA+2molB B.2molA+1molB+3molC+1molDC.3molC+1molD+1molB D.3molC+1molD【变式1】上题变为: 在一个体积可变....的密闭容器中﹍﹍若维持容器压强..和温度不变﹍﹍达到平衡后,C的浓度不是..a mol·L-1的是()【归纳】等效平衡:在一定条件(恒温恒容或恒温恒压)下,同一可逆反应从两种不同的起始状态开始反应,达到平衡后,若两种平衡体系中任何相同组分......的百分含量....(体积分数、物质的量分数等)均相等...,则两化学平衡互称为等效平衡。
【例题2】可逆反应A(g)+B(g)2C(g)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达到平衡时,C的浓度是amol·L-1,体积分数为m%;若向容器中充入1mol C,在同样的温度下达到平衡时,C的浓度是bmol·L-1,体积分数为n%,则m和n的关系是__________,a和b的关系是__________【归纳】等效平衡规律:对于可逆反应mA(g)+nB(g)pC(g)+qD(g),在两种不同起始状态下反应,达平衡后互为等效平衡的条件是:反应条件系数关系等效平衡条件若m+n≠p+q 极限转化后起始投料必须完全相同恒温恒容若m+n=p+q 极限转化后起始投料比相同(或投料完全相同)恒温恒压极限转化后起始投料比相同(或投料完全相同)【例题3】在一个盛有催化剂容积可变的密闭容器中,保持一定温度和压强,进行以下反应:N2+3H22NH3。
利用等效平衡解析一组高考题

( 者 单 位 : 南 省 范 县 一 中) 作 河
) 。
B. pl> P2 2 D. Pl= 2 p2
容器 中, 在一定温度和催化剂作用下 , 反应 达到平衡 ,
s 3 O3 o o 为 , l 时若 移走 05 o 2 .r l 2则 反 m 。此 .m l 和05n S , O oO 应达 到新 的平 衡 时 , 3 s 的物 质 的量 是 ( o
小 于 0 1t l .5 o。 o
) 。
B 均加 倍 .
C 均增加 1 o . o t|
答 案 :. 2 C 1 B .
D. 均减少 1 o o tl
例 2一 定 温 度 下 , a o C5 往 一 容 积 不 变 . 将 m l 1通 P 的密 闭容 器 中 达 如 下 平 衡 P l g— P l g + C5 ) ( C3 ) (
因此 , 建立 一个 等效 的中间平 衡体 系 ( 等效 平衡 ) 来 代替 已知 的平衡体 系 , 可使复 杂的问题 易于解决。
例 1将 lo O 和 lo 2 人一 体 积 不变 的密 闭 . ml 2 ml 通 S O
则 P 与 P 的关 系是 ( 2
A . pl= P2 2 C. pl< P2 2
和 C的物质的量分 别为 4 o、m l 4 o o t l2 o 和 m l 。物 中三 者的物 质 的量做
如下调 整 , 可使平衡右移 的是 (
A. 减半 均
物质 的量 应 为 0 1m l但 由于抽 走 了部 分 s 2 .5 o, o 和 0 , 当于减小 体积 压强 , 2相 平衡 左 移 , s 3的量 应 故 o
0. 5 1
C 小于 p . %
2020年高考化学专题强化:等效平衡选择题型
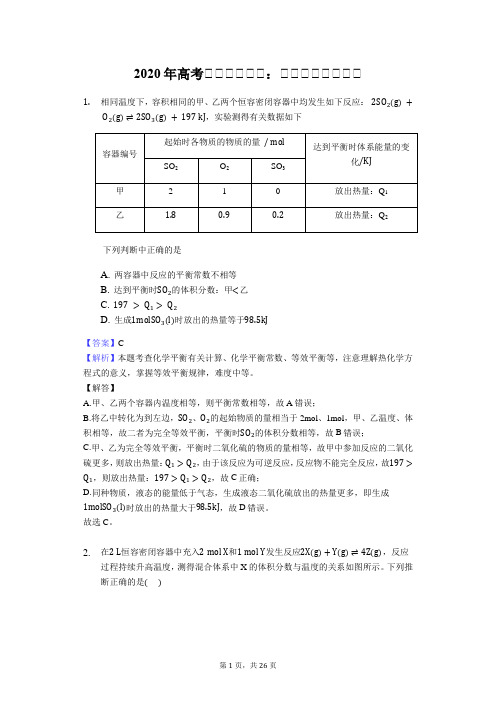
2020年高考化化化化化化:化化化化化化化化1.相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)+197kJ,实验测得有关数据如下下列判断中正确的是A. 两容器中反应的平衡常数不相等B. 达到平衡时SO2的体积分数:甲<乙C. 197>Q1>Q2D. 生成1molSO3(l)时放出的热量等于98.5kJ【答案】C【解析】本题考查化学平衡有关计算、化学平衡常数、等效平衡等,注意理解热化学方程式的意义,掌握等效平衡规律,难度中等。
【解答】A.甲、乙两个容器内温度相等,则平衡常数相等,故A错误;B.将乙中转化为到左边,SO2、O2的起始物质的量相当于2mol、1mol,甲、乙温度、体积相等,故二者为完全等效平衡,平衡时SO2的体积分数相等,故B错误;C.甲、乙为完全等效平衡,平衡时二氧化硫的物质的量相等,故甲中参加反应的二氧化硫更多,则放出热量:Q1>Q2,由于该反应为可逆反应,反应物不能完全反应,故197> Q1,则放出热量:197>Q1>Q2,故C正确;D.同种物质,液态的能量低于气态,生成液态二氧化硫放出的热量更多,即生成1molSO3(l)时放出的热量大于98.5kJ,故D错误。
故选C。
2.在2L恒容密闭容器中充入2mol X和1mol Y发生反应2X(g)+Y(g)⇌4Z(g),反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
下列推断正确的是()A. Q点时,Y的转化率最大B. W点X的正反应速率等于M点X的正反应速率C. 升高温度,平衡常数增大D. 平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大【答案】A【解析】【分析】本题考查化学平衡,为高频考点,把握温度对平衡移动的影响、等效平衡判定为解答的关键,侧重分析与应用能力的考查,注意图象的分析与平衡移动的结合,题目难度不大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.已知:H2(g)+I2(g)2HI(g)ΔH<0。
有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。
欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是()A.甲、乙提高相同温度B.甲中加入0.1 mol He,乙不变C.甲降低温度,乙不变D.甲增加0.1 mol H2,乙增加0.1 mol I22.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO 2(g) + NO2(g) SO3(g) + NO(g) 达到平衡,正反应速率随时间变化的示意图如右图所示。
由图可得出的正确结论是(11年天津)A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a~b段小于b~c段3.在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g) 2c(g);H1<0 x(g)+3y(g)2z(g);H2<0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误..的是A.等压时,通入惰性气体,c的物质的量不变B.等压时,通入z气体,反应器中温度升高C.等容时,通入惰性气体,各反应速率不变D.等容时,通入z气体,y的物质的量浓度增大4.向某密闭容器中充入1molCO和2molH 2O(g),发生反应:CO+H2O (g) CO2+H2。
当反应达到平衡时,CO的体积分数为x。
若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是A.0.5molCO+2molH2O(g)+1molCO2+1molH2B.1molCO+1molH2O(g)+1molCO2+1molH2C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH25.在恒容密闭容器中存在下列平衡:CO(g)+H 2O(g) CO2(g)+H2(g)。
CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。
下列说法错误的是() A.反应CO(g)+H 2O(g)CO2(g)+H2(g)的ΔH>0B.在T2时,若反应处于状态D,则一定有v正<v逆C.平衡状态A与C相比,平衡状态A的c(CO)大D.使用合适的催化剂能提高CO的转化率6.将1 mol SO2和1 mol O2通入容积固定的密闭容器中,在一定条件下反应达到平衡,平衡时SO3的物质的量为0.3 mol。
此时若移走0.5 mol SO2和0.5 mol O2,则反应达到新平衡时SO3的物质的量()A.为0.3 mol B.为0.15 molC.小于0.15 mol D.大于0.15 mol且小于0.3 mol7.在一定条件下,向两个容积固定且相同的密闭容器中分别充入一定量的PCl5(g)和NO 2(g),分别达到平衡(PCl5PCl3+Cl2,2NO2N2O4,均为气态)后,PCl5和NO2的转化率均为a%。
保持温度、容积不变,向两个容器中分别再充入1 mol PCl5和1 mol NO2,又达到平衡时PCl5和NO2的转化率分别为b%和c%,则下列关系中正确的是()A.b>a>c B.c>a>b C.a>b>c D.a=b=c8.(10·四川)反应a M(g)+b N(g)c P(g)+d Q(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。
其中z表示反应开始时N的物质的量与M的物质的量之比。
下列说法正确的是()A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加B.同压同z时,升高温度,平衡时Q的体积分数增加C.同温同z时,增加压强,平衡时Q的体积分数增加D.同温同压时,增加z,平衡时Q的体积分数增加9.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)t /min 2 4 7 9n(Y)/mol 0.12 0.11 0.10 0.10 下列说法正确的是A.反应前2min的平均速率v(Z) = 2.0×10-3mol/(L•min)B.其他条件不变,降低温度,反应达到新平衡前v(逆) > v(正)C.该温度下此反应的平衡常数K=1.44D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大10.已知可逆反应a A+b B c C中,物质的含量R%(A%和C%)随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动11.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。
工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:⑴煤的气化的主要化学反应方程式为:_______________________。
⑵煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________。
⑶利用水煤气合成二甲醚的三步反应如下:① 2H 2(g)+ CO(g)C H3O H(g)ΔH=-90.8 kJ·mol-1② 2CH 3OH(g)CH3OCH3(g)+ H2O(g) ΔH=-23.5 kJ·mol-1③ CO(g)+ H 2O(g)C O2(g)+ H2(g) ΔH=-41.3 kJ·mol-1总反应:3H 2(g)+ 3CO(g)CH3OCH3(g)+ C O2 (g)的ΔH=___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压b.加入催化剂c.减少C O2的浓度d.增加CO的浓度e.分离出二甲醚⑷已知反应②2CH 3OH(g)CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。
此温度下,在密闭容器中加入C H3O H,反应到某时刻测得各组分的浓度如下:物质C H3O H CH3OCH3H2O 浓度/(mol·L-1)0.44 0.6 0.6①比较此时正、逆反应速率的大小:v正______ v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(C H3O H) =_________;该时间内反应速率v(CH3OH) =__________。
12.在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L、c(C)=0mol/L。
反应物A的浓度随时间的变化如下图所示。
请回答下列问题:(1)与①比较,②和③分别仅改变一种反应条件。
所改变的条件和判断的理由是: ②_______________;__________________________________________________。
③_______________;__________________________________________________。
(2)实验②平衡时B 的转化率为_________;实验③平衡时C 的浓度为____________;(3)该反应的H _________0,判断其理由是________________________________;(4)该反应进行到4.0min 时的平均反应速度率:实验②:B v =______________________;实验③:C v =______________________。
13.可逆反应X(g)+2Y(g) 2Z(g) 、2M (g )N (g )+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。
反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是 A . 反应1的正反应是吸热反应B . 达平衡(I )时体系的压强与反应开始时体系的压强之比为14:15C . 达平衡(I )时,X 的转化率为D . 在平衡(I )和平衡(II )中M 的体积分数相等等效平衡题目1.相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N 2(g)+3H 2(g)2NH 3(g) ΔH =-92.6 kJ·mol -1。
实验测得起始、平衡时的有关数据如下表容器编号起始时各物质的物质的量/mol 达平衡时体系能量的变化 N 2 H 2 NH 3 ①1 3 0 放出热量:23.15 kJ ② 0.9 2.7 0.2 放出热量:Q 下列叙述错误的是( )A .容器①、②中反应的平衡常数相等B .平衡时,两个容器中NH 3的体积分数均为17C .容器②中达平衡时放出的热量Q =23.15 kJD .若容器①的体积为0.5 L ,则平衡时放出的热量小于23.15 kJ2.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反-1 容器甲 乙 丙 反应物投入量1 mol N 2、3 mol H2 2 mol NH34 mol NH 3 NH 3的浓度(mol·L -1)c l c 2 c 3 反应的能量变化放出a kJ 吸收b kJ 吸收c kJ 体系压强( Pa) p 1p 2 p 3反应物转化率α1α2α3下列说法正确的是A.2 c l> c3 B.a+b=92.4 C.2 p2< p 3 D.α1+α3 <13.2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)。
达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是()A.0.40 mol B.0.20 mol C.小于0.20 mol D.大于0.20 mol,小于0.40 mol4.某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K= 94。
该温度下在甲、乙、起始浓度甲乙丙c(H2)/mol·L-10.010 0.020 0.020c(CO2)/mol·L-10.010 0.010 0.020下列判断不正确的是( )A.平衡时,乙中CO2的转化率大于60% B.平衡时,甲中和丙中H2转化率均是60% C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢5.已知2SO 2 (g) + O2 (g) 2SO3 (g);ΔH=-197 kJ·m o l-1。
