西南科技大学基础有机化学习题答案整理
【西南●最新版】[0080]《高等有机化学》网上作业及课程考试复习资料(有答案)
![【西南●最新版】[0080]《高等有机化学》网上作业及课程考试复习资料(有答案)](https://img.taocdn.com/s3/m/36aba6c0a1c7aa00b52acbe1.png)
[0080]《高等有机化学》1[判断题]由等量互为对映体的化合物组成的混合物称为外消旋体。
参考答案:正确[判断题]开链烯烃的"Z/E命名”与"顺/反命名”的规则是一致的。
参考答案:错误[判断题]卤代烃发生消除反应符合Saytzeff规则,即得到取代基最多的烯烃参考答案:正确[判断题]季铵盐或锍盐消除反应符合Hofmann规则,即得到取代基较少的烯烃参考答案:正确[判断题]S N1历程形成平面结构的碳正离子中间体参考答案:正确[单选题]解释"场效应"A:是由于取代基的大小和形状引起分子中特殊的张力或阻力的一种效应。
B:由于原子或集团电负性的影响沿着分子中键传导,引起分子中电子云按一定方向转移或键的极性通过键链依次诱导传递的效应。
C:分子中原子之间相互影响的电子效应,不是通过键链而是通过空间传递的效应D:分子中原子或原子团相互联接的方式和次序。
参考答案:C[论述题]根据反应中键的断裂及形成方式不同,有机反应可分为三类,请分别写出每类的名称参考答案:<!--[if !supportLists]-->1.<!--[endif]-->自由基反应:反应中间体为自由基<!--[if !supportLists]-->2.<!--[endif]-->离子反应:反应中间体为碳正离子或碳负离子<!--[if !supportLists]-->3.<!--[endif]-->分子反应:有过渡态的反应<!--[endif]-->[单选题]解释"空间效应"A:由于原子或集团电负性的影响沿着分子中键传导,引起分子中电子云按一定方向转移或键的极性通过键链依次诱导传递的效应。
B:是由于取代基的大小和形状引起分子中特殊的张力或阻力的一种效应。
C:分子中原子之间相互影响的电子效应,不是通过键链而是通过空间传递的的效应。
基础有机化学习题答案

基础有机化学习题答案在基础有机化学的学习过程中,习题是检验学生对知识点掌握程度的重要手段。
以下是一些基础有机化学习题的答案示例:习题一:命名以下化合物1. CH₃CH₂CH₂OH- 答案:1-丙醇2. CH₃CH(CH₃)CH₂CH₃- 答案:2-甲基丁烷3. CH₃COOH- 答案:乙酸习题二:写出下列反应的化学方程式1. 乙醇与乙酸在浓硫酸催化下加热反应生成乙酸乙酯。
- 答案:CH₃CH₂OH + CH₃COOH → [浓硫酸] CH₃COOCH₂CH₃+ H₂O2. 苯与溴在铁催化下发生取代反应。
- 答案:C₆H₆ + Br₂ → Fe C₆H₅Br + HBr习题三:判断下列化合物是否具有芳香性,并说明理由1. 环戊二烯(C₅H₆)- 答案:不具有芳香性。
因为环戊二烯的碳原子上只有4个π电子,不符合4n+2规则(Hückel规则)。
2. 苯(C₆H₆)- 答案:具有芳香性。
苯的碳原子上共有6个π电子,符合4n+2规则,具有特殊的稳定性。
习题四:写出下列化合物的IUPAC名称1. CH₃CH₂CH₂CH₂Br- 答案:1-溴丁烷2. CH₃CH(OH)CH₂CH₃- 答案:2-丁醇习题五:判断下列化合物的立体化学1. CH₃CHBrCH₂Br- 答案:如果Br原子连接在同一个碳原子上,该化合物具有顺式立体化学;如果Br原子连接在不同的碳原子上,该化合物具有反式立体化学。
2. CH₃CH₂CH₂CH₂CH₃- 答案:该化合物是直链烷烃,没有立体中心,因此没有立体化学。
请注意,以上习题答案仅作为示例,实际习题的答案可能因题目的具体内容而有所不同。
在解答有机化学习题时,应仔细阅读题目要求,运用所学的有机化学知识进行分析和解答。
《基础化学》课后习题参考答案(有机部分)
均为 Na + , K + , Br , Cl 离子各 1mol 。
第十章开链烃1、扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答:2、NaCl 相同?如将 CH 4 及 CCl 4 各 1mol 混在一起,与 CHCl 3 及 CH 3Cl 各 1mol 的混合物是否相同? 为什么?答: NaCl 与 KBr 各 1mol 与 NaBr 及 KCl 各 1mol 溶于水中所得溶液相同。
因为两者溶液中 - -由于 CH 4 与 CCl 4 及 CHCl 3 与 CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合 物。
3、用系统命名法命名下列化合物:⑴2-甲基丙烷⑵2,4,4-三甲基-5-丁基壬烷⑶己烷⑷3-乙基戊烷⑸3-甲基-5-异丙基辛烷⑹2-甲基-5-乙基庚烷4、写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。
H 3CCH 3 ⑴3,3-二甲基丁烷 H 3CH 2CH 3H 3C错,2,2-二甲基丁烷CH 2CH 3 ⑵2,3-二甲基-2-乙基丁烷 H 3C HC C3错,2,3,3-三甲基戊烷CH 3CH 3⑶2-叔丁基-4,5-二甲基己烷H 3CC CH 3CH 33错,2,2,3,5,6-五甲基庚烷H 3CC H 2CH 3CH 3H 3CCH⑷2,3-二甲基-4-丙基庚烷H 3H CH 2 CC H 2CH 3CH 2CH 2CH 3H 3CH 3CCH 2CH 3H 2⑸2,4,5,5-四甲基-4-乙基庚烷H 3CHC H 2 CH 3CC C 3 32 CH32CH2 3CH 2 3CH 3 3CH 3 2CH 3⑹2,2,3-三甲基戊烷H3CH3CCCH3CH2CH35、写出分子式为C6H14的烷烃的各种异构体,用系统命名法命名,丙标出伯、仲、叔、季碳原子。
1oCH 32oCH 2 2 o22 oCH2 oCH 21 o己烷1oCH 3oCH 21 o CH32 o CHo1 oCH32-甲基戊烷1 o CH31oCH 32ooCH2 oCH2 1 oCH3 3-甲基戊烷1oCHo3 oCH1 o3 2,3-二甲基丁烷1 o CH31 o1 o CH31oCH2o4 oCCH32,2-二甲基丁烷H3C 1 o 1 o CH36、⑶>⑵>⑸>⑴>⑷7、写出2,2,4-三甲基戊烷进行氯代反应可能得到的一氯代产物的结构式。
西南科技大学基础有机化学习题参考答案整理

1 绪论习题参考答案1. 从教材中可以找到下列术语的答案2. HCl、CH3OH、CH2Cl2和CH3OCH3为极性分子;Cl2和CCl4为非极性分子。
3. 参照表1-7 ,可以写出下列化合物的Lewis结构式4.亲核试剂:Cl-,-CH3;亲电试剂:AlCl3,C2H4,CH4,ZnCl2,BF3,CH3CN,Ag+,H+,Br+,Fe+,+NO2,+CH3;既是亲核试剂又是亲电试剂:H2O,CH3OH,HCHO。
5.属于酸的化合物:HBr,NH4+;属于碱的化合物:CN-;既是酸又是碱的化合物:NH3,HS-,H2O,HCO3-6. 按照碳骨架分类,芳香族化合物为:(1)(2)(3)(4);脂环(族)化合物为:(5)(6);开链化合物为:(7)(8)。
按照官能团分类,羧酸:(2)(3)(6)(7);醇:(1)(5)(8);酚:(4)。
7.按照碳骨架分类,除了(2)和(5)之外都属于不饱和化合物。
属于哪一族?(略)2 烷烃习题参考答案1 (1)1°1°1°1°2°2°2°3°3°2-甲基-3-乙基己烷(2)1°1°1°1°2°2°2°3°3°2°3-甲基-5-乙基庚烷(3)1°1°1°1°1°2°2°2°2°2°3°4°3,6-二甲基-3-乙基辛烷(4)1°1°1°1°1°1°2°2°2°2°2°3°3°3°3°3,5-二甲基-6-异丙基癸烷(5) 2,3,5,5,7-五甲基辛烷(6) 2,4,4-三甲基-5-乙基辛烷(7) 2,7-二甲基-7-乙基壬烷(8) 2,11,14-三甲基-7-乙基十六烷2 (1)(2)(3)(4)(5)CHCH3CH3H3C(6)3 解:烷烃分子间的作用力主要是色散力,随着分子质量增加,色散力增大,使沸点升高。
有机化学_习题集(含答案)

《有机化学》课程习题集西南科技大学成人、网络教育学院所有习题【说明】:本课程《有机化学》(编号为10002)共有单选题, 填空题,命名或写构造式,鉴别化合物,合成化合物,推测化合物的结构等多种试题类型,其中,本习题集中有[ 填空题]等试题类型未进入。
一、单选题1.某纯(-)-化合物M的[α]D25=-25°,若将M的(+)-化合物与M的(-)-化合物以物质的量比3﹕1混合后,所得混合物的比旋光度为()A、0°B、+50°C、+25°D、-25°2.化合物CH3CH=CHCH2CH(NH2)CH2CH3的手性碳为S构型,该化合物的立体异构体数目为:( )A、2个B、4个C、6个D、8个3. 2个苯环共用2个碳原子而形成的双环化合物属于()A、多苯代脂肪烃B、桥环烃C、稠环芳烃D、联苯类化合物4.下列化合物中无顺反异构体的是()A、2-丁烯B、2-氯-2-丁烯C、2-戊烯D、3-乙基-2-戊烯5.环丙烷具有下列哪种性质?()A、有力,难发生开环加成B、无力,易发生开环加成C、有力,易发生开环加成D、无力,难发生开环加成6.邻氯苯胺发生苯环上的亲电取代反应,新基团主要进入()A、氯原子的邻或对位B、氯原子的邻或间位C、氨基的邻或对位D、氨基的间或对位7.下列化合物酸性最强的为()A、CH2OHB、CH3CH2OHC、OHD、OHNO28.蒸馏乙醚前应检验是否含有()A、过氧化物B、碘化钾C、硫酸亚铁D、亚硫酸钠9.能被斐林试剂氧化的化合物为()A 、CH 3COCH 3B 、OC 、CHOD 、CH 3COCH 2CH 3 10. 下列化合物最易发生水解的为( )A 、(CH 3CO)2OB 、CH 3COClC 、CH 3COOC 2H 5D 、CH 3CONH 2 11. 醛、酮分子中羰基碳、氧原子的杂化状态是( )A. spB. sp 2C. sp 3D. sp 2和sp 3 12. (CH 3)2CHCH 2CH(CH 3)2的一氯代产物有( )A. 1种B. 2种C. 3种D. 4种13. 氯乙烯分子中存在的共轭体系是( )A. p-π共轭B. π-π共轭C. σ-π超共轭D. σ-p 超共轭14. 下列分子中有sp 2杂化碳原子的是( )A. CH 3CH 2CH 3B. (CH 3)2C =CH 2C. (CH 3)3CCH 2OCH 2CH 3D. CH≡CH 15. 关于化合物具有芳香性的正确叙述是( )A. 易加成难取代B. 易取代难加成C. 具有芳香味D. π电子数要满 16. 化合物CH 3CH =CHCH 2CHOHCHOHCH 3的构型异构体的数目是( )A. 4种B. 8种C. 16种D. 32种17. 下列化合物能被氧化生成正丁酸的是( )A. CH 3COCH 2CH 3B. CH 3CH 2CH 2CHOC. CH 3CH 2CHOHCH 3D. CH 3CH 2CH=CH 2 18. 在下列化合物中,与金属钠反应最快的是( )A. 2-丁醇B. 2-甲基乙醇C. 乙醇D. 叔丁醇19. 下列化合物中最易发生脱羧反应的是( )A. 环己烷羧酸B. 2,2-二甲基丙酸C. 3-丁酮酸D. 3-羟基丁酸20. 室温下与HNO 2反应放出N 2的是( )A. HOCH 2CH 2NHCH 3B. CH 3NHCH 2CH 2NHCH 3C. N,N-二甲基苯胺D. 叔丁基胺 21. 下列化合物能发生羟醛缩合反应的是( )A. 叔戊醛B. 甲醛C. 苯甲醛D. 1-丙醛22. 下列化合物中不能与饱和NaHSO 3溶液生成白色沉淀的是( )A. CH 3CH 2COCH 2CH 3B. CH 3COCH 2CH 3C. C 6H 5CHOD. CH 3CH 2CH 2CH 2CHO 23. 下列碳正离子中最稳定的是( )A. CH 2CH 2+(CH 3)2B. CHCH 3+CH (CH 3)2C. C 2H 5+C (CH 3)2D. CH +C 6H 5C 6H 5 24. 下列化合物能发生碘仿反应的是( )A. CH 3CH 2COCH 3B. O (CH 3CH 2)2CC. CHOD. (CH 3)3COH 25. 下列羰基化合物对NaHSO 3加成反应速率由快到慢的顺序为( )1.苯乙酮2.苯甲醛3.2-氯乙醛4.乙醛A. 1234B. 1243C. 4321D. 342126. 下列化合物不可形成分子氢键是( )A..NO 2OH b.NO 2OH CH 3COCH 2CHCH 3OH c. d.OH OB. a.NO 2OH b.NO 2OH CH 3COCH 2CHCH 3OH c. d.OH OC.a.NO 2OHb.NO 2OH CH 3COCH 2CHCH 3OHc.d.OH OD. NO 2OH b.NO 2OH CH 3COCH 2CHCH 3OH c. d.OH O 27. 下列各对化合物属于官能团异构的是( )A.CH 3CH 2CH 2CH 3与(CH 3)2CH 2CH 3B. CH 3CH 2CH 2OH 与CH 3CHOHCH 3C.CH 3CH 2CHO 与CH 3CH =CHOHD. CH 3CH 2CH 2OH 与CH 3CH 2OCH 3 28. 下列烷烃中沸点最低的是( )A. 新戊烷B. 异戊烷C. 正己烷D. 正辛烷29. 下列化合物具有旋光性的是( )A. COOH COOHBr Br HO HO B. C CH 3H 3C H H C C C. D. Cl H 3C H 3C F 30. 分子具有手性的一般判据是分子中不具有( )A. 对称轴B. 对称面C. 对称中心D. 对称面和对称中心 31. 叔丁基正碳离子比异丙基正碳离子稳定,可用于解释的理论是( )。
基础有机化学试题及答案

基础有机化学试题及答案一、选择题(每题2分,共20分)1. 下列化合物中,哪一个是芳香烃?A. 甲烷B. 乙炔C. 苯D. 环己烷答案:C2. 哪个官能团是醇类化合物的特征?A. 羧基B. 羟基C. 酯基D. 酮基答案:B3. 下列哪种反应不是取代反应?A. 卤代反应B. 酯化反应C. 酯的水解D. 硝化反应答案:C4. 以下化合物中,哪一个是烯烃?A. 甲烷B. 乙醇C. 丙烯D. 丙酮答案:C5. 醇的氧化反应中,通常需要哪种催化剂?A. 酸B. 碱C. 金属氧化物D. 金属答案:C6. 以下化合物中,哪一个是酮?A. 乙酸B. 丙酮C. 乙醇D. 丙烯酸答案:B7. 以下哪种反应是加成反应?A. 酯化反应B. 卤代反应C. 水解反应D. 聚合反应答案:B8. 以下化合物中,哪一个是醛?A. 甲醛B. 乙酸C. 乙醛D. 丙酮答案:C9. 以下哪种反应是消除反应?A. 酯化反应B. 卤代反应C. 酯的水解D. 醇的脱水反应答案:D10. 以下化合物中,哪一个是羧酸?A. 乙酸B. 乙醇C. 丙酮D. 丙烯酸答案:A二、填空题(每题2分,共20分)1. 芳香烃的特点是具有一个或多个_____。
答案:苯环2. 醇类化合物的官能团是_____。
答案:羟基3. 取代反应是指一个原子或原子团被另一个原子或原子团所_____。
答案:取代4. 烯烃是含有_____的碳氢化合物。
答案:碳碳双键5. 醇的氧化反应通常需要_____作为催化剂。
答案:金属氧化物6. 酮类化合物的官能团是_____。
答案:羰基7. 加成反应是指两个或多个分子结合形成一个新的分子,同时没有原子或原子团被_____。
答案:取代8. 醛类化合物的官能团是_____。
答案:醛基9. 消除反应是指从分子中移除一个或多个原子或原子团,形成一个新的不饱和化合物的过程,通常发生在_____化合物中。
答案:醇10. 羧酸类化合物的官能团是_____。
基础有机化学习题答案

基础有机化学习题答案基础有机化学习题答案有机化学是化学中的一个重要分支,研究有机物的结构、性质和反应机理。
对于学习有机化学的学生来说,解答习题是非常重要的一部分,可以帮助巩固知识、提高解题能力。
本文将为大家提供一些基础有机化学习题的答案,希望能对大家的学习有所帮助。
1. 下列化合物中,哪一个是醇?A. 乙酸B. 乙醛C. 乙醇D. 乙酸乙酯答案:C. 乙醇。
醇是一类含有羟基(-OH)的有机化合物,乙醇就是一种醇。
2. 下列化合物中,哪一个是醛?A. 甲酸B. 乙醇C. 乙酸D. 丙酮答案:A. 甲酸。
醛是一类含有羰基(C=O)的有机化合物,甲酸就是一种醛。
3. 下列化合物中,哪一个是酮?A. 甲酸B. 乙醇C. 乙酮D. 丙酮答案:C. 乙酮。
酮是一类含有羰基(C=O)的有机化合物,乙酮就是一种酮。
4. 下列化合物中,哪一个是酸?A. 甲酸B. 乙醇C. 乙酮D. 丙酮答案:A. 甲酸。
酸是指能够释放出H+离子的化合物,甲酸是一种酸。
5. 下列化合物中,哪一个是酯?A. 甲酸B. 乙醇C. 乙酮D. 乙酸乙酯答案:D. 乙酸乙酯。
酯是一类含有酯基(-COO-)的有机化合物,乙酸乙酯就是一种酯。
6. 下列化合物中,哪一个是醚?A. 甲酸B. 乙醇C. 乙酮D. 乙醚答案:D. 乙醚。
醚是一类含有氧原子连接两个烃基的有机化合物,乙醚就是一种醚。
7. 下列化合物中,哪一个是胺?A. 甲酸B. 乙醇C. 乙酮D. 乙胺答案:D. 乙胺。
胺是一类含有氨基(-NH2)的有机化合物,乙胺就是一种胺。
8. 下列化合物中,哪一个是酸酐?A. 甲酸B. 乙醇C. 乙酮D. 乙酸酐答案:D. 乙酸酐。
酸酐是指由酸中的羧基(-COOH)失去一个水分子形成的化合物,乙酸酐就是一种酸酐。
9. 下列化合物中,哪一个是酸酐?A. 甲酸B. 乙醇C. 乙酮D. 乙酸答案:D. 乙酸。
乙酸是一种酸,不是酸酐。
10. 下列化合物中,哪一个是酸酐?A. 甲酸B. 乙醇C. 乙酮D. 乙酸乙酯答案:D. 乙酸乙酯。
《基础化学》课后习题参考答案(无机部分)
⑵
-2
⑶
-4
⑺ 1.1×10
1
⑻ 5.0×10-15
+
5.0×10
6.3×10
1.8×10
-5
1.1×10
-11
6.3×10
-8
1.0
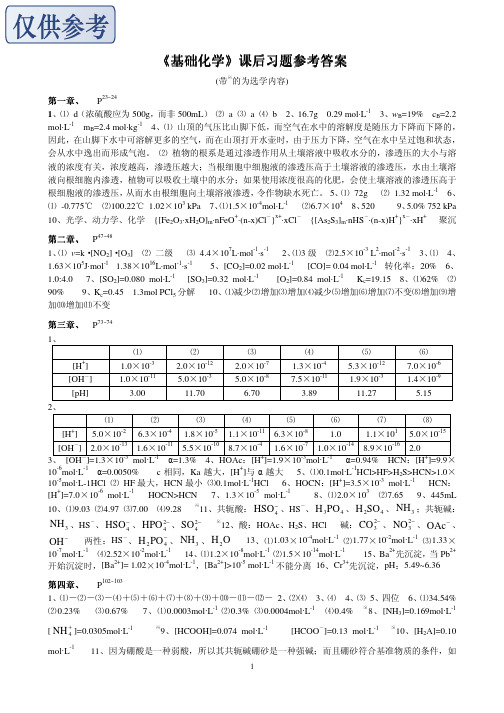
[OH ] 2.0×10-13 1.6×10-11 5.5×10-10 8.7×10-4 1.6×10-7 1.0×10-14 8.9×10-16 2.0 3、 [OH-]=1.3×10-3 mol·L-1 α=1.3% 4、HOAc:[H+]=1.9×10-3mol·L-1 α=0.94% HCN:[H+]=9.9× -6 -1 + 10 mol·L α=0.0050% c 相同,Ka 越大,[H ]与 α 越大 5、⑴0.1mol·L-1HCl>HF>H2S>HCN>1.0× 10-5mol·L-1HCl ⑵ HF 最大,HCN 最小 ⑶0.1mol·L-1HCl 6、HOCN:[H+]=3.5×10-3 mol·L-1 HCN: + -6 -1 -5 -1 3 [H ]=7.0×10 mol·L HOCN>HCN 7、1.3×10 mol·L 8、⑴2.0×10 ⑵7.65 9、445mL 10、⑴9.03 ⑵4.97 ⑶7.00 ⑷9.28
2
1 ⑷m = 0 2
5、 n ≥ 3 、 l = 0,1 、 l = 0 、 m = 0 、 m s = ±
2
1 2
2s
n 2 2
m 0 0
ms +1/2 -1/2
2p3
※
2 2 2
1 1 1
0 +1 -1
+1/2 +1/2 +1/2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 绪论习题参考答案1. 从教材中可以找到下列术语的答案2. HCl、CH3OH、CH2Cl2和CH3OCH3为极性分子;Cl2和CCl4为非极性分子。
3. 参照表1-7 ,可以写出下列化合物的Lewis结构式4.亲核试剂:Cl-,-CH3;亲电试剂:AlCl3,C2H4,CH4,ZnCl2,BF3,CH3CN,Ag+,H+,Br+,Fe+,+NO2,+CH3;既是亲核试剂又是亲电试剂:H2O,CH3OH,HCHO。
5.属于酸的化合物:HBr,NH4+;属于碱的化合物:CN-;既是酸又是碱的化合物:NH3,HS-,H2O,HCO3-6. 按照碳骨架分类,芳香族化合物为:(1)(2)(3)(4);脂环(族)化合物为:(5)(6);开链化合物为:(7)(8)。
按照官能团分类,羧酸:(2)(3)(6)(7);醇:(1)(5)(8);酚:(4)。
7.按照碳骨架分类,除了(2)和(5)之外都属于不饱和化合物。
属于哪一族?(略)2 烷烃习题参考答案1 (1)1°1°1°1°2°2°2°3°3°2-甲基-3-乙基己烷(2)1°1°1°1°2°2°2°3°3°2°3-甲基-5-乙基庚烷(3)1°1°1°1°1°2°2°2°2°2°3°4°3,6-二甲基-3-乙基辛烷(4)1°1°1°1°1°1°2°2°2°2°2°3°3°3°3°3,5-二甲基-6-异丙基癸烷(5) 2,3,5,5,7-五甲基辛烷(6) 2,4,4-三甲基-5-乙基辛烷(7) 2,7-二甲基-7-乙基壬烷(8) 2,11,14-三甲基-7-乙基十六烷2 (1)(2)(3)(4)(5)CHCH3CH3H3C(6)3 解:烷烃分子间的作用力主要是色散力,随着分子质量增加,色散力增大,使沸点升高。
各异构体中,一般是直链烷烃的沸点最高,支链愈多沸点愈低。
故沸点:正癸烷>正庚烷>正己烷>2-甲基戊烷>2,3-二甲基丁烷4解:含单电子的碳上连接的烷基越多,自由基越稳定,自由基越稳定则形成产物的机会越多。
自由基的稳定性次序为:·C(CH3)3>·CH(CH3)2>·CH2CH3>·CH35解:C n H2n+2 = 72,所以n = 5。
该烷烃的构造式为:CH3CHCH2CH3CH36(1)正己烷Cl ClClCH2CH2CH2CH2CH2CH3CH3CHCH2CH2CH2CH3CH3CH2CHCH2CH2CH3(2)2-甲基戊烷(3)2,2-二甲基丁烷CH3CH3CH3CH2CCH2CH3CH2CCHCH3CH3CCH2CH2 Cl Cl Cl CH3CH3CH37解:8 解:四种典型构象中分子内能最低的是对位交叉式(a),因为它的两个大基团(CH3-和Cl-)相距最远,扭转张力最小;分子内能最高的是全重叠式(d)为它的两个大基团相距最近,扭转张力最大;其他两种构象的内能处于上述两种构象之间,但部分重叠式(b)的扭转张力大于邻位交叉式(c)。
因此,这四种构象的稳定性顺序是a>c>b>d。
3 脂环烃习题参考答案1、(1)反-1,3-二甲基环己烷(2)2-甲基-5-环丙基庚烷(3)2-甲基-8-氯二环[3.2.1]辛烷(4)7,7-二甲基-2-氯二环[2.2.1]庚烷(5)1,4-二甲基-7-溴螺[2.4]庚烷(6)1,6-二甲基-8-乙基螺[3.5]壬烷(7)(8)2、3、(1)顺式ea (2)反式ee (3)顺式ea (4)反式ea4、(1)(CH3)3C CH(CH 3)2CH3CH3A B(CH3)3CCH 3(2)C(3)(4)C(CH3)3Cl(5) D A (6) C (7) C (8) C(9) 答:在环己烷的椅式构象中与分子的对称轴平行的C-H键,叫做直立键或a键。
与直立键形成接近109.5°的夹角,平伏着向环外伸展的C-H键,叫做平伏键或e键。
5(1)(2)(3) (4)(5)6、答:加溴的四氯化碳溶液不褪色的是(2),剩下的加高锰酸钾溶液,不褪色的是(1)。
7、(1)(2)(3)4 电子效应习题参考答案1 极性分子有(3)和(4),非极性分子有 (1)和(2)。
2 按照给电子诱导效应的大小排列为(3)>(1)>(4)>(2)。
3 (1)当氯原子取代乙酸的α-H 后,生成氯乙酸,由于氯的吸电子作用通过碳链传递,使羟基中O -H 键极性增大,氢更易以质子形式解离下去,从而酸性增强。
即:Cl CH 2COOH,所以ClCH 2COOH 的酸性强于CH 3COOH的酸性。
(2)这是因为烯烃发生亲电加成时,形成的碳正离子的稳定性顺序为CH 3+<CH 3C +H 2<(CH 3)2C +H<(CH 3)3C +,所以烯烃的亲电加成具有如此的活性顺序。
4 体系的共轭效应的大小为(3)>(1)>(2)。
5 烯烃习题参考答案1. (1)(Z)-2,4-二甲基-3-乙基-3-己烯 (2) (E)-3,5-二甲基-2-己烯 (3)(E)-4-甲基-3-庚烯 (4) 反-3,4-二甲基环丁烯 (5)(Z)-3-甲基-4-乙基-3-庚烯 (6) 3-乙基-1-戊烯 (7)(E)-3-乙基-2-溴-2-己烯 (8) 3,4-二甲基环己烯2. (1)CH 3CH=CH- (2)CH 2=CHCH 2- (3)CH 2=C(CH 3)- (4)(5)CH 3C CH(CH 3)2CH 3HC(6)CH(CH 3)2(7)CH 2CH 2CH 3H H 3C C CH 3C (8)(CH 3)2C=C(CH 3)CH(CH 3)2 (9)(10)CH 2CH 2CH 3H H 3C C C(CH 3)3CH 2C3.(1)(1)(2)CHCH 3H 2OH 2SO 4C (CH 3)2CH 2CH 3C (CH 3)2OH (2)(3)(4)(5)℃Br 2300 (6)(1)(2)CH 2H 2O 2CH 2CH Hg(OAc)2CHOH CH 2CH 3(7)(1)(2)CH 2H 2O 2CH 2CH OHB 2H 6(8)KMnO 4OHOH OH(9)H +KMnO 4C 2H 5C 2H 5CH=CH COOH 2CH 2CH 3 (10)(11)H +KMnO 4C 2H 5COOH C OC 2H 5(CH 2)3 (12)H 2O 2+O s O 4OHOH(13)CH 2OH(14)(15)(16)Br 2+CCl 4(17)H 2OCH 3+CH 3O s O 4NaHSO 3(18) HIF 3C +CH=CH 2CH 2CH 2I F 3C(19) CH 2CH 2H 2O 2OHB 2H 6CH 2CH 2HO OH (20) CH 2H +I +Cl C (CH 3)2 CH 2(CH 3)2CH ICl 4.(1)C >B >D >A (2)A D (3) C (4) D (5)D >A >B >C(6) B (7) A C (8) D >A >C >B (9) C >D >B >A (10)B>C>A5.(1)答: 在室温氯气与烯烃加成是亲电加成,氯气分子在Π电子的诱导下发生极化,成为亲电试剂,与双键发生亲电加成反应。
在高温时氯气分子易于生成氯自由基,然后氯自由基进攻比较活泼的α-H 原子发生α-H 原子的取代反应。
(2)解:三氟甲基是强吸电子基,存在强的– I 效应。
使Π电子云向三氟甲基方向偏移,即CF 3CH δ– =CH 2δ+,因此氢原子加在链中双键碳原子上;而连在双键碳上的甲氧基存在强的+C 、弱的–I 效应,使Π电子云向远离甲氧基方向偏移即CH 3OCH δ+=CH 2δ–,因此氢原子加在链端双键碳原子上。
(3) A 发生碳正离子重排。
第一步得到的碳正离子已是叔碳正离子,但分子中有五元环。
重排时,碳正离子α-位环戊基的一条键带一对电子移到碳正离子上,生成六员环(1,2-迁移,碳正离子是1-位,2-位基团迁到1-位上)。
B 解:(4)答:用浓硫酸洗涤,烯烃溶于浓硫酸中而烷烃不溶,进行相分离,上层即为不含烯烃的裂化汽油。
6(1)(2)CH 2HBrH 2SO 4CH 3CH 2CH 3BrCH 3CH CH=CH 2OH CH 3ROOR 浓(3)H 2O 2OHClC 2H 5OH OHO s O 4KOH(4)(5) (6)(7) (8)7 (1) CH 3CH 3CH 2C=CCH 2CH 3CH 3 (2)(3)CH 22CH 2H 2(1)(2)O 3Ni H +2,CHO Zn CHO (4)(5)(6)6 炔烃与二烯烃习题参考答案1.2. (1) 2,2,6,6-四甲基-3-庚炔(2)2-庚炔(3) 4-甲基-2-庚烯-5-炔(4)1-己烯-3,5-二炔(5) (E),(Z)-3-叔丁基-2,4-己二烯3. (1)CH2=CHCH2C≡CH 1-戊烯-4-炔(2)CH3CH=CH-C≡CH 3-戊烯-1-炔(3)(CH3)3CC≡CC(CH3)32,2,5,5-四甲基-3-已炔(4)2,5-二甲基-3-庚炔4. (1)(2)、(3)无顺反异构体(4)顺式(Z)反式(E)5. (1)ΔHФ=EC≡C+EBr-Br+2EC-H–(2EC-Br+EC=C +2EC-H)=EC≡C +EBr-Br–2EC-Br–EC=C = 835.1+188.3–2×284.5-610 =-155.6KJ/mol(2)同理:ΔHФ=EC≡C–EC=C=835.1-610-345.6=-120.5KJ/mol(3)+EH-Br-EC=C-EC-Br-EC-H =835.1+368.2-610-284.5-415.3=-106.5 KJ/mol6. 1,4戊二烯氢化热预测值:2×125.5= 251 KJ/mol,而1,3-戊二烯氢化热的实测值为226 KJ/mol∴ E 离域能= 251-226=25 KJ/mol7.ΔHФ> 0,说明乙醛变为乙烯醇需吸热,,即乙醛比乙烯醇稳定。
8. (1)(2)(3)(4)(5)(6)(7)(8)(9)9. (1)(2)10. 设10 g戊烷中所含烯的量为x g ,则:∴混合物中戊烯的质量分数为0.35/1×100% = 35%11该炔烃为(CH3)2CHCH2C≡CH12.(1)该二烯烃(2)13. ∴该化合物为14.(1)(2)(3)(4)(5)(8)(6)(7)15. (1)(3)(2)(4)16.(1)(2)(3)(5)(4)17. 一种反应向多种产物方向转变时,在反应未达到平衡前,利用反应快速的特点控制产物叫速度控制。
