初三化学化学质量守恒定律的专项培优练习题(含答案)含答案
初三化学质量守恒定律试题答案及解析

初三化学质量守恒定律试题答案及解析2CO可表示为1.用“O”表示碳原子、“●”表示氧原子,则方程式2C+O2【答案】C【解析】构成物质的微粒有:分子、原子、离子,碳是由碳原子构成,氧气由氧分子构成,通过2CO,微观意义是:2个碳原子和一个氧分子反应生成2个一氧化碳分子,结方程式2C+O2合分子、原子的微观图,故选C【考点】分子、原子的微观图,化学方程式的微观意义2.化学反应前后可能发生变化的是A.物质的总质量B.元素种类C.原子数目D.分子数目【答案】D【解析】化学反应的实质是分子分成原子,原子再重新组合成新的分子的过程。
A、根据质量守恒定律的定义可知,物质的总质量是一定不变的;B、因为化学反应是原子的重新组合,原子的种类不变,元素的种类也一定不变;C、因为化学反应的实质是分子分成原子,原子再重新组合成新的分子,在化学反应前后原子的种类、数目、质量都不变;D、化学反应前后有两个可能变:分子的数目、元素的化合价,故此选项正确。
故选D【考点】质量守恒定律及其应用点评:理解和掌握化学反应前后六个不变、两个一定变、两个可能变;六个不变:原子的种类、数目、质量、元素的种类、质量、物质的总质量;两个一定变:分子的种类、物质的种类;两个可能变:分子的数目、元素的化合价。
3.下列各项中,在化学反应前后,肯定没有改变的是A.原子的数目B.分子的数目C.物质种类D.分子的种类【答案】A【解析】质量守恒定律是指参加化学反应的各物质的质量总和,等于反应后生成各物质的质量总和。
从微观上来说,该定律成立的原因是:“在化学反应前后,原子的种类、数目和质量三不变”。
故该定律的含义是:“宏观上的‘反应前后物质总质量、元素的种类、各元素质量’和微观上的‘原子的种类、原子的数目、原子的质量’六不变”。
A、由于在化学反应前后,原子的种类、数目和质量都不变,故A正确;B、对于大多数的化学反应来说,反应前后分子的数目是要发生改变的,故B错误;C、化学反应的实质就是产生了新的物质,所以反应前后物质的种类一定改变,故C错误;D、物质是由分子构成的,所以反应前后分子的种类一定改变,故D错误。
中考化学化学质量守恒定律(大题培优 易错 难题)含答案

=
×100% =31.6%,错误。故选 B。
点睛:结合新信息,灵活运用化学式的意义是解题的关键。
6.软玉也称“中国玉”,以新疆“和田玉”为代表,生成“和田玉”矿床的反应方程式是
5CaMg(CO3)2+8SiO2+H2O=Ca2Mg5(Si4O11)2(OH)2+7CO2↑+3R,则 R 的化学式为( )
【答案】B
【解析】
【分析】
反应后质量减少的物质是反应物,减少的质量是参加反应的质量,反应后质量增多的物质
是生成物,增多的质量是生成的质量。X 反应后质量增多,是生成物,生成的质量是 18g-
2g=16g,Z 反应后质量减少,是反应物,参加反应的质量是 16g-6g=10g,W 反应后质量减
少,是反应物,参加反应的质量是 16g-11g=5g,5g+10g<16g,所以 Y 是反应物,参加反应
A.CaCO3
B.Ca(OH)2
C.Mg(OH)2
D.MgCO3
【答案】A
【解析】
【分析】
根据质量守恒定律,反应前后元素种类及原子个数均不变。
【详解】
由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式
5CaMg(CO3)2+8SiO2+H2O=Ca2Mg5(Si4O11)2(OH)2+7CO2↑+3R,反应前钙、镁、碳、氧、硅原子 个数分别为 5、5、10、47、8,反应后的生成物中钙、镁、碳、氧、硅原子个数分别为 2、
加上相应的数字,2N 表示 2 个氮原子,元素是一个宏观概念,无数量的意义,此选项错 误; D. 氯化钠溶液中含有 Na+和 Cl﹣,此选项正确。 故选 D。
初三化学质量守恒定律培优检测题附答案

初三化学质量守恒定律培优检测题附答案一、初中化学质量守恒定律选择题1.一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。
下列说法中,不正确的是()物质甲乙丙丁反应前的质量/g50200反应后的质量/g23X243A.x的值等于2 B.甲一定是化合物C.该反应是化合反应D.反应时丙和丁的质量比为8:12.某反应前后分子变化的微观示意图如下。
下列说法不正确...的是A.该反应中共有3种分子B.该反应中分子数减少C.甲和乙的相对分子质量之和与丙的相对分子质量相等D.该反应属于化合反应3.下图为某反应的部分微观示意图,其中不同的球代表不同元素的原子。
下列说法正确的是()A.该反应属于置换反应B.参加反应的两种分子个数比为1:1C.1个X分子中含有3个原子D.1个X分子中含有3种不同的原子4.某个化学反应的微观示意图如图。
有关说法正确的是()A.该反应为分解反应B.该反应不遵守质量守恒定律C.该反应前后分子种类未发生变化D.该反应的化学方程式为H2+Cl22HCl5.图反映了某个化学反应各物质质量与时间的关系。
下列描述正确的是A.该反应是化合反应B.甲的相对分子质量大于乙C.丙是反应物,甲和乙是生成物D.t1时,丙的质量一定等于甲、乙的质量之和6.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列说法错误的是( )A.x的值是7B.丙可能是该反应的催化剂C.该反应是化合反应D.参加反应的甲和乙质量比为2:77.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如表:物质甲乙丙丁反应前的质量(g)561820反应后的质量(g)1002X下列说法不正确的是()A.x为64B.参加反应的乙的质量为18gC.参加反应的甲物质的质量为46g D.丙物质一定作催化剂8.下列物质由离子直接构成的是A.H2O B.He C.O2D.NaCl9.下列化学用语的使用及其表示的意义,正确的是A.2H2 2个氢气B.4H 4个氢元素C.Ca+2—个钙离子D.2CO2两个二氧化碳分子10.三位科学家因“分子合成器”分享2016诺贝尔化学奖,下列关于分子的说法正确的是()A.物质都是由分子构成的B.同种原子可以构成不同的分子C.化学变化中分子的个数一定发生改变D.分子的质量一定大于原子的质量11.某反应前后分子变化的微观示意图如下。
培优训练:质量守恒定律相关计算练习(含答案)教师版

培优训练:质量守恒定律相关计算练习(含答案)教师版一、选择题1.我国已研究新型水处理剂ClO2的新制法,其反应的微观过程如图所示(其中表示氯原子,表示钠原子,表示氧原子),下列相关结论正确的是()A.化学反应前后,分子的种类和数目保持不变B.该反应的反应物、生成物都是化合物C.该反应中氯元素的化合价共表现了4种D.该反应的化学方程式为2Cl+2NaClO2=2ClO2+2NaCl【答案】C【解析】【分析】根据反应的微观过程图,分析反应物生成物写出反应的化学方程式,据其意义分析判断有关的问题;根据微粒的变化分析分子、原子的变化.根据微粒的构成分析物质的类别等.【解答】解:根据图示可以看出,反应物为一个Cl2和2个NaClO2,生成的是2个NaCl和2个ClO2,反应的化学方程式是:Cl2+2NaClO2═2NaCl+2ClO2.A、由微粒的变化可知,化学反应前后,分子的种类和数目都发生了变化,故A错误;B、由方程式可知,该反应的反应物中有单质参加反应,故B错误;C、由返程时可知,在Cl2、NaClO2、NaCl、ClO2中氯元素的化合价分为:0、+3、﹣1、+4,氯元素的化合价共表现了4种,故C正确;D、由上述分析可知,该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl,故D错误.故选C.【点评】本题考查了净水的知识及化学式的读法和根据微观粒子化学方程式的写法,完成此题,可以依据已有的知识进行,书写反应的化学方程式要根据图示正确写出物质的化学式.2.某纯净物3g在氧气中完全燃烧,生成8.8g二氧化碳和5.4g水。
下列说法不正确的是( )A.该纯净物中含有C、H元素,不含O元素B.该反应中O2和CO2的质量比为14:11C.该反应中O2和H2O的分子数之比为7:6D.该纯净物中C、H原子的个数比为1:4【答案】D3.在某密闭容器中,加入一定质量的甲、乙、丙、丁四种物质,一段时间后,测得各物质的质量如下表。
初三化学化学质量守恒定律的专项培优练习题(含答案)含答案
初三化学化学质量守恒定律的专项培优练习题(含答案)含答案一、初中化学质量守恒定律1.在一个密闭容器内有四种物质,一定条件下充分反应后,测得反应前后各物质的质量如表,下列推理正确的是物质X Y Z Q反应前质量/g410121反应后质量/g01215待测A.反应物是X和Y,成物是Q和ZB.参加反应的Y和Q的质量比是1∶1C.参加反应的X与Q的质量比是1∶3D.反应后生成15 g Z【答案】C【解析】由表中数据分析可知,反应前后X的质量减少了4 g﹣0 g=4 g,故X是反应物,参加反应的X的质量为4 g;反应前后Y的质量增加了12 g﹣10 g=2 g,故Y是生成物;同理确定Z 是生成物,生成的Z的质量为15 g﹣1 g=14 g;由质量守恒定律,Q应是反应物,且参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故待测的数值为21g﹣12 g=9 g。
A、根据分析,可知反应物是X和Q,生成物是Y和Z,故选项说法错误;B、参加反应的Y的质量为12 g ﹣10 g=2 g,参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故参加反应的Y和Q的质量比是1∶6,故选项说法错误;C、参加反应中X、Q的质量比为4 g∶12 g=1∶3,故选项说法正确;D、根据表格中的数据,反应后生成Z的质量为15 g﹣1 g=14 g,故选项说法错误。
故选C。
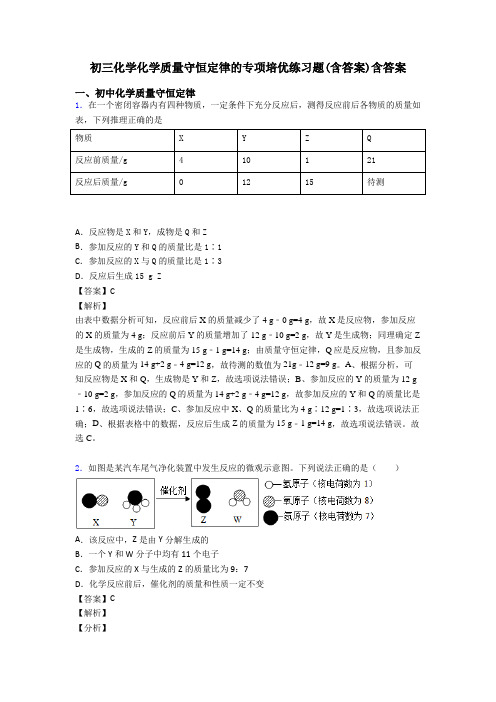
2.如图是某汽车尾气净化装置中发生反应的微观示意图。
下列说法正确的是()A.该反应中,Z是由Y分解生成的B.一个Y和W分子中均有11个电子C.参加反应的X与生成的Z的质量比为9:7D.化学反应前后,催化剂的质量和性质一定不变【答案】C【解析】【分析】由反应的微观示意图可以看出,反应物是NH3和NO两种分子,生成物是N2和H2O两种分子,所以化学反应方程式为:6NO+4NH3催化剂5N2+6H2O。
【详解】A、由微粒的构成可知,X、Y都含有氮原子,不能确定Z是由Y分解生成的,故A不正确;B、由微粒的构成可知,Y和W分子分别是氨分子和水分子,一个Y和W分子中均有10个电子,故B不正确;C、参加反应的X与生成的Z的质量比为(30×6)(28×5)=9:7,故C正确;D、化学反应前后,催化剂的质量和化学性质一定不变,故D不正确。
初三化学质量守恒定律选择题(习题及答案)

相对原子质量:H—1;O—16;C—12;N—14;S—32;Cl—35.5;Al—27;Mg—24;Cu—64;Fe—56;Zn—65;K—39;Ca—40;Mn—55;P—311.化学反响遵循质量守恒定律的原因是反响前后A.分子种类不变 B.分子数目不变C.原子种类和数目没有改变D.物质种类没有改变2.化学反响方程式2H2 + O2点燃2H 2O 所表示的意义是①氢气和氧气在点燃条件下生成水②每两个氢分子和一个氧分子在点燃的条件下生成两个水分子③氢气、氧气、水的质量比为4:32:36A.①③B.①②③C.②③D.①②3.依据化学方程式4NH3+5O2====4X+6H2O,可推断X的化学式是:A.NO B.NO2C.N2O3 D.NH3 4.以下化学方程式书写正确的选项是A.氧化汞加热分解:HgO △Hg+O2↑B.铁在氧气中燃烧:3Fe+2O2点燃Fe304C.氢氧化钠溶液与硫酸铜溶液混合: CuSO4+NaOH=Na2SO4+Cu(OH)2 D.碳在氧气中燃烧: C+O2= CO25.碱式碳酸铜受热分解成CuO、CO2和H2O等三种物质,则碱式碳酸铜的组成是A.只含有碳、氢、氧元素B.肯定含有碳、氢、铜元素,可能含有氧元素C.肯定含有碳、氢、氧元素,可能含有铜元素D.肯定含有碳、氢、氧、铜元素6.元素周期表是学习和研究化学的重要工具,右图是元素周期表中的氯元素,以下说法不正确的选项是A.氯元素符号为Cl B.氯元素为金属元素C.氯原子的核内质子数为17 D.氯元素的相对原子质量为35.5 7. 以下各物质反响后,都能生成氧气,其中最合适潜水艇里供应氧气的反响物是①2KClO3MnO2△2KCl + O2↑②2H2O22H2O + O2↑③2Na2O2 + 2CO2=2Na2CO3 + O2↑④2H2O通电H2↑+ O2↑A、KClO3B、H2O2C、Na2O2D、H2O8.相同质量的以下物质全局部解后,放出氧气最多的是2MgOA.H2O B.KMnO4C.HgO D.KClO39. 3g镁在3g氧气中燃烧可生成氧化镁的质量是〔已知:Mg+O2点燃2MgO〕A.小于6g B.大于6g C.等于6g D.以上都有可能10.以下能正确表示铁在氧气中燃烧的化学方程式的是A.Fe + O2点燃FeO B.3Fe + 2O2点燃Fe3O4C.4Fe + 3O2点燃2Fe2O3D.6Fe +4O2点燃2Fe3O411.用托盘天平称量潮湿的或具有腐蚀性的药品时,药品必须放在A.托盘上B.纸上C.玻璃器皿中D.铁盒上12.相同质量的以下物质在氧气中完全燃烧,消耗氧气最多的是A.CB.P C.S D.H213.在白磷燃烧前后质量测定的探究活动中,陆红同学在玻璃管上端没有系小气球,以下表达错误的选项是A.局部五氧化二磷扩散到空气中B.天平不平衡C.符合质量守恒定律D.锥形瓶的瓶塞会被冲出来14.以下变化不符合质量守恒定律的是A.镁条燃烧后生成物的质量比镁条B.纸条燃烧后,灰烬的质量比纸条质量小C.湿衣服晾干D.蜡烛燃烧越来越短15.在2A + B2 = 2C 的反响中,C的化学式为A.AB B.A2B2C.AB2D.A2B 16.在化学反响前后,以下各项肯定没有变化的是〔〕MnO2①原子的种类②物质的总质量③元素的种类④分子的数目⑤物质的种类⑥原子的数目A.①②③⑥B.①③④⑤C.①③⑤⑥D.①③⑥17.在一密闭容器内有4 种物质,在肯定条件下充分反响后,测得各物质的质量如下:已知X的相对分子质量为n,Q的相对分子质量为2n。
《质量守恒定律》习题(含答案及解析)

《质量守恒定律》练习题一、单选题(本大题共24小题,共48.0分)1.科学家探索用CO除去SO2,该研究涉及的一个反应SO2+2CO=2X+S,则X为()A. CO2B. CC. CS2D. COS2.在化学反应前后:①物质的化学性质②原子的种类③元素的种类④反应物的质量总和与生成物的质量总和。
其中一定不发生变化的是()A. ①②③④B. ①③④C. ②③④D. ②③3.汽车尾气是空气污染的元凶之一,使用催化净化装置可有效减少尾气污染。
下图是一种处理汽车尾气的反应微观示意图,下列有关说法正确的是()A. 反应前后均为纯净物B. 反应前后分子数不发生改变C. 该反应可以减少NO2的排放D. 该图不符合质量守恒定律4.关于下列观点中错误的有①铁丝在氧气中燃烧,生成物的质量比铁丝的质量大,这个反应不遵守质量守恒定律②因为“质量守恒”,所以氢气燃烧生成的水中一定含有氢元素③根据质量守恒定律,二氧化碳变成“干冰”后质量保持不变④根据质量守恒定律,双氧水和二氧化锰的混合物制取氧气前后,二氧化锰质量不变。
A. ②③④B. ①②④C. ①③④D. ①②③④5.偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空。
该化学方程式为C2H8N2+2N2O4=2X↑+3N2↑+4H2O↑。
下列说法正确的是()A. X的化学式为COB. 偏二甲肼中碳的质量分数为40%C. 该反应属于化合反应D. 生成N2和H2O的质量比为14:96.下图中的四位同学对H2+Cl22HCl的认识中,不正确的是()A. B. C. D.7. 下列关于化学方程式C +O 2点燃̲̲̲̲̲̲CO 2的读法,错误的是( )A. 碳和氧气在点燃的条件下生成二氧化碳B. 1个碳原子与1个氧分子反应生成1个二氧化碳分子C. 每12份质量的碳跟32份质量的氧气完全反应,生成44份质量的二氧化碳D. 碳加上氧气点燃等于二氧化碳8. 在一个密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是( )物质 甲 乙 丙 丁反应前质量/g4 6 111 4 反应后质量/g 待测15 0 84 A. 该反应不遵循质量守恒定律B. 丙一定属于化合物C. 反应后密闭容器中甲的质量为22 gD. 该反应中,乙、丙的质量变化之比为6:1119. 小明同学从中获得以下信息:①该反应反应物是硫和氧气;②反应发生条件是点燃;③反应前后元素种类和原子个数不变;④反应前后分子总数保持不变;⑤参加反应的硫和氧气的质量比为2:1其中正确的信息是( )A. ①②④⑤B. ①②③C. ④⑤D. ①②③⑤10. 化学方程式不能提供的信息是( )A. 各物质之间的质量比B. 化学反应的快慢C. 在什么条件下发生反应D. 哪些物质参加反应11. 某物质在空气中燃烧生成二氧化碳和水,则关于这种物质的组成描述正确的是( )A. 该物质只含有碳、氢元素B. 该物质一定含有碳、氢、氧元素C. 该物质一定含有碳元素和氢元素,可能含有氧元素D. 无法确定12.如图为某化学反应的微观示意图。
微型培优专题(三)质量守恒定律的图表题

【示范题2】将一定质量的a、b、c、d 4种物质放入一密闭容
器中,在一定条件下反应一段时间后,测得反应后各物质的质量
如下: 物 质 a 6.4 待测 b 3.2 2.56 c 4.0 7.2 d 0.5 0.5
反应前质量(g) 反应后质量(g)
下列说法中错误的是(
反应前质量/g
反应后质量/g
51
x
96
0
0
88
0
54
下列说法中不正确的是( A.x值为5 B.R物质只含有碳、氢元素
)
C.R物质中碳、氢元素质量比为4∶1 D.反应生成的二氧化碳和水的分子个数比为2∶3
【解析】选B。本题主要考查质量守恒定律及关于化学式的计 算。依据质量守恒定律可知:x=51+96-88-54=5,88 g二氧化碳 中含有碳元素24 g,54 g水中含有氢元素6 g,故R中的碳、氢元 素质量为30 g,还含有氧元素;碳、氢元素的质量比为24∶6 =4∶1,二氧化碳和水的分子个数比为
【示范题4】(2014·安徽中考)下图是某个化学反应的微观模 拟图,下列关于该反应前、后的说法正确的是( )
A.均为混合物 C.原子总数减少
B.质量减少 D.分子总数不变
【解析】选A。反应前后都有两种分子,故为混合物;原子总数、 总质量都不变,但分子数减少,故选A。
【示范题5】(2014·成都中考)我国科学家创造性地构建了 “单中心铁催化剂”,在甲烷高效转化研究中获得重大突破。 其成果在最近的美国《科学》杂志发表。该转化的微观示意图 如下:
)
A.a和b是反应物,d可能是催化剂 B.反应后a物质的质量为4.64 g C.c物质中元素的种类,一定等于a、b两种物质中元素的种类 D.若物质a与物质b的相对分子质量之比为2∶1,则反应中a与b 的化学计量数之比为2∶1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学化学质量守恒定律的专项培优练习题(含答案)含答案一、初中化学质量守恒定律1.在一个密闭容器内有四种物质,一定条件下充分反应后,测得反应前后各物质的质量如表,下列推理正确的是物质X Y Z Q反应前质量/g410121反应后质量/g01215待测A.反应物是X和Y,成物是Q和ZB.参加反应的Y和Q的质量比是1∶1C.参加反应的X与Q的质量比是1∶3D.反应后生成15 g Z【答案】C【解析】由表中数据分析可知,反应前后X的质量减少了4 g﹣0 g=4 g,故X是反应物,参加反应的X的质量为4 g;反应前后Y的质量增加了12 g﹣10 g=2 g,故Y是生成物;同理确定Z 是生成物,生成的Z的质量为15 g﹣1 g=14 g;由质量守恒定律,Q应是反应物,且参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故待测的数值为21g﹣12 g=9 g。
A、根据分析,可知反应物是X和Q,生成物是Y和Z,故选项说法错误;B、参加反应的Y的质量为12 g ﹣10 g=2 g,参加反应的Q的质量为14 g+2 g﹣4 g=12 g,故参加反应的Y和Q的质量比是1∶6,故选项说法错误;C、参加反应中X、Q的质量比为4 g∶12 g=1∶3,故选项说法正确;D、根据表格中的数据,反应后生成Z的质量为15 g﹣1 g=14 g,故选项说法错误。
故选C。
2.如图是某汽车尾气净化装置中发生反应的微观示意图。
下列说法正确的是()A.该反应中,Z是由Y分解生成的B.一个Y和W分子中均有11个电子C.参加反应的X与生成的Z的质量比为9:7D.化学反应前后,催化剂的质量和性质一定不变【答案】C【解析】【分析】由反应的微观示意图可以看出,反应物是NH3和NO两种分子,生成物是N2和H2O两种分子,所以化学反应方程式为:6NO+4NH3催化剂5N2+6H2O。
【详解】A、由微粒的构成可知,X、Y都含有氮原子,不能确定Z是由Y分解生成的,故A不正确;B、由微粒的构成可知,Y和W分子分别是氨分子和水分子,一个Y和W分子中均有10个电子,故B不正确;C、参加反应的X与生成的Z的质量比为(30×6)(28×5)=9:7,故C正确;D、化学反应前后,催化剂的质量和化学性质一定不变,故D不正确。
故选C。
【点睛】根据质量守恒定律,反应前后原子个数不变。
3.质量守恒定律是帮助我们认识化学反应实质的重要理论.某物质与水和氧气反应的化学方程式为224242R+2H O+7O=2FeSO+2H SO:则R的化学式应为A.FeS B.Fe2S3C.FeO D.FeS2【答案】D【解析】【分析】根据质量守恒定律,反应前后原子个数不变。
【详解】根据质量守恒定律,反应前后原子个数不变,反应物中氢、氧原子个数分别为4、16,反应后的生成物中氢、硫、氧、铁原子个数分别为4、4、16、2,根据反应前后原子种类、数目不变,则2R中含有2个铁原子和4个硫原子,则化学式为2FeS,故选D。
4.某化学反应的微观示意图如图所示,则下列说法正确的是( )A.反应前后分子种类、数目均不变B.该反应属于置换反应C.该反应中,反应物的质量比是1:2D.该反应的生成物均为氧化物【答案】D【解析】由反应的微观示意图可知,该反应的化学方程式为CH4+2O2点燃2H2O+CO2。
A、由反应的微观示意图可知,反应前后分子种类该变、数目不变,错误;B、由反应的微观示意图可知,生成物中没有单质,不属于置换反应,错误;C、由反应的化学方程式可知,该反应中,反应物的质量比是(12+1×4):(2×16×2)=1:4,错误;D、由反应的化学方程式可知,该反应的生成物是H2O和CO2,均为氧化物,正确。
故选D。
5.为预防手足口病,可用84消毒液(主要成分是NaClO)对生活用品消毒,用酒精是不管用的.有关NaClO的说法错误的是()A.NaClO中氯元素的化合价为﹣1价B.NaClO是一种钠盐C.NaClO由三种元素组成D.NaClO中Na、Cl、O的原子个数比为1:1:1【答案】A【解析】试题分析:A、根据化合物中组成元素的化合价代数和为零,设NaClO中氯元素的化合价为x,则(+1)+x+(﹣2)="0" x=+1;故A不正确;B、根据84消毒液主要成分的化学式NaClO,该物质由金属钠与酸根组成,属于盐;含钠元素的盐可称为钠盐;故B正确;C、根据84消毒液主要成分的化学式NaClO,该物质由Na、Cl、O三种元素组成;故C正确;D、根据84消毒液主要成分的化学式NaClO,该物质Na、Cl、O的原子个数比为1:1:1;故D正确;考点:元素质量比的计算;常见的氧化物、酸、碱和盐的判别;物质的元素组成;有关元素化合价的计算.6.科学家发现亚硝酸氮是一种新型火箭燃料,亚硝酸氮的化学式为N(NO2)3,下列有关N(NO2)3的说法错误的是()A.N(NO2)3中氮元素的化合价为+3B.N(NO2)3中含有4个氮原子和6个氧原子C.N(NO2)3属于氧化物D.N(NO2)3中氮元素的质量分数为36.8%【答案】B【解析】【详解】A.亚硝酸根NO2的化合价为﹣1,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(﹣1)×3=0,则x=+3价,故正确;B.该物质是由分子构成的,而不是由原子直接构成的,每个N(NO2)3分子中含有4个氮原子和6个氧原子,故错误;C.氧化物是只含有两种元素且其中一种元素是氧元素的化合物,N(NO2)3是由氮、氧两种元素组成的,属于氧化物,故正确;D.三亚硝酸氮中氮元素的质量分数为100%≈36.8%,故正确。
故选:B 。
7.下列关于反应C+2H 2SO 4(浓)===∆CO 2↑+2X↑+2H 2O 的分析,正确的是 A .X 的化学式为SO 3B .X 的水溶液能使酚酞溶液变红C .CO 2和X 的质量比为11:16D .碳元素的化合价在反应前后由0价变为+4价 【答案】D 【解析】 【详解】根据反应C+2H 2SO 4(浓)===∆CO 2↑+2X↑+2H 2O 和质量守恒定律的元素守恒和原子个数不变,则可知:反应前C 原子个数为1、H 原子个数为4、S 原子个数为2、O 原子个数为8;反应后C 原子个数为1、H 原子个数为4、O 原子个数为4;可以推测X 气体为SO 2;因此: A 、根据分析,X 气体为SO 2;说法不正确;故不符合题意;B 、SO 2的水溶液呈酸性,不能使酚酞溶液变红,说法不正确;故不符合题意;C 、CO 2和SO 2的质量比为44:128=11:32;说法不正确;故不符合题意;D 、碳单质中碳元素化合价为0,CO 2中碳元素的化合价为+4价,碳元素的化合价在反应前后由0价变为+4价,说法正确;故符合题意; 故选D8.下列化学方程式书写正确的是( ) A .H 2+O 2点燃H 2OB .2Mg+O 2点燃2MgOC .2KClO 3催化剂2KCl+3O 2D .4 Fe+3O 2点燃2Fe 2O 3【答案】B 【解析】 【分析】根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确。
【详解】A 、该化学方程式没有配平,正确的化学方程式应222 2H +O O2H 点燃,故A 不正确;B 、2Mg+O 2点燃2MgO ,化学方程式书写完全正确,故B 正确;C 、该化学方程式缺少反应条件,氧气后面没有标注↑,正确的化学方程式应为:32 2KClO 2KCl 3O ∆+↑催化剂,故C 不正确;D 、铁在氧气中燃烧生成四氧化三铁,正确的化学方程式为234 3Fe+2OO Fe 点燃,故选B 。
9.在一个密闭容器内,有A 、B 、C 、D 四种物质,在一定条件下充分反应,测得反应前后各物质的质量见下表依据上表判断,下列说法正确的是( ) A .该反应是化合反应B .待测值为22C .生成A 和B 的质量比为22:9D .D 物质是该反应的反应物【答案】C 【解析】由表中数据分析可知,反应前后,B 的质量增加了9g ,是生成物,生成B 的质量为9g ;C 的质量减少,是反应物,减少的质量是111g ;同理可以确定D 是生成物,生成D 的质量为80g ;由质量守恒定律,A 应是生成物,且生成的质量为111g-9g-80g=22g ,反应后丁的质量为4g+22g=26g 。
A 、由以上分析可知该反应是一种物质反应生成三种物质,所以属于分解反应,错误;B 、反应后密闭容器中A 的质量为26g ,错误;C 、生成A 和B 的质量比=22g: 9g= 22:9,正确;D 、D 物质是该反应的生成物,错误。
故选C 。
点睛:本题考查了质量守恒定律的应用,解题的关键是分析表中数据,灵活运用质量守恒定律,在化学反应中质量增加的是生成物,质量减少的是反应物。
10.某反应前后分子变化的微观示意图如下(图中“●”和“○”分别代表不同元素的原子),下列说法不正确的是()A.该反应前后涉及到三种物质B.反应后分子种类没有改变C.反应后分子数增多D.该反应属于分解反应【答案】B【解析】【详解】由化学反应的微观示意图可知,各物质反应的微粒个数关系是:A、由图示可知,该反应前后涉及到三种物质,故A正确;B、由微粒的变化可知,反应后分子种类发生了改变,故B不正确;C、由微粒的变化可知,该反应后分子数增多,故C正确;D、该反应由一种物质生成了两种物质,属于分解反应,故D正确。
故选B。
【点睛】化学变化中分子的种类一定改变,数目可变可不变。
11.食盐不仅可以做调味品,还是一种重要的化工原料。
电解饱和食盐水,不可能得到的产物是()A.H2B.Cl2C.NaOH D.Na2CO3【答案】D【解析】【分析】根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变进行分析。
【详解】饱和食盐水中不含有碳元素,所以电解饱和食盐水不可能得到碳酸钠,故选D。
12.浓盐酸跟二氧化锰混合加热会产生一种黄绿色的有毒气体,该气体可能是A.Cl2B.H2C.NH3D.HCl【答案】A【解析】【详解】浓盐酸跟二氧化锰混合加热会产生一种黄绿色的有毒气体,根据质量守恒定律,反应前后,元素种类不变,该气体可能是氯气,氢气为无色的无毒气体;反应物中不含氮元素,不可能生成氨气;氯化氢气体无色,不可能是氯化氢。
故选A。
13.某有机物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该有机物的组成推断正确的是()A.一定含碳、氢、硫元素B.一定含有碳、氢、氧元素C.只含碳、氢元素D.一定含碳、氢、氧元素,可能含有硫元素【答案】A【解析】【分析】【详解】物质+氧气 = 二氧化碳+水蒸气+二氧化硫,根据元素守恒,物质中一定含有碳、氢、硫元素,可能含氧元素,故选A。
