阳离子分析方法
阳离子分析

AgCl + 2NH3· 2O = Ag(NH3)2+ + Cl- + 2H2O H
PbCl2 + 2NH3· 2O = Pb(OH)2↓(白) + 2Cl- + 2NH4+ H
Hg2Cl2 + 2NH3· 2O = HgNH2Cl ↓(白) + Hg ↓(黑) + NH4+ + Cl- + 2H2O H
PbCrO4 ↓(黄色),溶于HNO3、NaOH。
3. 络合物
Ag+: Ag(NH3)2+、Ag(CN)2-、Ag(S2O3)23- 等;
Pb2+: Pb(AC)42-,用于PbSO4和 BaSO4等的分离; 注:本组离子与常用试剂的反应见 表 2~2(P10)
(二)组试剂与分离条件
组试剂:HCl
AgCl↓(白)
示有 Ag+
三、第二组阳离子的分析
(一)本组离子的分析特性
铜锡组:
Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、
As(III,V) 、Sb(III,V) 、Sn(II,IV) 第二组,硫化氢组
0.3mol· -1 HCl L
硫化物↓
H2S
⒈ 离子的存在形式
离子的颜色: Cu2+ 蓝色,其余均无色。
2
K sp ,CdS
故可认为Cd2+沉淀完全,第二组离子全部沉淀完全; 而因Zn2+不会沉淀,第三组其它离子不会沉淀。 加热的作用:促使胶体凝聚;促进 As(V) 被 NH4I 还原为 As(III) 冷却通H2S的作,不利于CdS、
⒉ Ag+与 Hg22+ 的分离及Hg22+ 的鉴定
第一组阳离子分析

1.两酸两碱沉淀分离的依据 两酸两碱沉淀分离是指依次采用HCl、H2SO4、 NH4Cl-NH3和NaOH为组试剂,依据各种氯化物,硫酸 盐和氢氧化物沉淀溶度积的差异进行选择沉淀分离。 2.硫化氢系统分析法的依据 硫化氢系统分析法是指依次采用HCl、H2S、NH4S为 组试剂,依据各种氯化物,硫化物沉淀溶度积的差异 进行选择沉淀分离。
系统分析和分别分析:
系统分析:指按一定的顺序和步骤向试液中 加入某种试剂(主要是沉淀剂),将性 质相近的离子逐组沉淀并分离开来,然 后继续进行组内分离,直至彼此不在干 扰鉴定反应为止。 分别分析:在多种离子共存时,不经过分组 分离,利用特效反应及某些选择性高的 反应直接鉴定某一离子。
组 试 剂
• 概念:分组用的试剂 • 条件: 分离要完全 沉淀与溶液易分开 过量组试剂易除去 各组内离子的种类不宜太多
+ 2H + 2H
﹢
﹢
K+ Zn2+ NH4+
﹡ PbCl2在热溶液中溶解度大,难以沉淀。 ﹡﹡ 此组的离子不沉淀,与沉淀的离子分离。
硫化氢系统分析法
组 名 称 组 试 剂 组 内 离 子 Ⅰ Ⅱ Ⅲ Ⅳ
盐酸
Ag+ Pb2+ Hg22+ Bi3+ (Pb2+)* Cu2+ Cd2+
硫化氢
Hg2+ As (ⅢⅤ) Sb (ⅢⅤ) Sn (ⅡⅤ)
离子的外层电子结构
离子半径大小r
离子电荷多少Z
•离子电位(Z/r )越大,
极化作用越强 •8电子外壳的离子 •未满18电子外壳的离子 •完满18或18+2电子外壳的离子 •不易变形,极化能力小 •较易变形,极化能力较强 •很易变形,极化能力最强
阴阳离子的鉴定

阴阳离子的鉴定
阴离子和阳离子是化学中离子的两种基本类型。
阴离子带有负电荷,而阳离子带有正电荷。
在化学分析中,可以通过不同的实验方法来鉴定阴离子和阳离子。
阳离子的鉴定方法:
1.火焰试验:将待鉴定物质放入火焰中,观察火焰的颜色。
不同的阳离子会产生不同颜色的火焰。
例如,钠离子会产生黄色火焰,钾离子会产生紫色火焰。
2.沉淀反应:使用适当的反应剂,观察是否生成可沉淀的产物。
例如,钡离子通常通过加入硫酸钡溶液来鉴定,生成白色沉淀(硫酸钡)。
阴离子的鉴定方法:
1.沉淀反应:使用适当的反应剂,观察是否生成可沉淀的产物。
例如,氯离子可以通过加入银离子(硝酸银溶液)来鉴定,生成白色沉淀(氯化银)。
2.气体的鉴定:一些气体可以用来鉴定特定的阴离子。
例如,二氧化硫气体可以用于检测硫离子。
3.酸碱中性化反应:使用适当的酸或碱与待鉴定物质反应,观察是否发生中性化反应。
例如,用氢氧化钠溶液可以鉴定酸性溶液中的氢离子。
在实验室中,这些方法通常结合使用,以确保对离子的准确鉴定。
通过观察沉淀、颜色变化和气体产生等现象,可以得出关于阳离子和阴离子的信息。
阴阳离子系统分析

阳离子系统分析:常见阳离子:Ag +、Hg 2+、Hg 22+、Pb 2*、Bi 3+、Cu 2+、Cd 2+、As (3 价和 5 价卜 Sb (3 价和 5 价)、Sn (2 价和 4 价)、Al 3+、Cr 3+、Fe (2 价和 3 价)、Mn 2+、Zn 2+、Co 2+、Ni 2+、Ba 2+、Ca 2+、 Mg 2+、 K +、 Na +、 NH 4+系统分析步骤: 第一组、检验铅离子、亚汞离子、银离子。
1. 加入盐酸至有 0.6mol/L -1 的氯离子剩余,补加稀硝酸至氢离子约 2.0mol/L -1,如有白色沉淀,则为氯化铅(溶解度较大,下组仍要除去铅离子)、氯化亚汞、氯化银,剩余 滤液A 用 于下组分析。
2. 验铅离子: 沉淀加水加热并趁热过滤, 加入醋酸酸化, 加入铬酸钾产生黄色沉淀铬酸铅则 有铅离子; 3. 验银离子:以上剩余沉淀用热水洗净,加入氨水,分离滤液并用硝酸酸化,滤液产生白色沉淀氯化银则有银离子; 4. 验亚汞离子:以上第 3步剩余残渣如变黑则有 Hg 22+(HgNH 2Cl+Hg )。
第二组、检验铅离子、铋离子、铜离子、镉离子、三价砷、汞离子、三价锑、四价锡。
1.往滤液A 中加入0.3mol/L -1的盐酸,通入硫化氢,加热,产生沉淀:PbS CuS HgS 均为 黑色,黑褐色Bi 2$、黄色的CdS 和SnS 、淡黄色AS 2S 3、橙红色S6S 3,剩余滤液B 用于下组 分析。
2 (铅、铋、铜、镉离子的检验)•过滤以上沉淀,加入过量硫化钠,得 沉淀A (组成有硫化 2- 3- 3-2- 铅、三硫化二铋、硫化铜、硫化镉 )和滤液C (组成有HgS -、AsS s -、SbS -、Sn S -)。
3 (铅、铋、铜、镉离子的检验)•往沉淀A 中加入6摩尔每升硝酸,沉淀溶解,在加入 1:1的甘油和过量的浓氢氧化钠,如有黄色沉淀为氢氧化镉,分离出 滤液 D 待检验,沉淀用 3 摩尔每升盐酸溶解,再稀释3倍,加入硫代乙酰胺(CHCSNH )加热,生成黄色沉淀硫化镉则有镉离子。
第二组阳离子分析
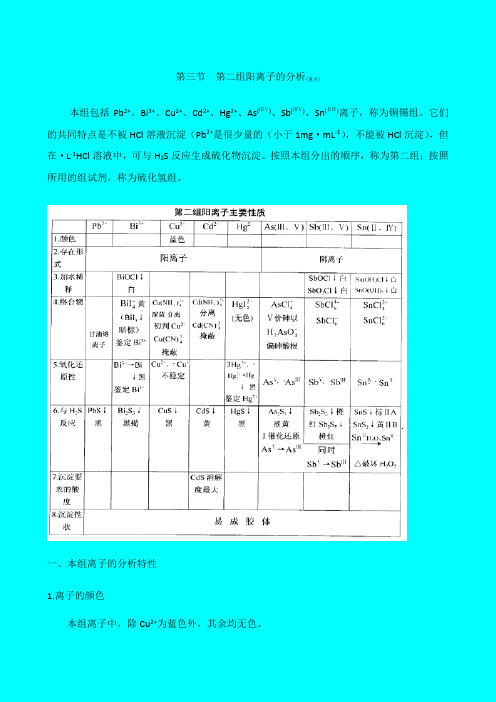
第三节第二组阳离子的分析(重点)本组包括Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(ⅢⅤ)、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子,称为铜锡组。
它们的共同特点是不被HCl溶液沉淀(Pb2+是很少量的(小于1mg·mL-1),不能被HCl沉淀),但在·L-1HCl溶液中,可与H2S反应生成硫化物沉淀。
按照本组分出的顺序,称为第二组;按照所用的组试剂,称为硫化氢组。
一、本组离子的分析特性1.离子的颜色本组离子中,除Cu2+为蓝色外,其余均无色。
2.离子的存在形式铅、铋、铜、镉、汞具有显著的金属性质,在水溶液中主要以金属阳离子的形式存在;而砷、锑、锡三种元素则表现出不同程度的非金属性质,它们在溶液中的主要存在形式随酸碱环境而不同,主要以阴离子形式存在于溶液中。
但由于存在下述平衡AsO33-+6H+=As3++3H2OSbCl63-= Sb3++ 6C1-SnCl42-=Sn2++4Cl-溶液中也或多或少地存在着简单阳离子,并能生成相应的硫化物(如SnS2、As2S3等),所以这些元素还是作为阳离子来研究。
鉴定时并不严格区分它们的存在形式,只是泛指该元素,书写时只标出其氧化数,而不具体指明其存在形式。
3.加水稀释Bi3+、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子(见前表)4.络合物本组离子一般都能生成多种络合物。
其中最常见的是氯络离子,因而大量Cl-存在时可影响到各简单离子的浓度。
另外,Cu2+、Cd2+等能生成氨或氰络离子:Cu(NH3)42+、Cd(NH3)42+、Cu(CN)42+、Cd(CN)42+,它们在Cu2+、Cd2+的分离和鉴定上有很多应用。
Bi3+与I-生成黄色的BiI4-;用于铋的鉴定。
Cu2+、Pb2+和Bi3+能与甘油生成络离子;Hg2+与I-生成无色的HgI42-,它与KOH 一起的溶液,可用于NH4+的鉴定,称为奈氏试剂。
这些都具有一定的分析应用价值。
5.氧化还原性质砷、锑、锡三元素的离子具有两种比较稳定的价态,它们在分析上都具有重要的意义。
常见阳离子和阴离子定性或定量分析方法汇总

常见阳离子和阴离子定性或定量分析方法汇总1、铵离子氨氮(纳氏试剂分光光度法)操作要点:试样中性(氢氧化钠+盐酸)+酒石酸钾钠(消除钙镁影响)+纳氏试剂(420nm淡红棕色络合物)氨氮(甲醛快速法)操作要点:试样酚酞红色(氢氧化钠+盐酸)+甲醛(5ml)+氢氧化钠酚酞红色(酸性六次甲基四胺)2、铁离子铁离子Ⅲ(菲啰啉分光光度法)操作要点:试样酸性(PH=2指示剂对硝基酚无色+盐酸)+抗坏血酸或盐酸羟胺(铁离子Ⅱ)+缓冲溶液(乙酸-乙酸钠)+菲啰啉显色剂(510nm橙红色络合物)铁离子Ⅱ(高锰酸钾氧化法+氢氧化钠)操作要点:①试样弱酸性+高锰酸钾溶液(紫色)+二价锰离子(溶液褪色)②试样弱酸性+氢氧化钠(白色沉淀Fe2++2OH-=Fe(OH)2-灰绿色沉淀-红褐色沉淀4Fe(OH)2+O2+2H2O=4Fe(OH)3)3、铜离子铜离子(二乙基二硫代氨基甲酸钠分光光度法或直接光度法)操作要点:试样酸化(1000ml试样+硝酸2ml)+乙二胺四乙酸二钠盐、柠檬酸铵(掩蔽铁钴镍锰)+氨-氯化铵缓冲溶液(PH=9)+淀粉稳定剂(5g/l)+二乙基二硫代氨基甲酸钠显色剂(460nm黄棕色络合物)4、钙镁离子(总硬度)操作要点:试样中性(盐酸+氢氧化钠)+三乙醇胺(掩蔽铁铝铜锰等)+氨-氯化铵缓冲溶液(PH=10)+铬黑T指示剂+乙二胺四乙酸二钠滴定剂(指示剂由酒红色至纯蓝色)5、钙离子操作要点:试样中性(盐酸+氢氧化钠)+盐酸煮沸(消除重碳酸根、磷酸根等)+三乙醇胺(掩蔽铁铝铜锰等)+氢氧化钾(PH=12-13)+钙-羧酸指示剂+乙二胺四乙酸二钠滴定剂(指示剂由紫红色至亮绿色)6、氯离子(银量法)操作要点:①试样中性或弱碱性+硝酸、氢氧化钠(酚酞微红PH=6.5-10.5)+铬酸钾指示剂+硝酸银滴定剂(判断是否出现砖红色沉淀)②试样酸性+硝酸(酚酞至过量硝酸)+硝酸铁显色剂+硫氰酸汞(硫氰酸汞过量显红色)③试样酸性+硝酸(溴酚蓝指示剂由蓝显黄)+二苯偶氮碳酰肼指示剂+硝酸汞(硝酸汞过量显紫红色)④试样酸性+硝酸(PH≤1)+硝酸银(过量)+铁铵矾指示剂(硫酸铁铵)+硫氰酸铵(硫氰酸铵过量由乳白色显浅橙色或红色)7、硫酸根离子(重量法或目视比浊法)操作要点:①试样+盐酸1+1酸化(消除碳酸根、亚硫酸根离子和银离子)+氯化钡(100g/l)(判断是否出现硫酸钡白色沉淀)8、碳酸根离子操作要点:①试样+盐酸(有气泡产生)+捕集气体通入澄清石灰水(氢氧化钙)(出现白色沉淀)②试样+氯化钡(100g/l、出现白色沉淀)+盐酸(白色沉淀消失且有气泡产生)9、亚硫酸根离子(碘酸钾和碘化钾氧化法)操作要点:①试样+盐酸+碘酸钾、碘化钾或碘(碘褪色证明有亚硫酸根存在)②试样+硝酸钡(100g/l)(出现白色沉淀)+硝酸(白色沉淀不消失,证明存在亚硫酸根)10、硫离子(容量法或目视比浊法)操作要点:①试样+碳酸钠和氯化镉(硫化镉吸收剂)+碘(氧化物)+盐酸(酸性)+硫代硫酸钠(碘化镉试液浊白)②试样+酸化(盐酸)+碱式铅酸钾(醋酸铅+氢氧化钾)+与硫化氢标准使用液目视比浊③试样+盐酸(煮沸)+捕集气体+乙酸铅试纸(黑色)④试样+氢氧化钠+双氧水或高锰酸钾(析出单质硫)。
分析化学阳离子的鉴定实验

分析化学Analytical chemistry——阳离子的鉴定实验-The cation authenticates an experiment班级:050911学号:05姓名:赵冬儿分析化学实验方案一、观察溶液颜色及其沉淀情况二、测定溶液酸碱性三、溶液分成四份后做检验(一)、取一份试液做初步试验a、检NH4+取2个表面皿,在上表面皿中贴湿润的红色石蕊试纸,在下表面皿中滴入试液,并在两夹缝中滴加碱,加热后,若试纸变蓝则表明NH4+存在。
b、检Fe2+(1)K3Fe(CN)6试法在点滴板上放试液1滴,加3 mol/L溶液1滴,K3Fe(CN)61滴,生成深蓝色KFe[Fe(CN)6]沉淀,示有Fe2+。
(2)邻二氮菲试法在点滴板上放1滴试液,加3 mol/L HCl 1滴,邻二氮菲试剂1滴,溶液如显红色,示有Fe2+存在。
c、检Fe3+(1)NH4SCN试法在点滴板上放1滴试液,NH4SCN 1滴,0.1 mol/L HCl 1滴,溶液显红色,示有Fe3+。
同时做空白实验1 份,与此做对比。
(2)K4Fe(CN)6试法在点滴板上放试液1滴,加3 mol/L HCl 1滴,K4Fe(CN)61滴,生成深蓝色KFe[Fe(CN)6]沉淀,示有Fe3+。
离子未知试液的分析实验报告一、实验药品与仪器药品:6mol/LNaOH 、邻二氮菲、K3Fe(CN)6 、NH4SCN 、HCl(8mol/L 、6mol/L 、3mol/L 、1mol/L 、0.6mol/L ) 、K2CrO4、K4Fe(CN)6 、 6 mol/L HNO3、3mol/L HNO3、6mol/L HAc 、浓HAc 、6 mol/L NH3·H2O、SnCl2溶液、浓HCl 、NH4Cl 、120g/L(NH4)2CO3 、TAA、铝片、HgCl2溶液、K2CrO4、H2O2、NaBiO3固体、戊醇、Na2HPO4试剂、丁二酮肟、玫瑰红酸钠试剂、NaAc、(NH4)2C2O4、醋酸铀酰锌试剂、KClO3固体、镁试剂、Na3Co(NO2)6 、甘油溶液、四苯硼化钠、锡箔、镁试剂、乙醇仪器:电炉、离心机、离心管、坩埚、表面皿、滤纸、黑白点滴板、红色石蕊试纸、PH试纸、玻璃棒二、实验步骤(一)、观察溶液颜色及其沉淀情况溶液颜色:紫红色;沉淀情况:白色沉淀;(二)、测定溶液酸碱性PH=1.0呈酸性(三)、溶液分成四份后做初步检验a、检NH4+取2个表面皿,在上表面皿中贴湿润的红色石蕊试纸,在下表面皿中滴入试液,并在两夹缝中滴加碱,加热后,若试纸变蓝则表明NH4+存在。
水处理之水中阳离子的分析

水处理之水中阳离子的分析
工业用水中的阳离子主要有钾、钠、钙、镁、铁、铝、锌、铜离子等。
这些离子常用的测定方法包括:火焰光度法测定钾、钠离子,EDTA配合滴定法测定钙、镁、锌等离子,分光光度法测定铁、铝、铜等离子。
1.钾离子的测定
1)原理
钾的化合物在高温火焰中能发射出波长为766.5nm的特征谱线。
把水样喷人稳定的火焰中,用滤光片把766.5nm的光分离出来,使光电管产生光电流,用检流计检测光谱强度。
在一定浓度范围内光谱强度与水样中钾的含景成正比。
为了抑制钾原子在火焰中的离子化,可使用氯化铯溶液作为电离缓冲剂。
碱土金属对测定有干扰,可加人浓度为250g/L的硝酸铝溶液抑制。
2)主要试剂与仪器
(1)钾离子标准溶液。
称取l05°C〜110°C下烘至恒重的高纯氯化钾 1.907g,精确至0.0002g。
放人100mL烧杯中,加20mL蒸馏水,溶解后转移至1000mL容量瓶中,用蒸馏水稀释至刻度,摇匀备用,此溶液1.00ml含钾离子1.00mg。
移取上述钾离子溶液5.00mL于100mL容量瓶中,加蒸馏水稀释至刻度,此溶液1.00mL 含钾离子0.05mg。
(2)氯化铯溶液。
称取126g氯化铯(CsCl)放入200mL烧杯中,加人50mL蒸馏水,再加人1+1盐酸40mL,溶解后转移至1000mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
(3)火焰光度计。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、第一组阳离子的分析
分组依据: 氯化物难溶于水 第一组阳离子:Ag+、Hg22+、Pb2+ 组试剂:稀HCl ㈠ 主要特性 1. 离子的存在形式 Ag+、Pb2+、Hg22+ (Hg+∶Hg+) Hg22+ = Hg2+ + Hg ↓
2. 难溶化合物
⑴
Ag+
Hg22+ Pb2+
氯化物
AgCl↓ (白色凝乳状) Cl-
Ⅲ
(NH4)2S (NH3 + NH4Cl) 或TAA,△ (NH4)2CO3 (NH3 &,Sr2+,Ca2+
碳酸铵组,钙组
Ⅴ
Mg2+,K+,Na+, NH4+
可溶组,钠组
简化的硫化氢系统分组方案
Ⅰ组 盐酸组 银 组 Ⅱ组 硫化氢组 铜 锡 组 Ⅲ组 硫化铵组 铁 组 Ⅳ组 可溶组 钙钠组
CH3CSNH2 + 3OH- == CH3COO - + NH3+ S2-(多硫化物具有氧化性) △
C、氨性:代替(NH4)2S NH2 △ CH3CSNH2 + 2 NH3 == CH3 C NH + NH4++ HS一
2. 分析步骤
⑴ 在含有阳离子的分析液(酸性溶液)中,加入 稀HCl,把第一组离子沉淀并分离出来。 ⑵ 将分离沉淀后所得的清液,调整酸度至HCl浓度 为0.3mol/L,通入H2S,或在0.2~0.6mol/L HCl存在下, 加TAA,加热, 把第2组离子沉淀并分离出来。
• 酸碱性能力不同 • 碱性: PbS Bi2S3 CuS CdS • 酸性明显: As2S5> As2S3 > Sb2S5 > Sb2S3 > SnS2 > HgS > SnS
㈡ 第二组阳离子硫化物的沉淀条件 1. 在Ⅱ—Ⅴ组阳离子的酸性混合液中,加入H2O2 氧化SnⅡ为SnⅣ,加热除尽过量的H2O2(若无 SnⅡ,此步可省略); SnCl42- + H2O2 + 2HCl = SnCl62- + 2H2O • H2O2 + H2S = S + 2H2O 2. 调节溶液中HCl的浓度为0.3mol/L; • 沉淀要求的酸度 • 第二组溶解度最大者CdS:Ksp=7.1×10-28 • 第三组溶解度最小者ZnS:Ksp=1.2×10-23 • Ksp,CdS<<Ksp,ZnS
第四、五组的硫化物溶于水; 第二、三组与四、五组硫化物的溶解度差 别很大。
沉淀第二组阳离子应将溶液的酸度控制在0.24~0.31 mol/L之间,实际约为0.3mol/L。 这首先是一个实验的结果,是以HCl溶液为基础的结 论。这里不仅有酸度问题,而且有Cl-与各种阳离子 生成氯配伍离子的效应在内,因此随便代替不合适。 而且
• 1. 离子的颜色
第三组阳离子在不同存在形式时的颜色
H2S组离子的分离与鉴定步骤表
铜组与锡组的分离
• 四、第三组阳离子的分析
• 本组包括由7种元素形成的8种离子:称为铁组 。 • Al3+、Cr3+、Fe3+、Fe2+、 • Mn2+、Zn2+、Co2+、Ni2+ • 分组依据: NH3—NH4Cl存在下与(NH4)2S生成硫化物 或氢氧化物沉淀 • 组试剂:NH3—NH4Cl存在下的(NH4)2S • ㈠ 主要特性
•
确保Ag+、Hg22+沉淀完全,适当降低PbCl2的溶解 度,防止第二组的Bi3+、Sb3+水解。
• 本组氯化物沉淀的条件是:
在室温下的酸性试液中,加入适当过量的稀HCl。 a. CL-适当过量:沉淀完全,过量生成络合物。0.5M b. 控制室温减小PbCl2的溶解度([Pb2+]《1mg.ml-1二组检) c. 适当的酸度:防止Bi3+、Sb3+等水解(2.0-2.4M) d. 防止胶体生成:加入适量电解质
加热60-70℃:防止胶体生成 冷却通H2S:反应完全 稀释:减小酸度
(2)用TAA代替H2S时,分离Ⅱ组的条件 先用氨水和盐酸调节试液的酸度为0.6mol· -1,加TAA L 并在沸水浴上加热10min。冷却后将试液稀释1倍(此时酸度 接近0.2mol· -1 ),再加TAA并加热10min,直至本组离子 L 沉淀完全。 若用TAA代替Na2S分离ⅡA和ⅡB组,事先可不加
Al3+ Cr3+ Fe3+ Fe2+
Mn2+ Zn2 + Co2+ Ni2+
Ba2+ K+ Ca2+ Na+ Mg2+ NH4+
硫代乙酰胺(CH3CSNH2 简称TAA)可代替H2S
(1)TAA的水解 A、酸性:代替H2S CH3CSNH2 + H++2H2O == CH3COOH + NH4++ H2S↑ △ B、碱性:代替Na2S
HNO3有氧化性,能改变一些离子的价态,还能使H2 S受氧化而失效且铜组硫化物溶于硝酸。
以硫酸代替盐酸则Ba2+、Sr2+、Ca2+同时沉淀 以醋酸代替盐酸酸度达不到
3. 加入NH4I少许,还原AsⅤ为AsⅢ(此时S bⅤ也同时被还原为SbⅢ); AsO43- +2I- + 2H+ =As2O33- +I2 +H2O I2 +H2S = 2I- + 2H+ + S 4. 加热,通H2S,冷却,将试液稀释一倍, 再通H2S,至本组完全沉淀。
3. 第三组(氨组):分离一、二组后, 氢氧化物难溶于水,也难溶于NH3·2O的离子 H 有:Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Bi3+、Hg2+、 SbⅢ,Ⅴ、SnⅡ,Ⅳ。 4. 第四组(碱组):分离一、二、三组后, 氢氧化物难溶于水,也难溶于过量NaOH溶液 的离子,包括:Cu2+、Cd2+、Co2+、Ni2+、Mg2+。 5. 第五组(可溶组):分离一至四组后, 未被沉淀的离子,包括Zn2+、K+、Na+、NH4+、 AsⅤ。
Hg2Cl2 ↓(白色粉末状)
PbCl2 ↓ (白色针状)
•⑵
铬酸盐
Ag+ Hg22 + Pb2+
K2CrO4
Ag2CrO4↓(砖红色) Hg2CrO4 ↓(红色) PbCrO4 ↓ (黄色)
(不溶于稀HAc)
⑶
硫酸盐
Ag+ Hg22+ Pb2+ Ba2+、Sr2+、Ca2+ Ag2SO4↓(白色) Hg2SO4 ↓(白色) PbSO4 ↓ (白色)
• 对组试剂的要求: (1) 分离完全 (2) 沉淀和溶液易分开 (3) 各组离子的数目不要过多 (4) 过量的组试剂不干扰以后的分析
分析方法: 1. 掌握分组依据和沉淀条件 2. 掌握各组分析步骤(简图)
3. 熟悉组内分离的主要条件和各离子主要鉴
定方法 4. 实验操作
常见25种阳离子:
Ag+、Hg22+、Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、 AsⅢ,Ⅴ、SbⅢ,Ⅴ、SnⅡ,Ⅳ、Al3+、Cr3+、Fe3+、 Fe 2+、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Sr2+、
组的名称
组试剂
稀HCl
H2S或TAA,加热 (0.3mol/L HCl, H2S 或 0.2~0.6mol/L HCl )
(NH4)2S 或TAA 加热 (NH3 + NH4Cl)
组内离子
Ag+ Hg22+ Pb2+
Pb2+ Hg2+ Bi3+ AsⅢ,Ⅴ Cu2+ SbⅢ,Ⅴ Cd2+ SnⅡ,Ⅳ
第二节 阳离子分析
要 求
1、掌握常见阳离子的硫化氢系统分组方案 的依据和分组方法。
2、掌握常见阳离子与常用试剂的反应。
3、掌握常见阳离子的系统分析鉴定方法。
1
一、常见阳离子的分组 一次分出一组离子的试剂就叫做组试剂; 若再利用某种试剂将分析组分成更小的 组,此小组就称为分组或族,所用的试剂称为 族试剂。
、Cd2+
+NH3
Pb2+、Bi3+、 Cu2++甘油 Hg2+ +4I-
4. 硫化物 ⑴ 本组离子的硫化物都有颜色
PbS Bi2S3 CuS HgS 黑色 CdS 亮黄 As2S3 As2S5 淡黄 Sb2S3 Sb2S5 橙红 SnS 棕 SnS2 黄
⑵ 本组硫化物的溶解度均较小,且有显著差异 ⑶ 本组硫化物类似于其氧化物或氢氧化物,酸 碱性差别较大
SbⅢ,Ⅴ、SnⅡ,Ⅳ它们的氧化性和还原性在分析上很重要
As有三种价态,即正三价、正五价、负三价。负三价的 As主要以AsH3形式存在,AsH3还原力极强,能将AgNO3 中的Ag+还原为金属Ag,是As的一种重要检出反应。
3. 络合性
本组离子均能生成多种络合物,在离子的分离与鉴定上都有 许多应用。 Cu2+
㈠ 主要特性
1. 离子的存在形式
关于Pb2+ Cu2+蓝色
2. 氧化性和还原性
Pb、Bi、Cd 仅各有1种重要阳离子: Pb2+、Bi3+、Cd2+ Cu、Hg有两种价态的离子: Cu2+、Cu+、Hg22+、Hg2+ Cu+在溶液中不稳定,易被氧化为Cu2+; Cu2+有氧化性,可利用Cu2+被还原为Cu+的反应进行鉴定 Hg22+很容易被进一步还原,得到黑色的金属汞,故Hg2+ 还原为Hg22+的反应常用于Hg的鉴定
