《界面化学》第三章PPT
合集下载
【胶体和界面化学】研究生课件3

HCOOCR + 3NaOH
H2COOCR
CH2OH 3RCOONa + CHOH
CH2OH
2. R-OSO3M硫酸酯盐 (烷基硫酸盐)R为8~22,M为Na、K , (如十二烷基硫酸钠)
是润湿、乳化分散及去污最好的表面活性剂之一,是在肥 皂之后最老的阴离子表面活性剂,是以用高级醇经硫酸化、 碱中和后制成。由于高表面活性而得到广泛应用,但有两 方面缺点,一是在酸性条件下易水解还原为醇,二是碳原 子数为14-16时室温溶度很小。
第三章:表面活性剂作用原理
§第一节 表面活性剂的分类和化学结构 §第二节 表面活性剂在界面上的吸附 §第三节 表面活性剂在溶液中的状态 §第四节 表面活性剂有序结构 §第五节 表面活性剂的化学结构和性能
的关系
§第一节 表面活性剂的分类和化学结构
1.1 表面活性和表面活性剂 1.2 表面活性剂的分子结构特点 1.3 表面活性剂的分类和化学结构
纺织、印染、农药等工业中常用的调湿剂“拉开粉”即为 一
种烷基(二丁基或二异丙基)萘磺酸盐。萘和丁醇在浓硫酸 石油的磺作酸用盐下即生成二丁基萘磺酸,以碱中和即得萘磺酸盐。
石油磺酸过去常为提炼、纯化白矿油的副产品,与废酸一起 被抛弃。近年来应用越来越广泛。石油磺酸不再作为废品被 弃去,而是在市场上供不应求。实际应用的石油磺酸大部分 是油溶性的,其平均分子量大约在400与580之间(石油磺酸钠)
烷基苯磺酸盐,十二烷基苯磺酸钠,是大多数洗衣粉中的主要 成分,在硬水中一般不生成皂垢,耐酸碱。制造的主要原料是 石油,合成路线:
C10H24CH4 = CH2 +
[HF] C12H25
or[H2SO4]
C12H25
[H2SO4] [SO3]
H2COOCR
CH2OH 3RCOONa + CHOH
CH2OH
2. R-OSO3M硫酸酯盐 (烷基硫酸盐)R为8~22,M为Na、K , (如十二烷基硫酸钠)
是润湿、乳化分散及去污最好的表面活性剂之一,是在肥 皂之后最老的阴离子表面活性剂,是以用高级醇经硫酸化、 碱中和后制成。由于高表面活性而得到广泛应用,但有两 方面缺点,一是在酸性条件下易水解还原为醇,二是碳原 子数为14-16时室温溶度很小。
第三章:表面活性剂作用原理
§第一节 表面活性剂的分类和化学结构 §第二节 表面活性剂在界面上的吸附 §第三节 表面活性剂在溶液中的状态 §第四节 表面活性剂有序结构 §第五节 表面活性剂的化学结构和性能
的关系
§第一节 表面活性剂的分类和化学结构
1.1 表面活性和表面活性剂 1.2 表面活性剂的分子结构特点 1.3 表面活性剂的分类和化学结构
纺织、印染、农药等工业中常用的调湿剂“拉开粉”即为 一
种烷基(二丁基或二异丙基)萘磺酸盐。萘和丁醇在浓硫酸 石油的磺作酸用盐下即生成二丁基萘磺酸,以碱中和即得萘磺酸盐。
石油磺酸过去常为提炼、纯化白矿油的副产品,与废酸一起 被抛弃。近年来应用越来越广泛。石油磺酸不再作为废品被 弃去,而是在市场上供不应求。实际应用的石油磺酸大部分 是油溶性的,其平均分子量大约在400与580之间(石油磺酸钠)
烷基苯磺酸盐,十二烷基苯磺酸钠,是大多数洗衣粉中的主要 成分,在硬水中一般不生成皂垢,耐酸碱。制造的主要原料是 石油,合成路线:
C10H24CH4 = CH2 +
[HF] C12H25
or[H2SO4]
C12H25
[H2SO4] [SO3]
电子教案与课件:《应用胶体与界面化学》第三章 表面张力与润湿作用

一 、润 湿 作 用 二、接触角与Young方程 三 、决定和影响接触角大小的 因 素 四 、常用的接触角测量方法 …
一 、润 湿 作 用
凝聚态物体表面一种流体被另一种流体取代的过程称为润湿(wetting)。例如, 液体将固体表面的气体取代,形成液体膜或液滴。液体取代固体表面气体,液 体不能完全展开的过程称为沾湿(adhesion)。沾湿是原有的气液和固气界面消 失形成新的固液界面。若形成单位界面,此过程在恒温、恒压条件下,自由能 的改变为 WA 称为黏附功,是将单位固液界面拉开外界需做的最小功,WA 表征固液界面(即 固体与液体分子间)作用力的大小。WA>0(即 ΔGA<0)是沾湿过程自发进行的条 件。 液体自发在固体表面展开成一薄层,此过程称为铺展(spreading)。铺展是固气 界面消失、气液界面和固液界面形成的过程。若形成单位界面,此过程自由能 的改变为 S 称为铺展系数。此过程自发进行的标准是 ΔS>0(即 ΔGs<0)。
一 、 几个小实验
在石蜡表面上的小水滴会自动成球形;在水面上用简单的方法可使金属针(或分 值硬币)漂浮,但不能使它们悬浮于水中;从管口缓慢自然形成的液滴形状与橡 胶薄膜中盛水悬起的形状很相似;插入水中的毛笔笔毛是分散开的,当笔头提 出水面后笔毛并拢,成一体状。这些实验现象说明:①液体表面与体相液体的 性质不完全相同;②液体表面似存在一弹性膜;③液体表面有自动缩小的本能。 液体表面的这些特点可从力学和能量的角度予以解释。
第二节 弯曲液面内外压力差与曲率 半径的关系——Laplace公式
一、Laplace公式的简单导出
二、LaplaBiblioteka e公式的应用举例一、Laplace公式的简单导出
弯曲液面与平液面不同,弯曲液面表面张力在法线方向的合力不等于零。凸液 面,表面张力合力方向指向液体内部;凹液面,合力方向指向液体上方。为保 持弯曲液面的存在与平衡,弯曲液面内外两侧有压力差:弯曲液面突向一侧的 压力总是小于另一侧的;换言之,当液面两侧有压力差时,能形成弯曲液面, 液面突向的一侧压力小,两侧压力差与液体表面张力和弯曲液面的曲率半径有 关。
一 、润 湿 作 用
凝聚态物体表面一种流体被另一种流体取代的过程称为润湿(wetting)。例如, 液体将固体表面的气体取代,形成液体膜或液滴。液体取代固体表面气体,液 体不能完全展开的过程称为沾湿(adhesion)。沾湿是原有的气液和固气界面消 失形成新的固液界面。若形成单位界面,此过程在恒温、恒压条件下,自由能 的改变为 WA 称为黏附功,是将单位固液界面拉开外界需做的最小功,WA 表征固液界面(即 固体与液体分子间)作用力的大小。WA>0(即 ΔGA<0)是沾湿过程自发进行的条 件。 液体自发在固体表面展开成一薄层,此过程称为铺展(spreading)。铺展是固气 界面消失、气液界面和固液界面形成的过程。若形成单位界面,此过程自由能 的改变为 S 称为铺展系数。此过程自发进行的标准是 ΔS>0(即 ΔGs<0)。
一 、 几个小实验
在石蜡表面上的小水滴会自动成球形;在水面上用简单的方法可使金属针(或分 值硬币)漂浮,但不能使它们悬浮于水中;从管口缓慢自然形成的液滴形状与橡 胶薄膜中盛水悬起的形状很相似;插入水中的毛笔笔毛是分散开的,当笔头提 出水面后笔毛并拢,成一体状。这些实验现象说明:①液体表面与体相液体的 性质不完全相同;②液体表面似存在一弹性膜;③液体表面有自动缩小的本能。 液体表面的这些特点可从力学和能量的角度予以解释。
第二节 弯曲液面内外压力差与曲率 半径的关系——Laplace公式
一、Laplace公式的简单导出
二、LaplaBiblioteka e公式的应用举例一、Laplace公式的简单导出
弯曲液面与平液面不同,弯曲液面表面张力在法线方向的合力不等于零。凸液 面,表面张力合力方向指向液体内部;凹液面,合力方向指向液体上方。为保 持弯曲液面的存在与平衡,弯曲液面内外两侧有压力差:弯曲液面突向一侧的 压力总是小于另一侧的;换言之,当液面两侧有压力差时,能形成弯曲液面, 液面突向的一侧压力小,两侧压力差与液体表面张力和弯曲液面的曲率半径有 关。
(推荐)《胶体与界面化学》PPT课件

Fx(2lx) 往下运动的距离。在此过程中,表面
积增量为(2表示液膜有两个表面)。
环境对体系做功为 Fx ,这个功为
等于表面能增量:
• 这样比表面能又有了新的定义——表 面张力,即垂直作用在单位边长且与 液面相切的力,这个力力图使液面收
γ= F 2l
缩。
• 由定义可知,其单位为N/m 。
9
需要注意的几点:
• 1. 务必区分表面张力与界面张力。 • 2. 务必注意温度的影响。
• 3. 压力和体系运动情况等其他因素对γ的影响。
• 4.任何界面和表面,包括固体表面,固—液界面均存在 界面张力。 由于固体中分子间作用力远大于液体分子间作用力,因 此固体的界面张力大得多。
• γ的两个物理概念即比表面能和表面张力是一个实质
• 图1-4示出一个用金属丝弯 成的矩形框架,其中一个边 是可滑动的,且认为滑动时 不存在任何阻力,并蘸取肥 皂液形成具有前后两个表面 的膜。
图1-3 图1-4
8
从力的角度分析其γ物理意义
• 图1-4去掉下面的力F时,滑动边就因
液膜的收缩拉回一个距离,(以减少
表面能)。这个回缩力与F大小相等而 方向相反。现在假定加上力F,滑动边
•
dGWR
表面积增加越多,所消耗功也越多,表面能增量越大,故:
dGW RdA
写成等式:
dGdA
∂G (∂A)T.P.n
γ的物理意义:在恒温、恒压和恒组成时,每增加单位表面
积所引起的表面能增量。其单位是J/m2或N/m。
称为比表面过剩自由能或比表面能。
7
(二)表面张力
• 图1-3示出在铁丝圆框之中 有松散的当中封闭的连线, 并蘸上肥皂膜,当用烧热的 铁丝,将线中的膜刺破时, 发现连线当中的封闭线立即 紧绷起来成为环形线,仿佛 四周有均匀的力拉动这个线 似的。
第三章 液-液界面-北航-表面与界面化学教程

油分散在水中,一般呈液珠状态 界面张力的作用使界面处于最小的球面
界面吉布斯函数:在一定温度和压力下,增加单位界面 积时体系吉布斯函数的增量,单位为J· m-2
产生界面张力的原因
1. 分子间的作用力 2. 构成界面的两相物质的性质不同 界面张力反映了界面上分子受到两相分子作用力之差 它随温度升高而下降。 测定方法:原则上测定液体表面张力的方法都可用。 考虑到接触角及黏度等因素的影响,一般采取滴重法和 悬滴法。若润湿性好,也可采用吊片法和毛细上升法。
6.表面活性剂在液液界面上的吸附
(1)液液界面的Gibbs吸附公式 与液体表面一样,表面活性剂在液液界面上,使界面张 力降低的同时,在液液界面上吸附,即表面活性剂在界 面上的浓度将高于其在两液相中的浓度。因为溶质在液 液界面上的吸附,体系至少存在三种组分,即两个液相 和一个溶质。因此 d 12 1d1 2 d 2 3 d3
液液界面张力曲线的转折点仍可视为胶团大量形成的结果,
该点的浓度仍称为表面活性剂的CMC。
表面活性剂降低界面张力的能力与第二相的性质有关。若
第二相是饱和烃,则表面活性剂降低液—液界面张力的能 力比气液界面高。如25℃时,辛基硫酸钠(C8H17SO4Na) 在空气—水界面的cmc=41.5 mN·m-1,而在庚烷—水界面 上的cmc=33 mN·m-1。如果第二相是短链的不饱和烃或芳 烃,则结果相反,即能力降低。如十二烷基硫酸钠在空气 —水表面的cmc=39.5 mN·m-1,而在庚烷—水界面的 cmc=29 mN·m-1,而在苯—水界面的cmc=43mN·m-1。 注意:碳氟表面活性剂虽有很强的降低水的表面张力的能 力,但它降低油-水界面张力的能力并不强。这是因为碳 氟表面活性剂的氟碳链既疏水又疏油。
界面吉布斯函数:在一定温度和压力下,增加单位界面 积时体系吉布斯函数的增量,单位为J· m-2
产生界面张力的原因
1. 分子间的作用力 2. 构成界面的两相物质的性质不同 界面张力反映了界面上分子受到两相分子作用力之差 它随温度升高而下降。 测定方法:原则上测定液体表面张力的方法都可用。 考虑到接触角及黏度等因素的影响,一般采取滴重法和 悬滴法。若润湿性好,也可采用吊片法和毛细上升法。
6.表面活性剂在液液界面上的吸附
(1)液液界面的Gibbs吸附公式 与液体表面一样,表面活性剂在液液界面上,使界面张 力降低的同时,在液液界面上吸附,即表面活性剂在界 面上的浓度将高于其在两液相中的浓度。因为溶质在液 液界面上的吸附,体系至少存在三种组分,即两个液相 和一个溶质。因此 d 12 1d1 2 d 2 3 d3
液液界面张力曲线的转折点仍可视为胶团大量形成的结果,
该点的浓度仍称为表面活性剂的CMC。
表面活性剂降低界面张力的能力与第二相的性质有关。若
第二相是饱和烃,则表面活性剂降低液—液界面张力的能 力比气液界面高。如25℃时,辛基硫酸钠(C8H17SO4Na) 在空气—水界面的cmc=41.5 mN·m-1,而在庚烷—水界面 上的cmc=33 mN·m-1。如果第二相是短链的不饱和烃或芳 烃,则结果相反,即能力降低。如十二烷基硫酸钠在空气 —水表面的cmc=39.5 mN·m-1,而在庚烷—水界面的 cmc=29 mN·m-1,而在苯—水界面的cmc=43mN·m-1。 注意:碳氟表面活性剂虽有很强的降低水的表面张力的能 力,但它降低油-水界面张力的能力并不强。这是因为碳 氟表面活性剂的氟碳链既疏水又疏油。
界面和胶体化学基础PPT讲稿

T ,P, ,nj
i
A ni
T ,P ,
,n j
i
Ai
i is Ai , Ai 0, i is
当前你正在浏览到的事第十三页PPTT,方程
对纯液体
i i , is i ,s ,
i
,s i
Ai
i i
is
,s i
分为如图12-31所示的亲水基和憎水基部分:
当前你正在浏览到的事第十九页PPTT,共一百二十二页。
2.1表面活性剂分类
表面活性剂的种类繁多,但其性质之差异主要取决于亲水和亲油基团 的性质特别是亲水基团的性质。因此通常采用按化学结构的分类方法将其分 为离子型和非离子型两大类,离子型中又可分为阳离子型、阴离子型和两性 型表面活性剂。显然阳离子型和阴离子型的表面活性剂不能混用,否则可能 会发生沉淀而失去活性作用。
用扭力天平测出它施加在AA边上的压力。这种膜天平的准确度
可达1×10-5N/m。
当前你正在浏览到的事第十一页PPTT,共一百二十二页。
Langmuir膜天平
如果用表面压 对表面积A作等温线(A图),可以 看到A图因分子的本性不同或温度不同而不同。 当表面膜行为象二维理想气体时,它的状态方程为:
A n RT
表面活性剂
1.离子型 2.非离子型
阳离子型 阴离子型 两性型
当前你正在浏览到的事第二十页PPTT,共一百二十二页。
常用表面活性剂类型
RCOONa 羧酸盐
阴离子表面活性剂
R-OSO3Na R-SO3Na R-OPO3Na2
硫酸酯盐 磺酸盐
磷酸酯盐
如肥皂一般是含碳14~18个的羧酸盐,这类表面活性剂一般不适用于硬水
1s 2b 1b 2s
第三章 材料表面与界面化学(材料化学)

下面介绍讨论固体表面原子的自行调整 ①.弛豫表面 固体表面层之间以及表面和体内原子层之间 的垂直距离偏离固体内部的晶格常数,而其 晶胞结构基本不变,这种情况称为弛豫。 离子晶体中各个正负离子间的主要作用力是 库仑静电力,这是一种远程力,所以其表面 比较容易发生弛豫现象。
以NaCl晶体为例说明弛豫的特征: NaCl晶体离子半径较大的Cl-作密堆积, Na+填八面体空隙,Na+,Cl-相间排列, 形成NaCl点阵结构。为了方便,我们以二 维平面图形来讨论。晶体表面是质点周期 性排列的中断,理想表面Na+,Cl-并未 变形。然而,表面处于高能状态,系统总 要通过各种途径降低表面能以达到稳定状 态。
因此,即使是新鲜的玻璃表面,其化学成分, 结构也会不同于内部。这种差异可以从表面 折射率、化学稳定性、结晶倾向以及强度等 性质的观测结果得到证实。 对于含有较高极化性能的离子如Pb2+、 Sn2+、Sb2+、Cd2+等的玻璃,其表面结构 和性质会明显受到这些离子在表面的排列 取向状况的影响。这种作用本质上也是极 化问题。
2.固体表面能 .
固体的表面同样具有表面自由能。 1个边长1cm的立方体,表面积为6cm2,分割成边长 为1nm时,小立方体的数目1021((10-7)3=N·13), 总表面积为6×107cm2,可见,对凝聚态的物质而言, 其表面积的大小是与其分散的程度密切相关的,分 散程度用比表面积A0来表示。
清洁表面:固体的清洁表面是指经过特殊的处 清洁表面 理(如离子轰击再加退火热处理,解理,热蚀, 场效应蒸发等)后,保存在高真空条件 [133.332×(10-9-10-10)Pa ]下的表面。可以将 之近似地看作是该固体真正的表面。 即清洁表面是指不存在任何吸附,催化反应, 杂质扩散特等物理-化学效应的表面,表面化 学组成与体内相同,但周期结构可以不同于体 内。
第三章-电极溶液界面
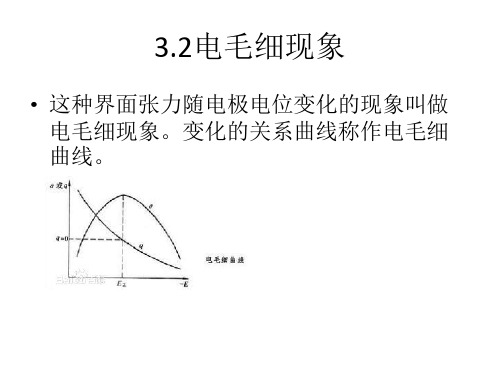
• 特性吸附过程取决于电极与表面活性粒子 之间、电极与溶剂粒子之间、表面活性粒 子与溶剂粒子间的相互作用。
• 影响:改变电极上双电层的分布,从而影 响反应粒子在电极表面的浓度和活化能, 使反应速率发生变化
一、无机离子的吸附
• 1.大多数无机阴离子是表面活性物质,而无 机阳离子的表面活性很小,只有少数离子 才表面活性。
表面张力变化原因
• 无论双电层是带正电还是带负电,由于同 性电荷的相互排除使界面有扩大的趋势, 与表面张力使界面缩小的趋势相反。因此, 带电界面比不带电界面表面张力下。而剩 余电荷密度与电势有关,故表面张力与电 势有关。
二、电毛细曲线的微分方程
• 根据吉布斯等温吸附方程
d id i
i
电子的表面吸附量 e q / F
• 常用的方法: • 充电曲线法
• 电位扫描法
氢原子的吸附
• 氢的吸附过程伴随有氢分子的分解,分解 生成的氢原子与金属表面相互作用而形成 吸附键。吸附氢原子与吸附自由氢原子是 不同的,吸附过程放出大量吸附热,吸附 氢原子的能量低得多。
氧原子的吸附
• 在常温下,主要是氧原子和含氧粒子的吸 附。这些含氧粒子是在逐步还原或OH-逐步 氧化过程形成并吸附的。
若保持电位恒定,并保持i组分外的化学势不变
i
(
i
) ,ki
负离子可逆,正离子表面剩余电荷量
(
Ina
)
1
正离子离子可逆,负离子表面剩余电荷量
( Ina
)
1
求解表面剩余电荷量的步骤
• 1.测量不同电解质浓度的电毛细曲线 • 2.从各条电毛细曲线下取同一相对电位下的
• 值,做出 ~ Ina 关系曲线。
双电层电位由紧密层电位差和分散层电位差
• 影响:改变电极上双电层的分布,从而影 响反应粒子在电极表面的浓度和活化能, 使反应速率发生变化
一、无机离子的吸附
• 1.大多数无机阴离子是表面活性物质,而无 机阳离子的表面活性很小,只有少数离子 才表面活性。
表面张力变化原因
• 无论双电层是带正电还是带负电,由于同 性电荷的相互排除使界面有扩大的趋势, 与表面张力使界面缩小的趋势相反。因此, 带电界面比不带电界面表面张力下。而剩 余电荷密度与电势有关,故表面张力与电 势有关。
二、电毛细曲线的微分方程
• 根据吉布斯等温吸附方程
d id i
i
电子的表面吸附量 e q / F
• 常用的方法: • 充电曲线法
• 电位扫描法
氢原子的吸附
• 氢的吸附过程伴随有氢分子的分解,分解 生成的氢原子与金属表面相互作用而形成 吸附键。吸附氢原子与吸附自由氢原子是 不同的,吸附过程放出大量吸附热,吸附 氢原子的能量低得多。
氧原子的吸附
• 在常温下,主要是氧原子和含氧粒子的吸 附。这些含氧粒子是在逐步还原或OH-逐步 氧化过程形成并吸附的。
若保持电位恒定,并保持i组分外的化学势不变
i
(
i
) ,ki
负离子可逆,正离子表面剩余电荷量
(
Ina
)
1
正离子离子可逆,负离子表面剩余电荷量
( Ina
)
1
求解表面剩余电荷量的步骤
• 1.测量不同电解质浓度的电毛细曲线 • 2.从各条电毛细曲线下取同一相对电位下的
• 值,做出 ~ Ina 关系曲线。
双电层电位由紧密层电位差和分散层电位差
界面化学ppt课件

序言 表面吉布斯自由能和表面张力 液-固、液-液界面现象 弯曲表面下的附加压力和蒸气压 溶液的表 面吸附 表面活性剂及其应用 固体表面的吸附
序言
1. 界面、界面现象
界面 ─ 物体表面与非本物体的另一个相的表面相接触的交界面 表面 ─ 物体对真空或与本体蒸气相接触的面
界面现象 ─ 处于界面上的物质由于具有与本体相内部不同的结
等温、等压条件下,将具有单位表面积的固体可逆地浸入液体中所作的最大功称为浸湿功,它 是液体在固体表面取代气体能力的一种量度。
终态
等温、等压条件下,单位面积的液固界面取代了单位面积的气固界面并产生了单位面积的气液 界面,这过程表面自由能变化值的负值称为铺展系数,用S表示。
2. 接触角与润湿作用
平衡时 γs-g=γs-l+γl-g cosθ
构和性质而产生的各种物理、化学现象 ?
2.
研究界面现象
X=X体
(表面积小)
X=X体+X表
(表面积大)
3. 分散程度的表示方法
形状规则微粒:
直径;
多孔物质:
比表面
A0∕m-1=
A s
VA
A0∕m2 ·kg-1 =
s
m
1kg SiO2
A=0.26 m2
E表=0.27J
A=2.6×106 m2
E表=2.7 ×106 J
cosθ=
sg sl lg
Young方程
① 180 ≥θ≥90时 -1≤cosθ≤0, γs-g<γs-l
液体难润湿固体表面,当θ=180时,液体完全不润湿固体表面
② 0 ≤ θ<90时, 0<cosθ≤1 γs-g>γs-l 液体能润湿固体表面,当θ=0时,液体完全润湿固体表面 ③ 当 γl-g<(γs-g-γs-l) 液体在固体表面上铺展
序言
1. 界面、界面现象
界面 ─ 物体表面与非本物体的另一个相的表面相接触的交界面 表面 ─ 物体对真空或与本体蒸气相接触的面
界面现象 ─ 处于界面上的物质由于具有与本体相内部不同的结
等温、等压条件下,将具有单位表面积的固体可逆地浸入液体中所作的最大功称为浸湿功,它 是液体在固体表面取代气体能力的一种量度。
终态
等温、等压条件下,单位面积的液固界面取代了单位面积的气固界面并产生了单位面积的气液 界面,这过程表面自由能变化值的负值称为铺展系数,用S表示。
2. 接触角与润湿作用
平衡时 γs-g=γs-l+γl-g cosθ
构和性质而产生的各种物理、化学现象 ?
2.
研究界面现象
X=X体
(表面积小)
X=X体+X表
(表面积大)
3. 分散程度的表示方法
形状规则微粒:
直径;
多孔物质:
比表面
A0∕m-1=
A s
VA
A0∕m2 ·kg-1 =
s
m
1kg SiO2
A=0.26 m2
E表=0.27J
A=2.6×106 m2
E表=2.7 ×106 J
cosθ=
sg sl lg
Young方程
① 180 ≥θ≥90时 -1≤cosθ≤0, γs-g<γs-l
液体难润湿固体表面,当θ=180时,液体完全不润湿固体表面
② 0 ≤ θ<90时, 0<cosθ≤1 γs-g>γs-l 液体能润湿固体表面,当θ=0时,液体完全润湿固体表面 ③ 当 γl-g<(γs-g-γs-l) 液体在固体表面上铺展
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
回主目录
第三章
凝聚相界面
3.3 二组分凝聚相界面性质 3.3.1 铺展系数
表3.2 水面上几种液体的铺展系数(20℃) 一般:低表面张力的液体可以在高表面张力的液体上铺展。 S S 液 体 液 体 通常:界面张力小于表面张力,当小到可以忽略的时候,则有 44.0 3.8 异戊醇 -σB。(可直接判断) 硝基苯 S=σw 例如:σW=72.8mN/m,σB=28.3 mN/m ,
上一内容 下一内容 回主目录 返回
2013-8-11
第三章
凝聚相界面
3.3 二组分凝聚相界面性质 3.3.3 表面活性剂对σab的影响
活性剂的亲油亲水性不同,在界面上的存在状态也不同, 因此,对σab的影响也有很大差别。 (1)油溶性活性剂可促进油在水面上的铺展
例如:油酸可降低σ油/水、σ油,使得 S = σ水-(σ油+ σ油/水)>0 S变大,可把油酸加入油漆中,涂于亲水表面, 制备亲油表面。
σ 正己烷 =σ 正己烷 d, σHg = σHgd +σHgm, σH2O = σH2Od +σH2Oh
对于Hg-正己烷界面:
σ
Hg/正己烷
=σ
Hg +σ
正己烷
d d -2 Hg 正己烷
代入已知数据,得 σHgd = 210mJ/m2; σHgm = 274 mJ/m2 对于H2O-正己烷界面:
②作用力与分子间距离的七次方成反比;
③作用力可越过相界面,这与特性①有关,即使是不同性质的 分子之间,也存在瞬间偶极作用。
上一内容
下一内容
回主目录
返回
2013-8-11
第三章
凝聚相界面
3.2 纯液体间的界面自由能
聚集状态不同,分子间受力也不同,因此,相接触的两相间 界面自由能必然发生变化。 Fowkes:液-液界面的自由能,来自于分子间各种作用力之和,包 括色散力和偶极力等; 不同液体中,起主导作用的分子间力的形式不同。 ①非极性液体(如饱和烃)不存在永久偶极,其分子间以 及与 其它物质分子间只有色散力; ②极性物质分子(如H2O)间,除色散力之外还有偶极力; ③金属(如Hg)原子间除色散力外,还有金属键力。 注意:色散力对其它类型的分子间力几乎没有影响,它不妨碍 分子间各种力的加和。 如:水表面张力σH2O=色散力σH2Od+氢键力σH2Oh; 水银的表面张力σHg=色散力σHgd+金属键力σHgm
σd(mN/m) 18.4 己 烷 18.4 20.2 28.5
σ
二甲基硅酮1 12 氢碳润滑剂 甲苯
19.0 16.9±0.5 =σ -σ 2(Antonow 法则) 14.0±0.2 28.5
正十六烷 σ 12= 1 ( 甲基萘 磷酸三甲苯酯 甲酰胺
27.6 27.6 (Girifalco-Good 法则) 2) 36.4 36.4
σB、σB/w收缩液滴,σw铺展液滴,三力 相较量,必将影响液滴的形状。
即:σw-(σB + σB/w)>0时,铺展
σw-(σB + σB/w)<0时,收缩
令σw-(σB + σB/w)= S(铺展系数) 则:S>0时,B在W上铺展 S<0时,B在W上收缩
返回
2013-8-11
回主目录
返回
2013-8-11
第三章
凝聚相界面
3.2 纯液体间的界面自由能
例:已知20℃时, 2 2 2 Hg = 484 mJ/m ,σH2O = 72.8 mJ/m ,σ正己烷 = 18.4 mJ/m , σ 2 正己烷与Hg形成界面,σHg/正己烷 = 378 mJ/m ; 2 正己烷与水形成界面,σH2O/正己烷 = 51.1 mJ/m 。 d m d h 试计算σHg 、σHg 和σH2O 、σH2O 。 解:据Fowkes公式,
σ
上一内容
H2O/正己烷
=σ
H2O +σ
正己烷
d d -2 H 2O 正己烷
代入已知数据,得σH2Od = 21.8mJ/m2, σH2Oh = 51.0mJ/m2
下一内容 回主目录 返回
2013-8-11
第三章
凝聚相界面
d
3.2 纯液体间的界面自由能
表3.1 某些常用液体的σ和σ 值 σ(mN/m) 液 体 此外,计算界面张力的经验式:
上一内容 下一内容 回主目录 返回
2013-8-11
第三章
凝聚相界面
3.2 纯液体间的界面自由能
饱和碳氢化合物分子之间只有色散力σd,同时,它与其它分子之 间的作用力也只有色散力。故而,在确定更复杂的分子间力对表面 张力的贡献时,常以饱和烃作为基准物。 设:水和烃单独与空气接触时的表 面张力为σ1和σ2 。 烃水接触后,l-l 取代g-l界面。 由于水与烃间相互作用,σ1和 σ2皆下降。 下降值分别为σ1-2和σ2-1
2013-8-11
第三章
凝聚相界面
主要内容
3.1 凝聚相界面之间的作用力——色散力 3.2 纯液体间的界面自由能
3.3 二组分凝聚相界面性质 3.4 液/固界面的润湿与铺展
3.5 润湿的应用
上一内容
下一内容
回主目录
返回
2013-8-11
第三章
凝聚相界面
3.1 凝聚相界面之间的作用力——色散力
讨论: a Wc a a (1)当Wc>Wa时: 2σa· > (σa + σb)A - σabA A
S =σb-σa-σab <0 则a在b上不铺展
(2)若Wc<Wa时: 2σa· < (σa + σb)A - σabA A S = σb-σa-σab > 0 则a在b上铺展
返回
2013-8-11
界面张力是由分子间吸引力引起的,深入了解其本质,有助于 认识分子间相互作用的基本性质。 静电力是以电场为 分子间作用力 ①分子间斥力:电子云、原子核; ②分子间吸力: 永久偶极作用力(静电力,Keesom力);
分子相互靠拢 时,它们的瞬 时偶极矩之间 会产生很弱的 吸引力
媒介传递的,即带 电体在其周围产生 电场,电场对置于 其中的另一带电体 施以作用力, 库仑定律。
庚醛 正辛醇 35.7 32.2 己烷 3.4 0.2
油酸
S = σW-σB >024.6
10.1 9.3 6.8 9.4
下一内容 回主目录
庚烷(30℃)
二溴乙烯
二硫化碳 碘代苯 溴仿 二碘甲烷
返回
-3.2
-3.3 -8.2 -8.7 -9.6 -26.5
2013-8-11
壬酸乙酯 对位百里烯 苯 甲苯 异戊烷
a
a
b
Wa b
图3.3 内聚功与粘附功示意
上一内容 下一内容 回主目录
第三章
凝聚相界面
3.3 二组分凝聚相界面性质 3.3.2 内聚功与粘附功
注意:若两种液体间有互溶性,则σ为平衡后的表面张力值。 例如: 苯在水面上先铺展,后收缩成透镜—— 开始时: S = σH2O-(σ苯 + σ苯/水) = 72.8-(28.9 + 35.0) = 8.9>0,铺展; 平衡时: S’ = σ’H2O-(σ’苯 + σ苯/水) = 62.2-(28.8 + 35.0) = -1.6<0,不铺展。
σ
12=σ 1 +σ
2
d d -2 2 1
上一内容
下一内容
回主目录
返回
2013-8-11
第三章
凝聚相界面
3.2 纯液体间的界面自由能 评价分子间力对液体表面自由能贡献的定量方法
(1)饱和烃2与水1组成界面,对于饱和烃而言,σ2 =σ2d,通过仪 器测定σ12和σ1、σ2,通过Fowkes公式计算σ1d,确定水的色散力对 表面自由能(或表面张力)的贡献; (2)液体的表面张力系其色散力、偶极力等多种因素贡献之和, 可求得水的偶极力对表面张力的贡献; (3)其它:如Hg等液体,亦可用类似的方法求出各力的贡献。
S>0时,铺展过程的自由能自动降低(<0),铺展自动进行。
上一内容 下一内容 回主目录 返回
2013-8-11
第三章
凝聚相界面
3.3 二组分凝聚相界面性质 3.3.2 内聚功与粘附功
Wc
a ①分割一液体,产生两新界面,表面积 增加,外力对体系做功—过程非自发。
a
a
做功抵消该液体分子间内聚力,称内聚 功Wc(相反过程自发进行,△G<0)。 Wc = 2σa· A
上一内容 下一内容 回主目录
σw、σB、σB/w分别表示水 、苯、水/苯体系界面张力 ,并将其视为沿相界面展 开的力。
返回
2013-8-11
第三章
凝聚相界面
3.3 二组分凝聚相界面性质 3.3.1 铺展系数
平衡时: σw = σB· cosθ + σB/w· cosφ 又:晶状液滴很薄, 可认为:θ = φ = 0 则上式可简化:σw = σB + σB/w
2
40.9 58.2
39.2±4 39.5±7
甘油
水
63.4
72.8
37.0±4
21.8±0.7
上一内容
下一内容
回主目录
返回
2013-8-11
第三章
凝聚相界面
3.3 二组分凝聚相界面性质 3.3.1 铺展系数
在水面上加一滴微溶或不溶于水的某种纯液体时,则液 滴可能出现三种情况: ①铺展 仍与界面张力有关 ②不铺展 ③先铺展后收缩 以苯-水体系为例加以讨论: 在洁净的水面上加一滴苯,初 时迅速铺展,继续滴加则又收 缩,最后,变成凸透镜形状而 浮于水面上(见图)。
第二章
纯液体的界面现象
内容回顾
2.1 表面张力与表面自由能 2.2 表面自由能的物理意义 2.3 影响表面自由能(或表面张力)的因素 2.4 弯曲界面两侧压力差与毛细管力 Laplace公式 Kelvin公式 Ostwald现象 2.5 测量表面(界面)张力的方法
