初三化学复习物质转化之三角关系
化学三角转化关系

化学三角转化关系一、酸碱中的中和反应酸碱中的中和反应是一种常见的化学转化关系。
当酸和碱混合时,产生盐和水的反应称为中和反应。
例如,将盐酸和氢氧化钠混合,会生成氯化钠和水。
这个反应过程中,酸和碱分别失去了H+离子和OH-离子,生成了水分子。
这种反应在我们日常生活中很常见,比如当我们喝柠檬汁时,柠檬汁中的酸会与口腔中的碱性物质中和,产生水和盐。
二、氧化还原反应氧化还原反应是化学反应中的重要类型之一。
在氧化还原反应中,物质中的原子氧化态和还原态发生变化,同时伴随着电子的转移。
例如,金属与非金属氧化物反应生成盐的过程中,金属原子失去电子变成阳离子,非金属氧化物原子得到电子变成阴离子。
这种反应在燃烧、腐蚀等过程中都有应用。
例如,当铁与氧气反应时,铁原子氧化成铁离子,氧气还原成氧离子,生成了氧化铁。
三、酯化反应酯化反应是一种酸催化的化学反应,常用于合成酯。
酯是一类含有酯基的有机化合物,其分子中含有羰基和氧原子。
酯化反应一般是酸催化的醇和酸反应生成酯和水。
例如,乙醇和乙酸反应生成乙酸乙酯和水。
酯化反应在食品、香料、涂料等领域有广泛的应用。
比如,水果中的香味主要来自于酯类物质。
四、聚合反应聚合反应是一种将小分子单体通过共价键连接起来形成高分子化合物的反应。
在聚合反应中,单体分子中的双键或三键被打开,形成新的共价键,从而形成高分子链。
例如,乙烯分子经过聚合反应可以形成聚乙烯链。
聚合反应在合成塑料、纤维等材料中起着重要作用。
五、水解反应水解反应是一种化合物与水反应生成两个或多个新的化合物的反应。
在水解反应中,水分子中的氢离子和水解物中的某个原子或基团发生置换,生成新的化合物。
例如,脂肪酸与水反应生成酸和醇。
水解反应在生物体内的消化过程中起着重要作用。
通过以上几种常见的化学转化关系,我们可以看到化学在物质变化中起着重要的作用。
通过不同的反应类型,我们可以合成新的化合物,改变物质的性质和用途。
化学转化关系的研究对于我们理解物质的本质和改进化学工艺具有重要的意义。
初三化学复习物质转化之三角关系

汇报人:XX
目录
• 物质转化基本概念与原理 • 酸碱盐之间转化关系 • 氧化物、单质和化合物之间转化 • 有机物之间转化关系 • 无机物之间转化关系 • 总结归纳与提高训练
01
物质转化基本概念与原理
物质转化定义及意义
物质转化是指物质之间通过化学反应 相互转化的过程。
典型例题解析与练习
• 练习:下列各组物质在溶液中能大量共存且形成无色 溶液的是( )
• A. NaCl CaCl2 Na2CO3 B. KNO3 HCl Ca(OH)2 • C. H2SO4 FeCl3 NaNO3 D. NaOH HNO3 NH4Cl • 解析:A项中$Na{2}CO{3}$和$CaCl{2}$能发生复分
结构
有机物的结构复杂多样,包括链状、 环状、支链等结构。碳原子之间可以 形成单键、双键和三键,构成不同的 官能团。
有机物之间反应类型及特点
取代反应
有机物分子中的某些原子或原子团被其他原 子或原子团所取代的反应。例如,卤代烃的
水解反应、酯化反应等。
加成反应
有机物分子中加入氧或失去氢的反应。例如 ,醇的氧化生成醛或酮,烯烃的氧化生成环
02
官能团转化
利用有机物的官能团转化规律 ,设计合理的合成路线。例如 ,通过酯化反应将醇转化为酯 ,通过硝化反应将苯转化为硝 基苯等。
03
保护与去保护策略
在合成过程中,对某些敏感官 能团进行保护,以避免不必要 的副反应发生。在合成完成后 ,再通过去保护步骤恢复官能 团的活性。
04
绿色合成策略
在合成过程中,尽量使用环保 的原料和试剂,减少废弃物的 产生和排放,提高合成的原子 经济性。
化剂等。
初中化学重点复习系列8-化学转换三角及推断
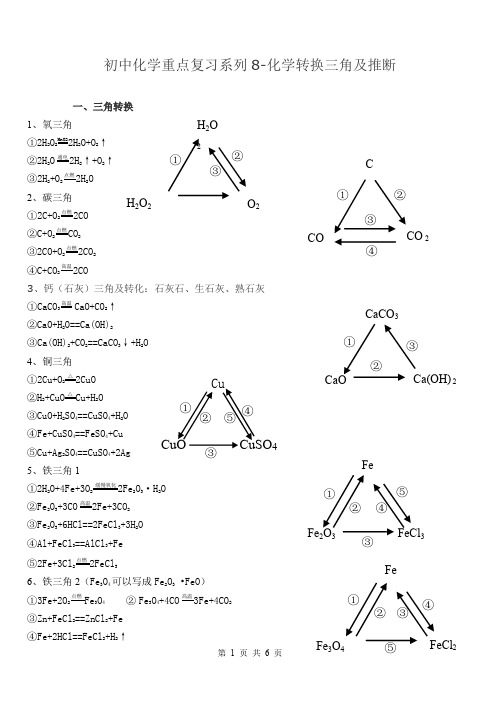
①②③H 2O2H 2O 2O 2O u C Cu4O S u C ①②⑤④③C COCO 2①②④③CaOCa(OH)2CaCO 3①②③①②⑤④③FeFe 2O 3FeCl 3Fe①②④③初中化学重点复习系列8-化学转换三角及推断一、三角转换1、氧三角 ①2H 2O 2MnO22H 2O+O 2↑ ②2H 2O通电2H 2↑+O 2↑ ③2H 2+O 2点燃2H 2O2、碳三角 ①2C+O 2点燃2CO②C+O 2点燃CO 2③2CO+O 2点燃2CO 2④C+CO 2高温2CO3、钙(石灰)三角及转化:石灰石、生石灰、熟石灰 ①CaCO 3高温CaO+CO 2↑②CaO+H 2O==Ca(OH)2 ③Ca(OH)2+CO 2==CaCO 3↓+H 2O 4、铜三角 ①2Cu+O 2 △2CuO②H 2+CuO△Cu+H 2O③CuO+H 2SO 4==CuSO 4+H 2O ④Fe+CuSO 4==FeSO 4+Cu ⑤Cu+Ag 2SO 4==CuSO 4+2Ag 5、铁三角1 ①2H 2O+4Fe+3O 2 缓慢氧化2Fe 2O 3·H 2O②Fe 2O 3+3CO高温2Fe+3CO 2③Fe 2O 3+6HCl==2FeCl 3+3H 2O ④Al+FeCl 3==AlCl 3+Fe ⑤2Fe+3Cl 2点燃2FeCl 36、铁三角2(Fe 3O 4可以写成Fe 2O 3 •FeO ) ①3Fe+2O 2点燃Fe 3O 4 ② Fe 3O 4+4CO高温3Fe+4CO 2③Zn+FeCl 2==ZnCl 2+Fe ④Fe+2HCl==FeCl 2+H 2↑H 2SO 4HClHNO 3/CO 2①②④③Ca(OH)2NaOH Cu(OH)2/NH 3①②④③Na 2CO 3Na 2SO 4NaCl/NaNO 3CaCO 3CaCl 2Ca(NO 3)2①②③⑤Fe 3O 4+8HCl==2FeCl 3+FeCl 2+4H 2O 7、酸三角①H 2SO 4+BaCl 2==BaSO 4↓+2HCl ②HCl+AgNO 3==AgCl ↓+HNO 3③H 2SO 4+Ba(NO 3)2==BaSO 4↓+2HNO 3 ④Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ 8、碱三角①Ca(OH)2+Na 2CO 3==CaCO 3↓+2NaOH ②2NaOH+CuSO 4==Cu(OH)2↓+Na 2SO 4 ③Ca(OH)2+CuSO 4==Cu(OH)2↓+CaSO 4 ④Ca(OH)2+(NH 4)2SO 4==CaSO 4+2H 2O+2NH 3↑ 9、盐三角1①Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ ②Na 2SO 4+BaCl 2==BaSO 4↓+2NaCl ③Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ ④Na 2CO 3+2HNO==2NaNO 3+H 2O+CO 2↑ 10、盐三角2①CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ ②CaCl 2+2AgNO 3==2AgCl ↓+Ca(NO 3)2 ③CaCO 3+2HNO 3==Ca(NO 3)2+H 2O+CO 2↑ 外一:我们身边 的物质总转变② ① ⑧ ⑨ ⑥ ⒀⒁③ ④ ⑦ ⒂⑤ ⑩ ⑾⑿①2KMnO 4 △K 2MnO 4+MnO 2+O 2↑②2H 2O 2MnO22H 2O+O 2↑ ③2H 2O通电2H 2↑+O 2↑ ④2H 2+O 2点燃2H 2O ⑤3Fe+2O 点燃Fe 3O 4⑥C+O 2点燃CO 2⑦6CO 2+6H 2O 叶绿素光照C 6H 12O 6+6O 2O 2Fe 3O 4 H 2CO 3 COCO 2 CaCO 3H 2OH 2O 2KMnO4⑧H2CO3△H2O+CO2↑⑨CO2+H2O==H2CO3⑩Ca(OH)2+CO2=CaCO3↓+H2O ⑾CaCO3高温CaO+CO2↑⑿CaCO3+2HCl=CaCl2+H2O+CO2↑⒀3CO+Fe2O高温2Fe+3CO2⒁2CO+O2点燃2CO2⒂C+CO2高温2CO二、推断题解题思路1、阅读题目:要求通阅全题,统领大局。
初中化学 化学转换三角及推断

①②③H 2O2H 2O 2O 2O u C Cu4O S u C ①②⑤④③C COCO 2①②④③CaOCa(OH)2CaCO 3①②③①②⑤④③FeFe 2O 3FeCl 3FeFe 3O 4FeCl 2①②⑤④③初中化学 化学转换三角及推断一、三角转换1、氧三角 ①2H 2O 2MnO22H 2O+O 2↑ ②2H 2O通电2H 2↑+O 2↑ ③2H 2+O 2点燃2H 2O2、碳三角 ①2C+O 2点燃2CO②C+O 2点燃CO 2③2CO+O 2点燃2CO 2④C+CO 2高温2CO3、钙(石灰)三角及转化:石灰石、生石灰、熟石灰 ①CaCO 3高温CaO+CO 2↑②CaO+H 2O==Ca(OH)2 ③Ca(OH)2+CO 2==CaCO 3↓+H 2O 4、铜三角 ①2Cu+O 2 △2CuO②H 2+CuO△Cu+H 2O③CuO+H 2SO 4==CuSO 4+H 2O ④Fe+CuSO 4==FeSO 4+Cu ⑤Cu+Ag 2SO 4==CuSO 4+2Ag 5、铁三角1 ①2H 2O+4Fe+3O 2 缓慢氧化2Fe 2O 3·H 2O②Fe 2O 3+3CO高温2Fe+3CO 2③Fe 2O 3+6HCl==2FeCl 3+3H 2O ④Al+FeCl 3==AlCl 3+Fe ⑤2Fe+3Cl 2点燃2FeCl 36、铁三角2(Fe 3O 4可以写成Fe 2O 3 •FeO ) ①3Fe+2O 2点燃Fe 3O 4 ② Fe 3O 4+4CO高温3Fe+4CO 2③Zn+FeCl 2==ZnCl 2+Fe ④Fe+2HCl==FeCl 2+H 2↑⑤Fe 3O 4+8HCl==2FeCl 3+FeCl 2+4H 2OH 2SO 4HClHNO 3/CO 2①②④③Ca(OH)2NaOH Cu(OH)2/NH 3①②④③Na 2CO 3Na 2SO 4NaCl/NaNO 3CaCO 3CaCl 2Ca(NO 3)2①②③7、酸三角①H 2SO 4+BaCl 2==BaSO 4↓+2HCl ②HCl+AgNO 3==AgCl ↓+HNO 3③H 2SO 4+Ba(NO 3)2==BaSO 4↓+2HNO 3 ④Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ 8、碱三角①Ca(OH)2+Na 2CO 3==CaCO 3↓+2NaOH ②2NaOH+CuSO 4==Cu(OH)2↓+Na 2SO 4 ③Ca(OH)2+CuSO 4==Cu(OH)2↓+CaSO 4 ④Ca(OH)2+(NH 4)2SO 4==CaSO 4+2H 2O+2NH 3↑ 9、盐三角1①Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ ②Na 2SO 4+BaCl 2==BaSO 4↓+2NaCl ③Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ ④Na 2CO 3+2HNO==2NaNO 3+H 2O+CO 2↑ 10、盐三角2①CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ ②CaCl 2+2AgNO 3==2AgCl ↓+Ca(NO 3)2 ③CaCO 3+2HNO 3==Ca(NO 3)2+H 2O+CO 2↑ 外一:我们身边 的物质总转变② ① ⑧ ⑨ ⑥ ⒀⒁③ ④ ⑦ ⒂⑤ ⑩ ⑾⑿①2KMnO 4 △K 2MnO 4+MnO 2+O 2↑ ②2H 2O 2MnO22H 2O+O 2↑ ③2H 2O通电2H 2↑+O 2↑④2H 2+O 2点燃2H 2O⑤3Fe+2O 点燃Fe 3O 4 ⑥C+O 点燃CO 2⑦6CO 2+6H 2O 叶绿素光照C 6H 12O 6+6O 2 ⑧H 2CO 3△H 2O+CO 2↑⑨CO 2+H 2O==H 2CO 3⑩Ca(OH)2+CO 2=CaCO 3↓+H 2OO 2Fe 3O 4 H 2CO 3 COCO 2 CaCO 3H 2OH 2O 2KMnO4⑿CaCO3+2HCl=CaCl2+H2O+CO2↑⒀3CO+Fe2O3高温2Fe+3CO2 ⒁2CO+O点燃2CO2⒂C+CO2高温2CO⑾CaCO3高温CaO+CO2↑二、推断题解题思路1、阅读题目:要求通阅全题,统领大局。
初中化学 化学转换三角及推断

初中化学化学转换三角及推断化学转换三角是一种直观的化学反应表示方法,它用不同的物质或元素符号来表示化学反应中物质的转换关系。
这个三角形可以清晰地展示出化学反应中各物质之间的相互转化关系。
推断题是初中化学考试中常见的一种题型,它通过给出一些化学反应的条件和结果,让考生推断出未知的反应物或生成物。
这种题型需要考生对化学反应有深入的理解和掌握,同时具备分析问题和解决问题的能力。
化学转换三角可以帮助考生在推断题中快速找到突破口。
例如,对于一个包含多种物质的推断题,我们可以通过分析化学转换三角来确定哪些物质之间可能发生反应,从而缩小可能的答案范围。
我们还可以通过观察化学转换三角中物质的分布情况,推断出反应的类型和反应条件等重要信息。
熟练掌握常见的化学反应类型和反应条件,以便在解题时能够迅速联想到相关的反应。
注意题目中给出的反应条件和结果,从中提取关键信息,如颜色变化、沉淀生成等。
尝试从已知的反应中找出规律,以便在未知的反应中找到对应的规律。
对于一些难以确定的物质,可以通过化学转换三角来分析其可能的性质和反应类型。
已知A、B、C、D、E五种物质,它们之间存在如下的化学转换关系:现知A是一种碱,B是一种盐,C是一种金属单质,D是一种非金属单质,E是一种酸。
根据上述信息,推断出A、B、C、D、E、F、G、H、I、J分别是什么物质。
A与B反应生成C和D,由于A是一种碱,B是一种盐,因此可以推断出这是一个碱与盐之间的复分解反应。
结合给出的反应条件和结果,可以推断出C可能是沉淀物或气体,D是非金属单质。
C与E反应生成A和F,由于E是一种酸,可以推断出这是一个金属与酸之间的反应。
结合给出的反应条件和结果,可以推断出F是一种盐。
B与E反应生成G和H,由于E是一种酸,可以推断出这是一个盐与酸之间的反应。
结合给出的反应条件和结果,可以推断出G和H可能是沉淀物或气体。
F与H反应生成I和J,由于F是一种盐,H是一种非金属单质,可以推断出这是一个盐与非金属单质之间的反应。
初三化学三角关系化学方程式及反应类型总结
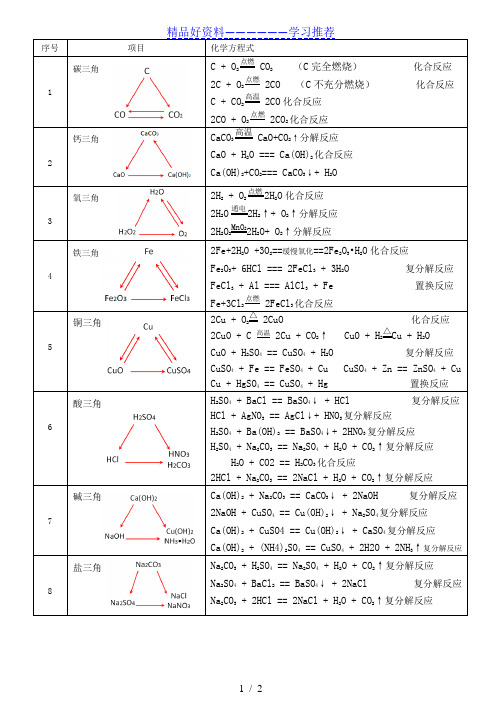
序号项目化学方程式1 碳三角 C + O2点燃 CO2(C完全燃烧)化合反应2C + O2点燃 2CO (C不充分燃烧)化合反应C + CO2高温 2CO化合反应2CO + O2点燃 2CO2化合反应2 钙三角CaCO3高温CaO+CO2↑分解反应CaO + H2O === Ca(OH)2化合反应Ca(OH)2+CO2=== CaCO3↓+ H2O3 氧三角2H2 + O2点燃2H2O化合反应2H2O通电2H2↑+ O2↑分解反应2H2O2MnO22H2O+ O2↑分解反应4 铁三角2Fe+2H2O +3O2==缓慢氧化==2Fe2O3•H2O化合反应Fe2O3+ 6HCl === 2FeCl3 + 3H2O 复分解反应FeCl3 + Al === AlCl3 + Fe 置换反应Fe+3Cl2点燃 2FeCl3化合反应5 铜三角2Cu + O2△ 2CuO 化合反应2CuO + C 高温 2Cu + CO2↑ CuO + H2△Cu + H2OCuO + H2SO4 == CuSO4 + H2O 复分解反应CuSO4 + Fe == FeSO4 + Cu CuSO4 + Zn == ZnSO4 + CuCu + HgSO4 == CuSO4 + Hg 置换反应6 酸三角H2SO4 + BaCl == BaSO4↓ + HCl 复分解反应HCl + AgNO3 == AgCl↓+ HNO3复分解反应H2SO4 + Ba(OH)2 == BaSO4↓+ 2HNO3复分解反应H2SO4 + Na2CO3 == Na2SO4 + H2O + CO2↑复分解反应H2O + CO2 == H2CO3化合反应2HCl + Na2CO3 == 2NaCl + H2O + CO2↑复分解反应7 碱三角Ca(OH)2 + Na2CO3 == CaCO3↓ + 2NaOH 复分解反应2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4复分解反应Ca(OH)2 + CuSO4 == Cu(OH)2↓ + CaSO4复分解反应Ca(OH)2 + (NH4)2SO4 == CuSO4 + 2H2O + 2NH3↑复分解反应8 盐三角Na2CO3 + H2SO4 == Na2SO4 + H2O + CO2↑复分解反应Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl 复分解反应Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑复分解反应9 盐三角CaCO3 + 2HCl == CaCl2 + H2O + CO2↑复分解反应CaCl2 + 2AgNO3 == 2ACl↓ + Ca(NO3)2复分解反应CaCO3 + 2HNO3 == Ca(NO3)2 + H2O + CO2↑复分解反应。
化学方程式里的三角

化学方程式里的三角
三角在化学方程式中表示反应物和生成物之间的相互作用关系。
它是一种用于表示化学反应的符号,通常用箭头表示。
化学方程式是描述化学反应的方式,其中包括反应物、生成物以及它们之间的转化关系。
三角箭头则用来表示反应的方向和转化的过程。
在化学方程式中,三角箭头的指向通常从反应物指向生成物。
箭头的方向表示反应的进行方向,从左到右表示反应是正向进行的,反之则表示反应是逆向进行的。
例如,考虑以下化学方程式:2H2 + O2 -> 2H2O
这个方程式表示了氢气和氧气反应生成水的过程。
箭头指向右侧,表示反应是正向进行的。
反应物是氢气和氧气,生成物是水。
三角箭头在化学方程式中的使用有以下几个作用:
1.指示反应的方向:箭头的指向表示反应是正向进行的还是逆向进行的。
正向反应是指反应物转化为生成物的过程,逆向反应是指生成物转化为反应物的过程。
2.描述化学反应的转化过程:箭头连接了反应物和生成物,表示它们之间发生了化学转化。
箭头的存在使得化学方程式更加明确和具体。
3.表示反应的速率:箭头的方向还可以表示反应的速率。
正向箭头表示反应速率较快,而逆向箭头表示反应速率较慢。
4.表示反应的平衡:当箭头指向双箭头时,表示反应是可逆的,可以同时进行正向和逆向反应。
双箭头中间的等号表示反应处于动态平衡状态。
总的来说,三角箭头在化学方程式中起到了指示反应方向、描述反应转化过程和表示反应速率等作用。
它是化学方程式中不可或缺的一部分,帮助我们理解化学反应的过程和特点。
化学三角转化关系

化学三角转化关系:怎样理解化学式中的各
种参数
化学三角转化关系是化学中十分重要且基础的概念之一。
它指的是通过解决化学式中的一些参数,如物质的摩尔质量、元素的质量、元素的分子数和物质的分子数等,来实现物质之间的化学计算和转化。
以下是具体内容:
1.摩尔质量:它是指相对分子质量、相对分子量或相对原子质量等数据,单位为g/mol。
它在计算化学式、制定反应方程、计算物质数量、反应物质的数量、浓度等方面都极为重要。
2.元素的质量:它是指元素的相对原子质量乘以该元素的摩尔分数,单位为g。
它可以用于计算分子中各元素的含量,推导出某个物质的化学式等。
3.元素的分子数:它是指分子量为1mol时,分子中该元素的个数,单位为个分子。
元素的分子数在确定比值关系和研究反应偏向性等领域具有很高的实用性。
4.物质的分子数:它是指物质摩尔质量与质量的比值,单位为mol。
它可用于计算化学反应中物质的数量,根据量的关系推导出相应的反应量等。
综合以上四个参数,可以实现化学计算和各种物质的转化。
例如,通过计算一个物质的摩尔质量,我们可以推导出该物质中每个元
素的质量和元素的分子数。
通过计算物质的分子数和反应的摩尔比,我们可以计算出反应的各种物质的数量,从而实现反应的制备和计算。
总之,化学三角转化关系中的各参数是化学研究与实践必不可少的一环,学生在认真掌握的基础上,可以更好地理解和应用化学。
