高中化学:乙醇和乙酸的化学性质
《乙醇和乙酸》课件

乙酸的化学性质
乙酸具有酸性,是一种有机酸 ,可以与碱反应生成盐和水。
乙酸可以发生酯化反应,生成 乙酸酯。
乙酸可以与金属反应,生成金 属盐和氢气。
乙酸的用途
乙酸是制造醋酸盐、醋酸纤维素 、乙酸酯等化合物的原料。
乙酸可以用作溶剂、防腐剂、消 毒剂等。
乙酸在化学实验中常用作有机合 成中的酸性催化剂。 Nhomakorabea03
《乙醇和乙酸》ppt课件
目录
• 乙醇的介绍 • 乙酸的介绍 • 乙醇和乙酸的关系 • 乙醇和乙酸的生产方法 • 乙醇和乙酸的安全与环保
01
乙醇的介绍
Chapter
乙醇的物理性质
乙醇是一种无色透明、易燃的液体,具有特殊的气味和 口感。
乙醇的沸点为78.5℃,熔点为-114℃,相对密度为0.789 (水=1)。
05
乙醇和乙酸的安全与环保
Chapter
乙醇和乙酸的安全性
乙醇的安全性
乙醇是一种易燃易爆的物质,遇明火、高热或与氧化剂接触,有引起燃烧爆炸 的危险。因此,在生产、储存和使用过程中,需要采取相应的安全措施,如远 离火源、保持通风、定期检查等。
乙酸的安全性
乙酸是一种具有刺激性和腐蚀性的物质,对人体和环境有一定的危害。在使用 过程中,需要穿戴防护服、手套、眼镜等个人防护措施,并确保工作场所的通 风良好。
发酵法 乙烯水合法 生物质发酵法 生物质热裂解法
利用淀粉质或糖蜜等含糖物质, 通过发酵和蒸馏提取乙醇。
利用生物质(如废弃物、农作物 残余等)通过发酵产生乙醇。
乙酸的生产方法
01
乙醛氧化法
将乙醛与氧气在催化 剂作用下进行氧化反 应,生成乙酸。
02
乙炔水合法
利用乙炔和水在催化 剂作用下反应生成乙 酸。
高中化学乙醇和乙酸知识点

高中化学知识点:乙醇和乙酸1. 乙醇的性质和制备方法乙醇是一种有机化合物,化学式为C2H5OH。
它是常见的酒精,常用作溶剂和消毒剂。
乙醇具有以下性质:•乙醇是一种无色、具有刺激性气味的液体,在常温下易挥发。
•它可与水混溶,形成不同浓度的醇溶液。
•乙醇具有酸碱性,可与碱反应生成乙醇盐。
乙醇的制备方法主要有两种:1.1 从蔗糖发酵制备乙醇蔗糖(C12H22O11)在酵母的催化下发生发酵反应,生成乙醇和二氧化碳。
这是制备乙醇的常见方法,也是酿酒的过程。
反应方程式:蔗糖 + 酵母→ 乙醇 + 二氧化碳1.2 从乙烯水合制备乙醇乙烯(C2H4)与水在催化剂存在下进行加成反应,生成乙醇。
这是一种工业上常用的制备乙醇的方法。
反应方程式:乙烯 + 水→ 乙醇2. 乙酸的性质和制备方法乙酸是一种无色液体,化学式为CH3COOH。
它是一种常见的有机酸,常用作食品添加剂和工业原料。
乙酸具有以下性质:•乙酸具有刺激性气味,并有酸味。
•它是一种极易挥发的液体,在常温下能与空气快速溶合。
•乙酸可溶于水,形成酸性溶液。
乙酸的制备方法主要有两种:2.1 从乙醇氧化制备乙酸乙醇通过催化剂的氧化反应,生成乙酸和水。
这是一种常见的制备乙酸的方法。
反应方程式:乙醇 + 氧气→ 乙酸 + 水2.2 从乙烯羧化制备乙酸乙烯与过氧化物反应,生成乙酸。
这是另一种制备乙酸的方法。
反应方程式:乙烯 + 过氧化物→ 乙酸3. 乙醇和乙酸的应用3.1 乙醇的应用乙醇具有广泛的应用领域:•作为溶剂:乙醇是一种常用的溶剂,在化学实验室和工业生产中被广泛使用。
•化妆品和个人护理产品:乙醇常用于制造香水、口红和洗手液等化妆品和个人护理产品。
•燃料:乙醇可以用作燃料,例如乙醇汽油用于汽车等内燃机的燃料。
•酿酒:乙醇是酒精的主要成分,用于酿造各种酒类。
3.2 乙酸的应用乙酸也有广泛的应用:•食品添加剂:乙酸可用作食品的酸味剂和防腐剂。
•化学品生产:乙酸是合成其他有机化合物的重要原料,例如合成纤维素醋酸纤维。
乙醇 乙酸

乙醇乙酸⑴乙醇①乙醇的分子结构:乙醇的分子式C2H6O,结构式,结构简式CH3CH2OH或C2H5OH。
乙醇的官能团为-OH(羟基),乙醇分子结构可以看成是乙烷分子(CH3CH3)中的1个氢原子被羟基取代的产物,也可以看成是水分子(H—OH)中的1个氢原子被乙基(-C2H5)取代的产物。
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
②乙醇的化学性质:Ⅰ.氧化反应:a.可燃性:在空气中燃烧,火焰颜色为蓝色,放出大量的热量。
C2H5OH+ 3O2−−点燃2CO2+3H2Ob.催化氧化:2C2H5OH+ O22CH3CHO+2H2O 催化剂为Cu或Ag。
c.能使酸性KMnO4溶液褪色或酸性K2Cr2O7溶液变色,乙醇直接被氧化为乙酸。
Ⅱ.与金属钠的反应:金属钠置换了羟基中的氢,反应的化学方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑决定有机化合物的化学特性的原子或原子团叫做官能团。
常见的有:卤素原子(-X)、羟基(-OH)、硝基(-NO2)和碳碳双键等。
⑵乙酸①乙酸的分子结构:乙酸分子式C2H4O2,结构式为,乙酸的结构简式为CH3COOH。
②乙酸的化学性质Ⅰ.乙酸的酸性:——具有酸的通性:a.乙酸是一元弱酸,能使紫色石蕊试液变红。
b.Zn+2CH3COOH−Zn (CH3COO)2+H2↑c.ZnO+2CH3COOH−Zn (CH3COO)2+H2Od.Zn(OH)2+2CH3COOH−Zn (CH3COO)2+2H2Oe.ZnCO3+2CH3COOH−Zn (CH3COO)2+H2O+CO2↑Ⅱ.酯化反应【实验探索】乙酸乙酯的制备【操作】在试管中先加入3mL乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL乙酸;连接好装置,用酒精灯慢慢加热。
【现象】液面上有透明的难溶于水的油状液体生成,并可闻到香味。
【分析】a.浓硫酸的作用是作催化剂、吸水剂。
b.该反应的实质是酸脱羟基醇脱氢。
乙醇和乙酸的分离

乙醇和乙酸的分离乙醇和乙酸是常见的有机化合物,它们在实验室和工业生产中都有广泛的应用。
本文将探讨乙醇和乙酸的分离方法以及其在实际应用中的意义。
一、乙醇和乙酸的性质乙醇,化学式为C2H5OH,是一种无色、具有特殊气味的液体。
乙酸,化学式为CH3COOH,也是一种无色液体,具有刺激性的酸味。
乙醇和乙酸在物理性质和化学性质上都有一定的区别。
乙醇和乙酸的分离方法主要有蒸馏法和萃取法。
1. 蒸馏法蒸馏法是一种常用的分离纯化方法,适用于乙醇和乙酸的分离。
乙醇和乙酸的沸点分别为78.5℃和118℃,通过调控温度可以使乙醇和乙酸分别蒸发并收集。
这种方法简单、成本低,但对纯度要求较高,且不能分离含水的乙醇和乙酸。
2. 萃取法萃取法是一种将混合物中的成分分离的方法,通过溶剂的选择性溶解性来实现。
乙醇和乙酸在水中溶解度不同,可以利用这一特点进行分离。
例如,可以将乙醇和乙酸混合物与正己烷等非极性有机溶剂进行萃取,乙酸会更容易溶解于有机溶剂中,从而实现分离。
三、乙醇和乙酸的应用乙醇和乙酸在工业生产和日常生活中都有广泛的应用。
1. 乙醇的应用乙醇是一种重要的有机溶剂,在化学实验室和工业生产中被广泛使用。
它可以用于制备药物、染料、涂料等化学品,也可用作燃料和消毒剂。
此外,乙醇还是酒精饮料的主要成分之一,具有一定的生活应用价值。
2. 乙酸的应用乙酸是一种重要的化学原料,在染料、塑料、橡胶等行业中有广泛的应用。
它还可以用于制备醋酸纤维、乙酸乙酯等化学品。
此外,乙酸还被广泛用作食品酸味剂和防腐剂,在食品加工和保鲜中发挥重要作用。
四、乙醇和乙酸的分离在实际应用中的意义乙醇和乙酸的分离对于实验室和工业生产都具有重要意义。
在实验室中,乙醇和乙酸的分离可以用于纯化化学试剂,提高实验的准确性和可重复性。
同时,乙醇和乙酸的分离也为进一步研究它们的性质和应用提供了基础。
在工业生产中,乙醇和乙酸的分离可以用于纯化工业原料,提高产品的质量和纯度。
此外,乙醇和乙酸的分离还有助于减少对环境的污染,提高资源利用效率。
乙醇、乙酸
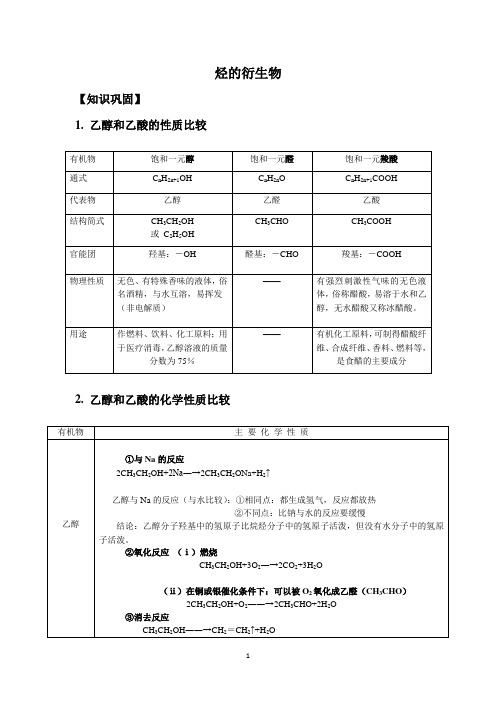
烃的衍生物【知识巩固】1. 乙醇和乙酸的性质比较2. 乙醇和乙酸的化学性质比较【专题练习】1.羟基的符号是( )A. OH B OH ―C -OHD HO ∙∙∙∙∙∙∙∙2.下列关于乙醇的物理性质的叙述中,错误的是( )A. 能与水任意比例互溶B. 可溶解多种无机物和有机物C.密度比水小D. 沸点比水高 3.比较乙烷和乙醇的结构,下列说法错误的是( )A.两个碳原子以单键相连B.分子里都含6个相同的氢原子C.乙基与一个氢原子相连就是乙烷分子D.乙基与一个羟基相连就是乙醇分子 4.CH 3CH 2OH 是生活中常见的有机物,下列对其性质的描述中不.正确的是: A .能够与金属Na 反应放出H 2 B .能够燃烧放出大量热量 C .能够使酸性高锰酸钾溶液褪色 D .能够使紫色石蕊溶液变红5. 若乙酸分子中的氧都是18O ,乙醇分子中的氧都是16O ,二者在浓H 2SO 4作用下发生反应,一段时间后,分子中含有18O 的物质有 ( ) A 1种 B 2种 C 3 种 D 4种6. 关于乙酸的下列说法中不正确的是 ( ) A .乙酸易溶于水和乙醇B.无水乙酸又称冰醋酸,它是纯净物C.乙酸是一种重要的有机酸,是有刺激性气味的液体D.乙酸分子里有四个氢原子,所以不是一元酸7. 某有机物蒸气,完全燃烧时需要三倍于其体积的氧气,产生二倍于其体积的二氧化碳,该有机物可能是()A.C2H4B.C2H5OH C.CH3CHO D.CH3COOH8. 只用水就能鉴别的一组物质是()A.苯,乙酸,四氯化碳B.乙醇,乙醛,乙酸C.乙醇,硝基苯,乙酸乙酯D.己烷,乙醇,甲醇9. 用一种试剂可以区分乙醇和乙酸的是()A.氢氧化钠溶液B.氨水C.碳酸钠溶液D.氢氧化铜10. 下列5个有机化合物中,能够发生酯化、加成和氧化3种反应的是①CH2=CHCOOH ②CH2=CHCOOCH3③CH2=CHCH2OH ④CH3CH2CH2OH⑤CH3CHCH2CHO|OHA.①③④B.②④⑤C.①③⑤D.①②⑤11. 质量为a g的铜丝放在空气中灼烧变黑,趁热放入下列物质中,铜丝变红,质量仍为a g 的是()A.CH3COOHB.HNO3C.CH3CH2OCH3D.CH3CH2CH2OH12. 下列物质中,能与醋酸发生反应的是:①石蕊②乙醇③甘油④金属铝⑤氧化镁⑥碳酸钙⑦氢氧化铜A.①③④⑤⑥⑦B.②③④⑤C. ①②④⑤⑥⑦D.全部13. 丙烯醇(CH2==CH—CH2OH)可发生的化学反应有()①加成②氧化③燃烧④加聚⑤取代A.只有①②③B.只有①②③④C.只有①②③④⑤D.只有①③④14. “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。
乙醇乙酸的知识点总结

乙醇乙酸的知识点总结一、乙醇乙酸的化学性质1. 乙醇乙酸的化学式为C4H8O2,是一种无色、有毒的液体。
2. 乙醇乙酸是一种饱和脂肪酸,属于羧酸类化合物。
3. 乙醇乙酸是一种具有药物效果的化合物,可以用于制药工业及医药领域。
4. 乙醇乙酸是一种重要的化工原料,广泛应用于合成酯类化合物、溶剂、香料等。
5. 乙醇乙酸是一种具有腐蚀性的化合物,应注意其安全使用和储存。
6. 乙醇乙酸的密度为1.049 g/cm3,沸点为141°C,熔点为16.6°C。
二、乙醇乙酸的制备方法1. 乙醇乙酸可以通过乙烯氧化法制备,将乙烯与氧气经过催化剂的作用,生成乙醇,再通过氧化反应生成乙醇乙酸。
2. 乙醇乙酸还可以通过乙醇氧化法制备,将乙醇经过氧气氧化反应生成乙醇乙酸。
3. 乙醇乙酸还可以通过醋酸酐和乙醇反应生成,醋酸酐与乙醇反应生成乙酸乙酯,再通过水解反应生成乙醇乙酸。
三、乙醇乙酸的应用领域1. 乙醇乙酸是一种重要的工业原料,在化工领域广泛用于合成其他化合物,如醋酸丁酯、醋酸乙酯等。
2. 乙醇乙酸在医药领域具有抗菌、杀菌的功效,常用于制药工业生产药物。
3. 乙醇乙酸可以用作有机溶剂,在涂料、油墨、香料等行业有重要应用。
4. 乙醇乙酸也被广泛应用于食品添加剂领域,用作食品酸化剂和防腐剂。
四、乙醇乙酸的安全性及注意事项1. 乙醇乙酸是一种有毒化合物,长期暴露或高浓度接触可能对人体造成伤害,并且会对环境产生一定的危害。
2. 在使用乙醇乙酸时应注意其防护措施,避免接触皮肤和眼睛,同时避免吸入其蒸气。
3. 乙醇乙酸应储存在阴凉、干燥、通风的仓库中,远离火源和氧化剂,避免高温或直接阳光照射。
4. 在使用乙醇乙酸时应注意其蒸气的排放,避免对周围环境造成污染。
五、乙醇乙酸的环境影响及处理方法1. 乙醇乙酸对环境会产生一定的危害,长期暴露会导致土壤酸化、水源污染等问题。
2. 在工业生产和使用乙醇乙酸时,应采取相应的环保措施,减少其对环境造成的影响。
乙酸和乙醇共沸点

乙酸和乙醇共沸点
摘要:
一、引言
二、乙酸和乙醇的性质
三、乙酸和乙醇共沸点的原理
四、影响共沸点的因素
五、实际应用与意义
正文:
乙酸和乙醇共沸点在化学领域是一个有趣的现象。
为了更好地理解这一现象,我们首先需要了解乙酸和乙醇的性质。
乙酸是一种有机酸,具有羧基(-COOH),具有酸性。
乙醇是一种醇类有机化合物,具有羟基(-OH),具有醇性。
当这两种物质混合在一起时,它们会发生相互作用,导致共沸点降低。
那么,乙酸和乙醇共沸点的原理是什么呢?这是因为混合物中的乙酸和乙醇分子间存在氢键。
氢键是一种较强的分子间作用力,可以降低混合物的沸点。
因此,当乙酸和乙醇混合时,它们的沸点会低于各自单独的沸点。
影响乙酸和乙醇共沸点的因素包括混合物的比例、压强和温度。
当混合物的比例发生变化时,共沸点也会相应地发生变化。
在一定压强下,共沸点随温度的升高而升高。
实际应用方面,乙酸和乙醇共沸点现象在化工生产中有重要意义。
例如,在酯化反应中,通过控制反应温度和压力,可以使反应更加完全。
此外,共沸
点现象还可以用于分离和提纯乙酸和乙醇等有机化合物。
总之,乙酸和乙醇共沸点是一个有趣的化学现象,其原理与实际应用具有重要意义。
7.3乙醇与乙酸高一化学精品讲义(沪科版2020)(学生版)

7.3 乙醇与乙酸学习聚焦知识精讲知识点01 乙醇乙醇的结构(1)乙醇是极性分子,易溶于极性溶剂,与水以任意比例混溶.(2)大部分有机物都能溶于乙醇,乙醇是常见的有机溶剂.(3)极性键①②③④在一定条件下都易断裂,碳碳键只有在燃烧或爆炸时才断裂.(4)羟基与氢氧根的区别①电子式不同②电性不同—OH呈电中性,OH-呈负电性.③存在方式不同OH和晶体中的—OH不能独立存在,只能与别的“基”结合在一起,OH-能够独立存在,如溶液中的OH-.④稳定性不同—OH不稳定,能与Na等发生反应,相比而言,OH-较稳定,即使与Fe3+等发生反应,也是整体参与的,OH-并未遭破坏.(二)乙醇的物理性质乙醇俗称酒精,是无色透明,有特殊香味,易挥发的液体,密度比水小,熔点-117.3℃,沸点78.5℃,比相应的乙烷、乙烯、乙炔高得多,其主要原因是分子中存在极性官能团羟基(—OH)。
密度0.7893g/cm3,能与水及大多数有机溶剂以任意比混溶。
工业酒精含乙醇约95%。
含乙醇达99.5%以上的酒精称无水乙醇。
乙醇是优良的有机溶剂。
(三)、乙醇的化学性质1.乙醇的取代反应(1)乙醇与活泼金属的反应2CH3CH2OH+2Na→2CH3CH2ONa+H2↑教学建议:可以联系复习讲解:反应类型、乙醇可以与其他金属反应、金属与醇反应与金属和水反应的剧烈程度,并分析两者的酸性强弱、其它烃的衍生物如酚、羧酸等与金属钠的反应进行对比。
(2)乙醇与HBr的反应(3)分子间脱水(4)酯化反应CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O教学建议:强调反应的断键原理,酯化反应的实质是酸脱羟基醇脱氢,另外醇不但可以跟有机酸发生酯化反应,也可以跟无机酸发生酯化反应。
如:硝化反应磺化反应2.乙醇的氧化反应 (1)燃烧氧化C 2H 6O +3O 2−−→−点燃2CO 2+3H 2O ①CH 3CH 2OH 燃烧,火焰淡蓝色 ②烃的含氧衍生物燃烧通式为:C x H y O z +(x +4y -2z )O 2−−→−点燃x CO 2+2yH 2O(2)催化氧化①乙醇去氢被氧化②催化过程为:CH 3CHO 生成时,Cu 又被释出,Cu 也是参加反应的催化剂. 拓展醇的催化氧化反应机理和氧化规律: ①反应机理羟基(-OH)上的氢原子与羟基相连碳原子上的氢原子脱去,氧化为含有( ) 双键的醛或酮。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
与活泼金属,碱,弱酸盐反应,如CaCO3、Na2CO3
酸性比较:ቤተ መጻሕፍቲ ባይዱH3COOH>H2CO3
2CH3COOH+CaCO3=2(CH3COO)2Ca+CO2↑+H2O(强制弱)
②酯化反应(写出乙酸与乙醇发生酯化反应的化学方程式)
_______________________________________________
②氧化反应
(ⅰ)燃烧
___________________________________
(ⅱ)在铜或银催化条件下:可以被O2氧化成乙醛(CH3CHO)
____________________________________
乙酸
①具有酸的通性:CH3COOH≒CH3COO-+H+
使紫色石蕊试液变红;
高中化学:乙醇和乙酸的化学性质
有机物
主要化学性质
乙醇
①与Na的反应
_____________________________________
乙醇与Na的反应(与水比较):①相同点:都生成氢气,反应都放热
②不同点:比钠与水的反应要缓慢
结论:乙醇分子羟基中的氢原子比烷烃分子中的氢原子活泼,但没有水分子中的氢原子活泼。
