卤素的含氧酸及其盐
无机化学考研辅导3

无机化学考研辅导(下)第五讲卤素一、卤素单质的通性1、分子结构和性质元素的价电子构型为ns2np5,易得一个电子形成全满结构,单质均为双原子分子。
最显著的性质是气态的F2、Cl2、Br2、I2的颜色变化,从近无色→紫色,分子最大吸收渐向长波方向移动。
说明双原子MO中最高充满的σ和π*至最低未满的空的σ*轨道之间能量差自上而下减小。
另外,卤素分子的离解能从F2到I2分别为159kj·mol-1,243kJ·mol-1,193kJ·mol-1和151kJ·mol-1。
.除F2外,随着离子半径的增加,键渐弱,因而离解能渐低。
2、反应活性(1)卤素标准电极电势:I2+2e-=2I-φ=0.52VBr2+2e-=2Br-φ=1.06VCl2+2e-=2Cl-φ=1.36VF2+2e-=2F-φ=2.87V氧化能力:F2>Cl2>Br2>I2(还原能力:I->Br->Cl->F-)(2)所以F2,Cl2可与所有金属作用,F2还能与稀有气体作用:形成XeF2,XeF4,XeOF4等化合物。
Br2,I2可与除贵金属外的所有金属作用。
(3)卤素与水作用发生下述两类反应1X2+H2O→2H++2X-+1/2O2F2极易发生此反应,日光下Cl2反应慢,Br2,I2无明显反应。
2X2+H2O→H++X-+HOX X2+2OH-→XO-+X-+H2O第2类反应即为卤素特征的OX-Re反应即歧化反应。
在酸性条件下,卤素歧化反应不易发生,如Cl2的K=4.0×10-4;而在碱性条件下,歧化极易进行,且XO-还可继续歧化(3XO-→2X-+XO3-)。
Cl2在70摄氏度,Br2在室温,I2在0℃即可发生上述反应。
所以室温下将Cl2,Br2,I2分别加入碱中生成的是ClO-,BrO3-和IO3-。
3、单质制备(1)F21工业制备:电解KHF2与HF混合液阳极(石墨):2F-=F2↑+2e-阴极(电解槽):2HF2-+2e-=H2↑+4F-电解总反应:2KHF2=2KF+H2↑+F2↑2实验室制法:BrF5(g)=BrF3(g)+F2(g)1986年:4KMnO4+4KF+20HF→4K2MnF6+3O2+10H2O2K2MnF6+4SbF5=4KSbF6+F2↑+2MnF3(2)Cl21工业制备:电解NaCl水溶液2实验室制法:MnO2+HCl(浓)= KMnO4+HCl(浓)=(3)Br21工业制法:海水制Br2。
卤素含氧酸的稳定性及其盐氧化还原性的比较

卤素含氧酸的稳定性及其盐氧化还原性的比较姓名:杨颖聪指导教师:桑亚丽赤峰学院化学系09级化学本科班引言恩格斯说过:“科学的发生和发展过程,归根结底是由生产所决定的。
”化学正像其他学科一样,是人类活动实践的产物。
那么,化学研究的是什么呢?简单地说,化学就是研究物质的组成、结构、性质和变化的科学。
下面,就卤素含氧酸的稳定性及其盐氧化还原性做如下讨论:一、卤素及其含氧酸(盐)的结构特征1、卤素原子的结构特征元素周期系第ⅦA族元素包括氟、氯、溴、碘和砹五种元素,总称为卤素。
卤族元素都是典型的非金属,其价层电子构型均为ns2np5,它们很容易得到一个电子形成卤离子,或与另一个原子形成共价键,所以卤素原子都能以-1氧化态形式存在[1]。
除氟外,在一定的条件下,氯、溴、碘的外层ns np成对电子受激发可跃迁到nd轨道,nd轨道也参与成键,故可呈现+Ⅰ、+Ⅲ、+Ⅴ、+Ⅶ氧化态,这些氧化态突出地表现在氯、溴、碘的含氧化合物或含氧酸根中,如:+1: HXO (次卤酸)、+3: HXO₂(亚卤酸)、+5: HXO₃(卤酸)、+7: HXO₄(高卤酸)。
2.卤素含氧酸(盐)的结构特征:含氧酸是酸根中含有氧原子的酸。
非金属元素的含氧酸的酸根,即含氧阴离子,属于多原子离子。
在这样的离子中,中心成键原子与氧原子之间除了形成σ键以外,还可能形成π键,不过由于中心原子的电子构型不同,形成的π键类型不完全一样[2]。
但是,在这些含氧酸的结构中,都含有X─O─H键,有的亦含有X─O键等。
二、卤素含氧酸(盐)的稳定性1、影响含氧酸(盐)热稳定性的因素:含氧酸(盐)的热稳定性与含氧酸根离子的变形性和阳离子的极化作用有关,组成盐的阳离子的离子热越大,且阴离子的变形性越大,则极化作用越强,越易于分解;其次,含氧酸盐分解的焓变大小也是其影响热稳定性的主要因素。
一般来讲,分解焓变越大,盐的热稳定性越高【3】。
2、含氧酸(盐)的稳定性规律:绝大多数含氧酸的热稳定性差,受热脱水生成对应的酸酐。
第11章卤素

基本要求
制备和性质 2、掌握卤化氢的还原性、酸性、稳定性的变 化规律和卤化氢的制备 3、掌握氯的含氧酸及其盐的酸性、氧化性、 稳定性的变化规律。
1、熟悉卤素单质的
作业
P346 2 、4 、 5
冷
漂白粉
次氯酸盐的漂白作用是基于次氯酸的氧化性
次卤酸盐的热稳定性:
ClO- > BrO- > IO-
例如次氯酸盐微热就发生歧化反应: 350K 2ClO-======Cl-+ClO3次溴酸盐在常温于就可以歧化,次碘酸盐根本就不 能存在于溶液中。
2.氯酸及其盐 卤酸: 酸性:(比次卤酸强 )
E(XO 3 / X )/V
HBrO
减弱
HIO
2.8×10-8 2.0×10-9 2.3×10-11
1.33
减弱 减弱
0.99
强氧化性 热稳定性(差):
注:热稳定性很低,只存在于水溶液中,在室温下见光或稍 浓即分解。
制备: 次氯酸 Cl2 +H2O (冷) 2Cl2 +2HgO+H2O HClO (稀) +HCl 2HClO(浓)+HgO.HgCl2
3.高卤酸及其盐 高卤酸: 酸性:比卤酸强 HClO4 最强 HBrO4 强 H5IO6 弱
酸性增强 E0A / V
氧化性:(都是强氧化剂)
1.19
比氯酸弱
1.763
1.60
稳定性:比卤酸稳定
均已获得纯物质,稳定性好。
浓HClO4溶液是强氧化剂,固体 高卤酸盐是强氧化剂,但稀HClO4
偏高碘酸 HIO4
五、拟卤素(简介)
拟卤素──性质与卤素单质相似的某些原子团称为拟卤素。
卤素概述

高碘酸是强氧化剂
作业:
P557:1,2,4,5,7, 8,10,12,15,18, 19
HF为何易与二氧化硅反应
先介绍硬软酸理论: 对于广义酸碱而言,不易变形为硬,易 变形者为软。 软亲软,硬亲硬,见P78,表4-1 根据硬软酸理论:四价硅是硬酸,氟离 子是硬碱,硬亲硬,如六氟化铝离子。 此反应用来刻蚀玻璃,溶解矿石。
4.卤化物的水解性
1). 金属卤化物除少数活泼金属卤化物外, 均发生不同程度的水解,金属的价态越 高,越易水解。
b) 卤素在水中的歧化反应
卤素的歧化反应与PH的关系
1. 在中性介质中,只有氯能小量歧化 2. 在强碱性介质中,能歧化完全,但可 发生两类歧化:
X2 + 2OH- →X- + XO- + H2O 3XO- →2X- + XO3最终产物取决于反应速度
在碱性条件下卤素的歧化与温度 的关系
小结:
卤素
一. 卤素概述: 1.第VIIA族包括氟、氯、溴、碘和砹五 种元素,总称为卤素。卤素希腊原文为 成盐元素的意思。。 砹是放射性元素,在自然界中仅以微量 而短暂地存在于镭、锕或钍的蜕变产物 中。
注意价电子结构和氧化数
2.价电子层结构:ns2np5
导致非单质的氧化数: 1)最低氧化数:-1 2)最高氧化数:F:-1;其它:+7 3) 氧化数都是奇数(为什么)
2).非金属卤化物水解的主要类型
二)不水解:如四氯化碳、六氟化硫 非金属最高配位数未满时水解,满则 不水解。
三.卤素的含氧酸及其盐
(1)含氧酸离子的结构:(从未激发 到激发三个电子。
(整理)3卤素的氧化物、含氧酸及其盐.
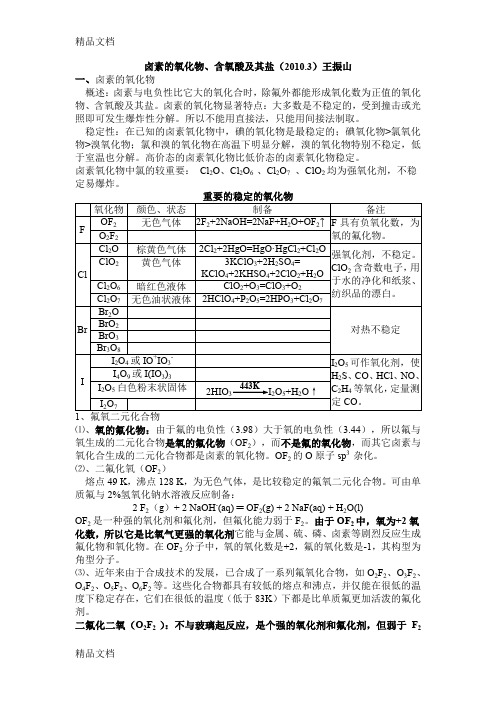
卤素的氧化物、含氧酸及其盐(2010.3)王振山一、卤素的氧化物概述:卤素与电负性比它大的氧化合时,除氟外都能形成氧化数为正值的氧化物、含氧酸及其盐。
卤素的氧化物显著特点:大多数是不稳定的,受到撞击或光照即可发生爆炸性分解。
所以不能用直接法,只能用间接法制取。
稳定性:在已知的卤素氧化物中,碘的氧化物是最稳定的;碘氧化物>氯氧化物>溴氧化物;氯和溴的氧化物在高温下明显分解,溴的氧化物特别不稳定,低于室温也分解。
高价态的卤素氧化物比低价态的卤素氧化物稳定。
卤素氧化物中氯的较重要:Cl2O、Cl2O6 、Cl2O7、ClO2均为强氧化剂,不稳定易爆炸。
⑴、氧的氟化物:由于氟的电负性(3.98)大于氧的电负性(3.44),所以氟与氧生成的二元化合物是氧的氟化物(OF2),而不是氟的氧化物,而其它卤素与氧化合生成的二元化合物都是卤素的氧化物。
OF2的O原子sp3杂化。
⑵、二氟化氧(OF2)熔点49 K,沸点128 K,为无色气体,是比较稳定的氟氧二元化合物。
可由单质氟与2%氢氧化钠水溶液反应制备:2 F2(g)+ 2 NaOH-(aq) ═ OF2(g) + 2 NaF(aq) + H2O(l)OF2是一种强的氧化剂和氟化剂,但氟化能力弱于F2。
由于OF2中,氧为+2氧化数,所以它是比氧气更强的氧化剂它能与金属、硫、磷、卤素等剧烈反应生成氟化物和氧化物。
在OF2分子中,氧的氧化数是+2,氟的氧化数是-1,其构型为角型分子。
⑶、近年来由于合成技术的发展,已合成了一系列氟氧化合物,如O2F2、O3F2、O4F2、O5F2、O6F2等。
这些化合物都具有较低的熔点和沸点,并仅能在很低的温度下稳定存在,它们在很低的温度(低于83K)下都是比单质氟更加活泼的氟化剂。
二氟化二氧(O2F2 ):不与玻璃起反应,是个强的氧化剂和氟化剂,但弱于F2本身:比OF2、ClF3有更强的氟化作用,能在OF2、ClF3不能完成的反应中将金属钚和钚的化合物氧化:Pu(s) + 3O2F2(g) →PuF6(g) + 3O2(g) 该反应用来从废核燃料中以挥发性PuF6的形式除去强放射性的金属Pu。
7-卤素

卤素含氧酸及含氧酸盐
• 氯、溴、碘都可以形成氧化数为+1、+3、+5、+7的各种含氧化合 物(氧化物、含氧酸和含氧酸盐),它们都不稳定或稳定性较差。 比较稳定的是含氧酸盐,最不稳定的是氧化物。卤素含氧酸依次 称为次卤酸(HXO)、亚卤酸(HXO2)、卤酸(HXO3)、高 卤酸(HXO4),碘还可以形成正高碘酸(H5IO6)。
卤素含氧酸及含氧酸盐
次卤酸根
亚卤酸根
卤酸根
高卤酸根
正高碘酸根
拟卤素
• 某些负一价阴离子与卤素离子有着相似的性质,在自由 状态时原子团性质也与卤素单质性质相似,因此将这些 化合物称为拟卤素。拟卤素主要有氰(CN)2、硫氰(SCN)2、 氧氰 (OCN)2 ,相应的阴离子为氰根离子 CN- 、硫氰酸根 离子SCN-、氰酸根离子OCN-。
HF F
N)2、(SCN)2在碱性溶液中的歧化反应式。 (CN)2+2NaOH→NaCN+NaOCN+H2O 3、HF一般呈弱酸性,但为什么很浓的HF水溶液为强酸?
浓度低时,第一个平衡占优势,氢氟酸呈弱酸性;浓度较大 (5~15mol·L-1)时,第二个平衡占优势,F-与未解离的HF以氢键方 式结合,F-浓度降低,促进第一个平衡右移,氢氟酸变成强酸。
卤素单质与水反应
卤素与水发生两类反应: 2X2+2H2O == 4HX+O2↑ X2+H2O == HX+ HXO↑ F2氧化性最强,只与水发生第一类反应; I2与水不发生第1类反应。 Cl2、 Br2、I2与水主要发生第2类反应(可逆),反应进行的程度依 次减小。
在碱溶液中,卤素单质(除F2外),在不同温度下歧化反应产物不同:
无机化学——卤素

4.成键特征
(1)单质 Px-Px (2)化合物
离子键 共价键(与非金属作用)PX3 NH3 配位键(在配合物中)FeF63(3)氯到碘有变价 +1 +3 +5 +7
在含氧化合物中 HClO4
在互化物中 IF3
二. 单质
1.物理性质: (1)决定因素:色散力 (2)颜色和状态:
氟(淡黄色气体) 氯(黄绿色气体) 溴(棕红色液体) 碘(紫黑色固体)(易升华) 原因是由于吸收光波长不同而产生不同颜色。
F2+Xe=XeF2(520K) F2+H2=2HF(低温和黑暗)
氯与大多数非金属化合,比较剧烈。 与磷硫碘氟氢等生成氯化物。 I2+3Cl2=2ICl3(光照) 溴和碘单质氧化能力较弱,反应活性不如氯, 需高温。 3Br2+2P=2PBr3(点燃,无色发烟液体) 3I2+2P=2PI3(红色固体)
(3)与水作用 i氧化水放出氧气:X2+H2O=2HX+1/2O2 ii歧化反应:在OH-易发生
Cl2+H2O=HCl+HClO Br2+H2O=HBr+HBrO I2+6OH- = 5I- +IO3- +3H2O
热或浓碱 3X2+6OH-=5X-+XO3-+3H2O(X=Cl Br I) F2与其它卤素不同:
2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O
☆结构:sp3杂化 V形
☆用途:制备次氯酸
(3) ClO2 ☆ 性质:黄绿色气体,冷却红色液体
mp bp低,顺磁性, 很高化学活性,强氧化剂漂白剂 ☆ 结构 思考:化学键是怎样形成的?
卤素含氧酸的稳定性及其盐氧化还原性的比较

卤素含氧酸的稳定性及其盐氧化还原性的比较姓名:杨颖聪指导教师:桑亚丽赤峰学院化学系 09级化学本科班引言恩格斯说过:“科学的发生和发展过程,归根结底是由生产所决定的。
”化学正像其他学科一样,是人类活动实践的产物。
那么,化学研究的是什么呢简单地说,化学就是研究物质的组成、结构、性质和变化的科学。
下面,就卤素含氧酸的稳定性及其盐氧化还原性做如下讨论:一、卤素及其含氧酸(盐)的结构特征1、卤素原子的结构特征元素周期系第ⅦA族元素包括氟、氯、溴、碘和砹五种元素,总称为卤素。
卤族元素都是典型的非金属,其价层电子构型均为ns2np5,它们很容易得到一个电子形成卤离子,或与另一个原子形成共价键,所以卤素原子都能以-1氧化态形式存在[1]。
除氟外,在一定的条件下,氯、溴、碘的外层ns np成对电子受激发可跃迁到nd轨道,nd轨道也参与成键,故可呈现+Ⅰ、+Ⅲ、+Ⅴ、+Ⅶ氧化态,这些氧化态突出地表现在氯、溴、碘的含氧化合物或含氧酸根中,如:+1: HXO (次卤酸)、+3: HXO₂(亚卤酸)、+5: HXO₃(卤酸)、+7: HXO₄(高卤酸)。
2.卤素含氧酸(盐)的结构特征:含氧酸是酸根中含有氧原子的酸。
非金属元素的含氧酸的酸根,即含氧阴离子,属于多原子离子。
在这样的离子中,中心成键原子与氧原子之间除了形成σ键以外,还可能形成π键,不过由于中心原子的电子构型不同,形成的π键类型不完全一样[2]。
但是,在这些含氧酸的结构中,都含有X─O─H键,有的亦含有X─O键等。
二、卤素含氧酸(盐)的稳定性1、影响含氧酸(盐)热稳定性的因素:含氧酸(盐)的热稳定性与含氧酸根离子的变形性和阳离子的极化作用有关,组成盐的阳离子的离子热越大,且阴离子的变形性越大,则极化作用越强,越易于分解;其次,含氧酸盐分解的焓变大小也是其影响热稳定性的主要因素。
一般来讲,分解焓变越大,盐的热稳定性越高【3】。
2、含氧酸(盐)的稳定性规律:绝大多数含氧酸的热稳定性差,受热脱水生成对应的酸酐。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卤素的含氧酸及其盐
Cl、Br、I具有不同价态的含氧酸。
X: 采取SP3杂化:O的2P电子与卤素3d空轨道间形成d-pπ键。
由于稳定性原因,只有常见的氯的含氧酸研究得多。
一、次卤酸
1. 化学性质
(1) 酸性
因为随半径增大,分子中 H— O—X,X—O 结合力减小,X 对 H+斥力变小,导致酸性减小。
(2) 热稳定性
HXO都不稳定,仅存在于水溶液中,从Cl到I稳定性减小,分解方式:
脱水分解:
由上式可知,Cl
O是HClO的酸酐。
BrO-室温下发生歧化分解,只有在273K
2
-盐。
可见XO-的歧时才有BrO- 存在, 323 ~ 353K时,BrO-完全转变成BrO
3
化速率与温度有关,温度升高,歧化速率增大。
IO-歧化速率更快,溶液中不存在次碘酸盐,HIO几乎不存在。
(3) 氧化性
HXO不稳定,表明HXO的氧化性很强。
XO-盐比HXO酸稳定性高,所以经常用其盐在酸性介质中做氧化剂。
2.HXO的制备
1)次氯酸酐Cl
2
O溶于水制得HClO
步骤:将Cl
2通到新制干燥的HgO表面,加热制得Cl
2
O
从体系中除去HCl可使平衡右移,可采用下法。
在Cl
2
水中加入新生成的HgO或碳酸盐
减压蒸馏得到HClO。
工业上采用电解冷的稀NaCl溶液的方法。
同时搅拌电解液,使产生的氯气与NaOH充分反应制得次氯酸钠
减压蒸馏得HClO。
将阳极产生的Cl
2
通入阴极区NaOH中。
二、亚卤酸及其盐
1.性质
亚卤酸中仅存在HClO
2
,酸性大于HClO,Ka=5.0
HClO
2不稳定,ClO
2
-在溶液中较稳定,具有强氧化性,NaClO
2
盐较稳定,加
热,撞击爆炸分解,在溶液中受热分解。
2. 制备方法
1)
过滤除去BaSO
4可制得纯净HClO
2
,但HClO
2
不稳定,很快分解。
可见ClO
2不是HClO
2
的酸酐,ClO
2
冷凝时为红色液体。
2) ClO
2
与碱作用可得到亚氯酸盐和氯酸盐。
首先制取ClO
2,其方法用SO
2
还原NaClO
3
3) Na
2O
2
(H
2
O
2
)与ClO
2
作用制备纯NaClO
2。
三、卤酸及其盐
1. 卤酸的制取
1) 利用卤素单质在OH-性介质中歧化的特点制取。
此法优点:1)X-、XO3-易分离。
2)反应彻底。
缺点:XO3-转化率只有1/6.
2) 卤酸盐与酸反应H2SO4浓度不宜太高,否则易发生爆炸分解。
3) 直接氧化法
HClO3可存在的最大百分比浓度40% , HBrO350%, HIO3固体,可见酸的稳定性依次增强。
2. 性质
1) 酸性因为Z增大,半径增
大,反极化作用减小,所以酸性减弱。
2) 稳定性HXO3 > HXO 但也极易分解。
HClO3、HBrO3仅存在于溶液中,减压蒸馏冷溶液可得到粘稠的浓溶液。
分解反应的类型:a: 光催化:b: 歧化:
c: 浓溶液热分解:
I2O5是稳定的卤氧化物,是HIO3的酸酐。
盐的稳定性大于相应酸的稳定性,但受热时也发生分解。
3) 氧化性HBrO3 > HClO3 > HIO3
HBrO3氧化能力最强的原因:在分子构型相同的情况下,Br同Cl比,外层18e的Br吸引电子能力大于8e的Cl,Br与I相比,都是18e,但半径Br < I 。
得e能力Br > I,所以BrO3-的氧化能力最强。
氧化能力的大小与稳定性刚好相反,越稳定氧化能力越小,它们均是强氧化剂。
同一元素HClO3与HClO氧化性的比较
1)HClO3中Cl为+5价,得e 趋势大,中心Cl SP3杂化成键数目多。
酸强度HClO3 > HClO, 稀溶液中HClO3以离子H+,ClO3-形式存在,而HClO酸以分子形式存在。
2)中心Cl对称性比HClO中Cl高, 所以HClO3相对稳定,配位O不易被夺走,对HClO3来说,第二个因素占主导, 所以氧化能力HClO>HClO3,而盐的氧化性小于相应的酸,因为Mn+极化能力小于H+。
4) 盐类的溶解度氯酸盐基本可溶,但溶解度不大。
溴酸盐AgBrO3浅黄,Pb(BrO3)2, Ba(BrO3)2难溶,其余可溶。
可溶碘酸盐更少,Cu(IO3)2水合物蓝色,无水盐绿色,AgIO3, Pb(IO3)2 , Hg(IO3)2 , Ca、Sr、Ba的碘酸盐均难溶。
所以溶解度的变化规律:
MClO3 > MBrO3 > MIO3
四、高卤酸及其盐
1.性质
1) 酸性 HClO
4 > HBrO
4
> H
5
IO
6
(HIO
4
)
最强很强Ka
1
=2.3
高氯酸是无机酸中最强的酸,在水中完全解离成H+、ClO
4
-, Cl7+对O2-的吸引力大于H+—O2-结合力,抵抗H+的反极化能力强,使O—H键的结合力被削弱。
Cl—Br—I,半径逐渐增大,反极化力逐渐减小,所以酸性逐渐减弱。
正高碘酸H
5IO
6
是无色单斜晶体,m.p 413K 在强酸中以H
5
IO
6
的形式存在。
在碱中以形式存在, H
5IO
6
中,I采取杂化,六配位,正八面体。
2) 稳定性和氧化性。
浓高氯酸以分子状态存在的数目多,此时H+ 的反极化作用使HXO
4
不稳定,因而表现出强氧化性。
质量百分比低于60%的HClO
4
溶液加热时不分解,>72.4%
HClO
4
溶液为恒沸混合物,沸点(476K)分解。
稀HClO
4不能被Zn还原说明HClO
4
氧化能力小。
因为稀HClO
4完全解离,ClO
4
-结构对称性高, ClO
4
-正
四面体稳定,所以氧化能力低。
3) 盐类的溶解度
ClO
4-的K+、Rb+、Cs+、NH
4
+溶解度小,其余易溶,BrO
4
-
的K+、Rb+、Cs+溶解度小。
盐基本上难溶的。
2. 制备
1) 酸置换法,高氯酸的制备:
KClO
4+H
2
SO
4
=KHSO
4
+ HClO
4
减压蒸馏把HClO
4
从混合物中分离出来,要求低于365K。
工业生产
电解氧化HCl(aq)制取HClO
4
,Pt阳极,Ag、Cu做阴极。
Pt阳极:
Ag(Cu)阴极:
电解法可得到20%的 HClO
4,经减压蒸馏可得70%市售HClO
4。
质量低于60%
的HClO
4溶解加热不分解。
质量百分比72.4%的HClO
4
溶液是恒沸混合物,b.p.
476K,此时分解。
2) 高溴酸
用XeF
2或F
2
氧化NaBrO
3
制取HBrO
4
质量百分比55%的HBrO
4
(6)溶液很稳定,373K不分解,但高于55%则不稳定。
3) 高碘酸的制备
将氯气通入碘酸盐的碱性溶液中,可得高碘酸盐
酸化高碘酸盐
Ba
5(IO
6
)
2
+5H
2
SO
4
=5BaSO
4
+2H
5
IO
6
工业制法:
电解氧化碘酸盐溶液得高碘酸盐
现已制出了H
5IO
6
.2H
2
O的高碘酸,但浓度高也不稳定。
