配位化学-配合物异构现象
1.4配位化合物中的异构现象

2 光学异构
旋光异构现象 光学异构又称旋光异构。旋光异构是 由于分子中没有对称因素(面和对称中心 )而引起的旋光性相反的两种不同的空间 排布。当分子中存在有一个不对称的碳 原子时 , 就可能出现两种旋光异构体。 旋光异构体能使偏振光左旋或右旋 , 而 它们的空间结构是实物和镜象不能重合, 尤如左手和右手的关系 , 彼此互为对映 体。 具有旋光性的分子称作手性分子。
3、水合异构:
当水分子取代配位基团而进入配离子的内界所产 生的溶剂合异构现象。内外界间也可以发生水分 子的交换,与电离异构极为相似。例如 [Cr(H2O)6]Cl3/[CrCl(H2O)5]· H2O/[CrCl2(H2O)4]· 2H2O 灰蓝色 蓝绿色 绿色 它们各含有6、5、4个配位水分子, 这些异构体在物 理和化学性质上有显著的差异,如它们的颜色
1、几何异构
在配合物中, 配体可以占据中心原子周围的不同位 置。所研究的配体如果处于相邻的位置, 我们称之为
顺式结构, 如果配体处于相对的位置, 我们称之为反
式结构。由于配体所处顺、反位置不同而造成的异 构现象称为顺-反异构。顺反异构体的合成曾是 Werner确立配位理论的重要实验根据之一。 很显然, 配位数为2的配合物, 配体只有相对的位
C
[M(abcd)]:例如[PtCl(NO2)(NH3)(py)]+
c M a d a b c d d c
M
b a
M
b
②. 八面体配合物
[M(a2b4)]型配合物有两种几何异构体,即两个a 处于八面体相邻顶角者为顺式,处在相对顶角者 为反式。例如[CoCl2(NH3)4]+
NH3 H3N Co H3N NH3 cis-[CoCl2(NH3)4]+ (紫色) Cl H3N Cl H3N Co NH3 Cl NH3
9.2 配位化合物空间结构及几何异构现象
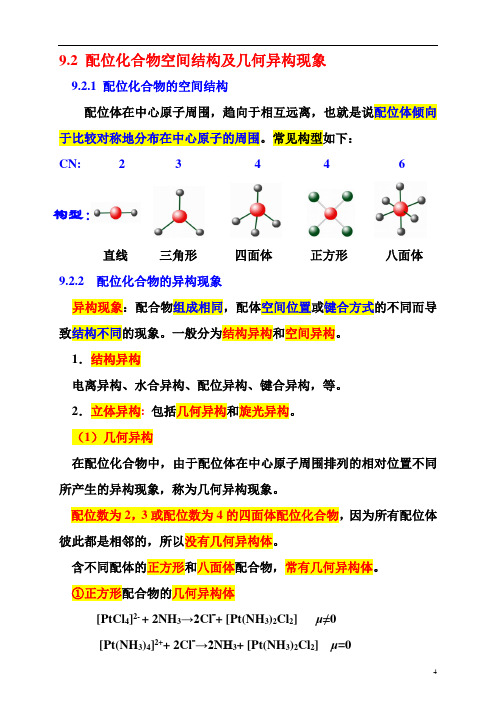
9.2 配位化合物空间结构及几何异构现象
9.2.1 配位化合物的空间结构
配位体在中心原子周围,趋向于相互远离,也就是说配位体倾向于比较对称地分布在中心原子的周围。
常见构型如下:
CN: 2 3 4 4 6
构型:
直线三角形四面体正方形八面体9.2.2 配位化合物的异构现象
异构现象:配合物组成相同,配体空间位置或键合方式的不同而导致结构不同的现象。
一般分为结构异构和空间异构。
1.结构异构
电离异构、水合异构、配位异构、键合异构,等。
2.立体异构:包括几何异构和旋光异构。
(1)几何异构
在配位化合物中,由于配位体在中心原子周围排列的相对位置不同所产生的异构现象,称为几何异构现象。
配位数为2,3或配位数为4的四面体配位化合物,因为所有配位体彼此都是相邻的,所以没有几何异构体。
含不同配体的正方形和八面体配合物,常有几何异构体。
①正方形配合物的几何异构体
[PtCl4]2- + 2NH3→2Cl-+ [Pt(NH3)2Cl2] μ≠0
[Pt(NH3)4]2++ 2Cl-→2NH3+ [Pt(NH3)2Cl2] μ=0
4。
2012-第二章 配合物的结构及异构现象

六配位 化合物
八面体 几何异构体数目
例
MA2B2C2
5
[Pt(NH3)2(OH2)2Cl2]
八面体配合物几何异构体数目 类型 MA6 MA5B MA4B2 MA3B3 MA4BC 数目 1 1 2 2 2
类型 MA3B2C
数目 3
MA2B2C2
5
MABCDEF
15
几何异构体的鉴别方法 (1) 偶极矩
量研究工作,随着各种现代结构测定方法的建立,配合
物的结构和异构现象更成为配位化学的重要方面。 配位多面体:把围绕中心原子的配位原子看作点,以线 按一定的方式连接各点就得到配位多面体。 用来描述中心离子的配位环境。
早在1893年维尔纳(瑞士)建立配位理论时,
就已经提出了使中心离子周围配体之间的静电斥力 最小,配合物最稳定,即配体间应尽力远离,从而 采取对称性分布,而实际测定结构的结果证实了这 种设想。 配合物的配位数与其空间结构有一定的联系,
例:Pt(II)配合物的偶极矩(Debye):
顺式 [Pt(PPr3n)2Cl2] 11.5 反式 0
[Pt(PEt3)2Cl2]
(2) X射线衍射法
10.7
0
该方法可确定原子在空间的确切位置(三维坐 标),因此可用来鉴定几何异构体。 例:trans-[Cu(py)2Cl2] (平面正方形)。
如:[HgI3]-、[Pt(PPh3)3]
N C Cu C N Cu C N C
N C Cu C N Cu C
KCu(CN)2
已经确认的如 KCu(CN)2, 它是一个聚合的阴离子, 其中每个Cu (I)原子与两个C原子和一个N原子键合。
化学式为 ML3 化合物并不一定都是三配位. 如 AlCl3、AuCl3为四配位(确切的分子式为Au2Cl6);
大学无机化学经典课件第三、四章配位化学

CH2NH2
H2CNH2
NH2CH2
CH2NH2
H2CNH2
NH2CH2
Cu
Cu2+的配位数等于4。
例如:
2+
螯合物
乙二胺四乙酸根 EDTA(Y4-)
乙二酸根(草酸根)
2–
O O C C O O
• •
• •
4–
• •
• •
• •
3. 浓度:一般[配体]增大,配位数增加
4. 温度:温度增加,配位数增大
[AlCl4]- [AlF6]3-
、配位化合物的命名 1 外界是负离子,简单酸根离子(Cl-), “某化某” 2 外界负离子是复杂酸根(SO42-)“某酸某” 3 外界为正离子(H+,Na+), “某酸某” (某酸/钠)
[Ag(NH3)2]+ [Cu(NH3)2]+ [Cu(CN)4]3- [Cu(NH3)4]2+ [Zn(NH3)4]2+ [Cd(CN)4]2- [Fe(CO)5] [FeF6]3- [Fe(CN)6]3- [Fe(CN)6]4- [Fe(H2O)6]2+ [MnCl4]2- [Mn(CN)6]4- [Cr(NH3)6]3+
烯羟配合物:配体为不饱和烃类的配合物。
一、几何异构现象
二、旋光异构现象---对应异构现象
三、其他异构
2.2 配合物异构现象
2.2 配合物异构现象
异构现象: 配合物的化学组成相同而原子间的联结方式或空间排列方式不同而引起性质不同的现象。
配合物的空间构型虽五花八门,但基本规律是:
(1) 形成体在中间,配位体围绕中心离子排布 (2) 配位体倾向于尽可能远离,能量低,配合物稳定
配位化学-配合物异构现象

一般可分为非对映异构和对映异构两类
非对映异构 和对映异构
非对应异构
构造式相同,构型不同,但不是实物与镜象关系的化合 物互称非对应体。
多形异构:分子式相同,立体结构不同的异构体。如 [Ni(P)2Cl2] 存在以下两种异构体(P代表二苯基苄基膦)
构造异构: 5、键合异构
同一种多原子配体与金属离子配位时,由于 键合原子的不同而造成的异构现象称为键合构体。
如:NO2-作为配体时 可用O原子配位亚硝酸根配合物。 可用N原子配位硝基配合物。
[Cr(H2O)5SCN]2+和[Cr(H2O)5NCS]2+
如[Co(NH3)5NO2]2+黄色, [Co(NH3)5(ONO )]2+红色 硝基·五氨合钴(Ⅲ)离子 亚硝酸根·五氨合钴(Ⅲ)离子
O
O
12O. 8
119 . 6N
H3N
191 . 9NH 3
195 . 6 Co 195 . 7
H3N
197. 7 NH 3 NH 3
O N 125 . 3
131 . 5O
H3N
193. 7 NH 3
196. 8 Co 191. 3
H3N
194. 9 NH 3 NH 3
二、立体异构
实验式相同,成键原子的联结方式也相 同,但空间排列不同。
第一章 配合物的异构现象
异构现象 :
配合物中原子间的联结方式及配体在空间的位置不同 而产生的异构现象。
如1:[Pt(NH3)2Cl2]
Cl Pt
Cl
NH3 NH3
Cl Pt
H3N
NH3 Cl
顺式
无机化学-配位化学基础-配合物的同分异构现象

violet
green
八面体配合物MA3B3异构体
经式
meridional (mer-)
面式
facial (fac-)
八面体配合物MA2B2C2
PtCl2(OH)2(NH3)2 [二氯•二羟•二氨合铂(IV))], 5 种异构体
C A| B
╲╱
M ╱╲ B| A
C 全反
C A|C
╲╱
M ╱╲ B| A
紫色 亮绿色 暗绿色
(4) 配位异构:
[Co(en)3][Cr(ox)3] [Cr(en)3][Co(o在空间排列位置不同引起的异构现象 ➢空间几何异构
➢旋光异构(光学异构)
9.2.2.1 空间几何异构
• 顺反异构
顺式 cis - PtCl2(NH3)2
极性
0
水中溶解度 0.2577 / 100 g H2O
1. 两种异构体互为镜象,但永远不能完全重叠(类 似左、右手关系),称为一对“对映体”, 也称 “手性分子”。 2. 平面偏振光通过这两种异构体时,发生相反方向 的偏转(右旋 d, 左旋 l )。
[Co(en)3]3+
[Co(C2O4)3]4-
l-尼古丁(天然)毒性大 d-尼古丁(人工)毒性小
(1) 键合异构
[Co(NO2)(NH3)5]Cl2 硝基, nitro 黄褐色, 酸中稳定
[Co(ONO)(NH3)5]Cl2 亚硝酸根, nitrito 红褐色, 酸中不稳定
(2) 电离异构
[Co(SO4)(NH3)5]Br [CoBr(NH3)5] SO4
(3) 水合异构
• [Cr(H2O)6]Cl3 • [CrCl(H2O)5]Cl2 ·H2O • [CrCl2(H2O)4]Cl ·2H2O
高中化学——配合物的几何结构与异构现象
第二节配合物的几何结构与异构现象一.知识储备1.配离子或配分子的空间结构根据配合物的配位数,可以判断配离子或配分子的空间结构。
不同配位数的配离子或配分子的空间结构2.配合物的异构现象化学式相同而结构不同的化合物其性质必然不同,此现象称为异构现象,这类化合物彼此称为异构体。
异构分为结构异构和立体异构。
结构异构——电离异构、水合异构、键合异构、配位异构。
立体异构——几何异构、旋光异构。
1.结构异构:组成相同但因原子之间连接方式不同所引起的异构现象。
(1)电离异构:具有相同化学组成的配合物,在溶液中电离时若能生成不同的离子,则这些配合物互为电离异构。
例如:[PtCl2(NH3)4]Br2与[PtBr2(NH3)4]Cl2。
(2)水合异构:当电离异构配合物分子中有一个配体换成水分子时就成为水合异构。
例如:[Cr(H 2O)6]Cl 3(紫色)、[CrCl(H 2O)5]Cl 2.H 2O(亮绿色)与[CrCl 2(H 2O)4]Cl.2H 2O(暗绿色)。
(3)键合异构:有一些配体能够以二种或多种不同方式与中心离子键合。
例如:[Co(NO 2)(NH 3)5]Cl 2(黄褐色)与[Co(ONO)(NH 3)5]Cl 2(红褐色);[Cr(SCN)(H 2O)5]2+与[Co(NCS)(H 2O)5]2+。
(4)配位异构:在由配阳离子和配阴离子组成的盐里,因配体在配阳离子和配阴离子中分配不同而引起的异构现象。
例如:[Co(NH 3)6][Cr(CN)6]与[Cr(NH 3)6] [Co(CN)6];[Cr(NH 3)6]2.立体异构:配体在中心原子周围因排列方式不同而产生的异构现象,称为立体异构。
立体异构分为几何异构和旋光异构。
(1)几何异构(顺—反异构)四配位数的平面四边形配合物可能形成几何异构,而四面体构型的配合物不存在几何异构现象。
几何异构体之间不仅物理性质不同,而且某些化学性质也差别很大。
①平面四边形配合物MA 2B 2型平面四边形配合物有顺式和反式两种异构体。
配位化学(第二章)
有三种水合异构体。 [ Cr Cl (H2O)5 ] Cl2 · H2O
蓝绿色
[ Cr Cl2 (H2O)4 ] Cl · 2H2O
绿色
(6)聚合异构 具有相同的化学式,各个聚合异构体的化学 式是最简式的 n 倍。例如: [ Co(NH3)3(NO2)3 ] n =1 [ Co(NH3)6 ] [ Co(NO2)6 ] n =2 [ Co(NH3)4(NO2)2 ] [ Co(NH3)2(NO2)4 ] n =2 [ Co(NH3)5(NO2) ] [ Co(NH3)2(NO2)4 ] 2 n =3 [ Co(NH3)6 ] [ Co(NH3)2(NO2)4 ] 3 n =4 [ Co(NH3)4(NO2) 2 ] 3 [ Co(NO2)6] [ Co(NH3)5(NO2) ] 3 [ Co(NO2)6] 2 n =4 n =5
可见,多原子配体分别以不同种 配位原子与中心离子键合的现象称为 键合异构。
[ CoBr (NH3)5 ]SO4 → [ CoBr (NH3)5]2+ + SO42暗紫色
[ Co SO4(NH3)5 ] Br → [ Co SO4(NH3)5]+ + Br紫红色
(5)水合异构 凡是化学组成相同,但水分子在内界和外界 分布不同的配合物,互为水合异构。 例如:CrCl3· 6H2O [ Cr(H2O)6 ] Cl3
Co
Cl
H3 N H3 N
NH3
Co
Cl
NH3
面式-三氯· 三氨合钴(Ⅲ) fac-[ Co(NH3)3Cl3
Cl
经式-三氯· 三氨合钴(Ⅲ) mer-[ Co(NH3)3Cl3 ]
2.2.2 旋光异构现象
旋光异构又叫对映异构。 对映异构:组成相同,空间构型相同,互为不 可重叠的镜像关系,就象人的左右手一样,这样的 异构体叫对映异构体。 例如: Ma2b2 c2型八面体配合物有一对对映 异构体。
5配合物的异构现象
O 配位
[Co(NH3)5(ONO)]2+
亚硝酸根·五氨合钴(III),红褐色
PPT编号13-2-2-11
旋光异构
两个配合物不能重合,二者互成镜像,就像人的左 右手一样,它们能使偏振光的偏转角度相同,但是偏转 方向相反,这种异构现象称为旋光异构。
旋光异构体分左旋(–)和右旋(+)异构体。
问题:如何判断一个配合物是否有旋光异构体存在? 通常是看该配合物的几何构型中有没有对称面或
如: [Co(NH3)6][Cr(C2O4)3] [Cr(NH3)6][Co(C2O4)3]
PPT编号13-2-2-10
(3)键合异构
在由两可配体形成的配合物中,由于配位原子的不同 而引起的异构现象成为键合异构。
两可配体 NO2-
N 配位
[Co(NH3)5(NO2)]2+
硝基·五氨合钴(III),黄褐色
反式 - [Pt(NH3)2Cl2]
棕黄色 μ=0 无抗癌活性
PPT编号13-2-2-4
对于 6 配位的八面体配合物而言,异构现象比较复杂, 取决于配体的种类和数目。
例 1: 通式为 MA2B4 的正八面体配合物,有 2 种顺反 异构体。
Cl
H3N
Cl
Cr
H3N
NH3
NH3
顺式 - [Cr(NH3)4Cl2]+ 紫色
Cl
H3N
NH3
Cr
H3N
NH3
Cl
反式 - [Cr(NH3)4Cl2]+ 绿色
PPT编号13-2-2-5
例 2: 通式为 MA2B2C2 的正八面体配合物,有 5 种顺反 异构体。
A
C
C
配位化学第4章 配合物的立体化学与异构现象
迄今为止, 罕有五配位化合物异构体的实例报道, 无 疑这与TBP←→SP两种构型容易互变有关, 因为互 变将使得配体可以无差别的分布于所有可能出现的 位置.
尽管X-射线衍射和红外光谱结果显示, 在[Fe(CO)5] 和PF5中, 处于轴向(z轴)的配体和处于赤道平面(xy 平面)的配体, 其环境是不等价的, 但NMR研究却证 实, [Fe(CO)5]或PF5中所有五个配位位置的配体都 是完全等价的, 这些结果揭示出这些分子在溶液中 具有流变性(fluxional molecules), 即分子结构在溶 液中的不确定性.
217 pm 187 187
Ni
187 184
199 pm 183
190 Ni
185 191
四方锥
变形三角双锥
图 4–3 在配合物[Cr(en)3][Ni(CN)5]1.5H2O中, 配阴离 子[Ni(CN)5]3–的两种结构
b) 三角双锥结构
五配位的非金属化合物如PF5具有三角双锥结构, 轴向 和赤道平面的P–F键键长是非等价的. 一般说来, 在PX5 分子中, 轴向键长比赤道平面的键长要稍长些. 但在配 合物[CuCl5]3−中赤道平面的键长反而比轴向键长稍微长 一些, 见图 4–2.
欲从四方锥(SP)构型转变成三角双锥(TBP)构型的话, 结构上看, 只需要挪动其中一个配体的位置即可, 反之 亦然.
在图 4–3中列出了[Ni(CN)5]3−既可以采取四方锥结构也 可以采取歪曲的三角双锥结构. 将四方锥底的两个对位 配体向下弯曲可转变成三角双锥结构的两个赤道配体, 在这个扭变的三角双锥结构中, 赤道平面的另一个配体 源于原先的锥顶配体, 赤道平面上的其中一个C–Ni–C 夹角(142°)要明显大于另外两个C–Ni–C的夹角 (107.3°和111
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
构造异构: 3、配合异 由于配体在配阳离子和配阴离子之间分配不同 而引起的异构。
①金属离子不同。 如:[Cu(NH3)4][PtCl4] 紫色 和[Pt(NH3)4][CuCl4] 绿色 [Co(NH3)6][Cr(CN)6]和[Cr(NH3)6][Co(CN)6]; ②金属离子相同,但配体不同。 [Co (NH3)4(NO2)2][Co (NH3)2(NO2)4]和 [Co (NH3)6][Co (NO2)6]
一般可分为非对映异构和对映异构两类
非对映异构
和对映异构
非对应异构
构造式相同,构型不同,但不是实物与镜象关系的化合 物互称非对应体。
多形异构:分子式相同,立体结构不同的异构体。如 [Ni(P)2Cl2] 存在以下两种异构体(P代表二苯基苄基膦)
P Cl Ni Cl P 红色、反磁性 Cl P 蓝绿色、顺磁性 P Ni Cl
顺反异构
配合物中,配体可占据中心原子周围的不同位置。 如配体处于相邻的位置叫顺式结构,如配体处于相对 的位置叫反式结构,分子的构造相同,由配体所处的 顺反位不同而产生的异构现象称为顺反异构现象。 最典型的代表是 [PtCl2(NH3)2],其有两种几何异构 体分别为顺式和反式。如图
Cl Pt Cl
NH3
顺式(绿色)
反式(紫色)
py Pt Cl Pt Br H3N py
如2:[Pt(NH3)(py)ClBr]
Cl Pt Br NH3 H3N py Cl Br
1.2 配合物的异构现象
配合物的异构现象是指分子式(实验式)相同 而原子间的联结方式或空间排列方式不同而引起 结构和性质不同的现象。一般可分为构造异构和 立体异构。 构造异构:化学式相同,成键原子连接方式不同 (原子排列次序不同)的异构体。 立体异构:化学式和原子排列次序都相同,仅原 子在空间的排列不同的异构体。
1.2 配合物的异构现象
构造异构: 水合异构、电离异构 配位异构、聚合异构 键合异构 立体异构 :非对眏异构 对眏异构 几何异构 多形异构
配合物的异构现象不仅影响其物理和化学性质, 而且与配合物的稳定性和键性质也有密切关系。 其中最重要的是几何异构现象和光学异构现象。
一、构造异构:
1.水合异构体 凡是化学组成相同,但水分子在分子的内界和外界 分布不同的配合物。 如:[Cr(H2O)6]Cl3 (紫色) [Cr(H2O)5Cl]Cl2·H2O (绿色)
当光通过含有某物质的溶液时, 使经过此物质的偏振光平面发 生旋转的现象。可通过存在镜 像形式的物质显示出来,这是 由于物质内存在不对称碳原子 或整个分子不对称的结果。 由于这种不对称性,物质对偏 振光平面有不同的折射率,因 此表现出向左或向右的旋光性。 利用旋光性可以对物质(如某些 糖类)进行定性或定量分析。
O H3 N H3 N
12O. 8
O NH3
O N
125 . 3
119 . 6 N
191. 9
131 . 5 O
195. 6 Co 195 . 7
197. 7
H3 N
196. 8
193. 7
NH3 NH3
Co 191. 3
194. 9
NH3
H3 N
NH3
NH3
二、立体异构
实验式相同,成键原子的联结方式也相 同,但空间排列不同。 最常见是顺反异构现象,主要是配位数为 4 的平面正方形和配位数为8的八面体中。
水合异构体的物化性质和热稳定性都有很大 的差别。 如:
构造异构:
2、电离异构 由于阴离子处于内界或外界之间进行交换而引起 的异构现象。
溶液中加入 BaCl 2 生成白色沉淀,室温下与 AgNO3 无反应。
溶液中室温下加入BaCl2无反应,但加入 AgNO3有大量的沉淀产生。 同样,反式-[CoCl2(en)2]NO2(绿色)与反式[CoCl( NO2)(en)2] Cl (红色)也互为电离异构体。
[Cr(H2O)4Cl2]·2H2O (绿色)。
见14页表1-1 [Co(NH3)4Cl2]Cl· H2O和[Co(NH3)4(OH2)Cl]Cl2; [Co(NH3)5(NO3)](NO3)2·H2O和[Co(NH3)5(OH2)](NO3)3 [Cr(Py)2(OH2)Cl3]· H2O和[Cr(Py)2(OH2)2 Cl2]Cl等。
第一章 配合物的异构现象
异构现象 :
配合物中原子间的联结方式及配体在空间的位置不同 而产生的异构现象。 如1:[Pt(NH3)2Cl2]
Cl Pt Cl NH3 H3N NH3 Cl Pt Cl NH3
顺式
反式
平面正方形配合物
Cl Cl NH3 H3N Cl NH3
H3N NH3
NH3
H3N Cl
旋 光 性
旋光异构体(对映异构体): CHClBrI
H Br C Cl I I
H C Cl Br
有对称面或对称中心的分子不存在旋光异构体。
③氧化态不同的同一金属离子与不同配位体配合。
[PtⅡ(NH3)4][PtⅣCl6]和 [PtⅣ(NH3)4Cl2][PtⅡCl4]
配位异构: 这种异构仅存在于由配阳离子和配阴离 子所组成的盐中,它们之间差别在于配阳离 子和配阴离子中配位体分布情况不同。
构造异构:
4、聚合异构 配合物的聚合异构现象与一般化合物的聚合现象不同,它 不是简单分子的聚合,而是由配位体的不同排列所形成的 配位异构体。 同系列的聚合异构体中,各个配合物的分子量正好为该系 列中最简式的整数倍。 [Co (NH3)6][Co (NO2)6] 黄色 [Co (NH3)6][Co (NH3)2(NO2)4]黄橙色 [Co (NH3)4(NO2)2][Co (NH3)2(NO2)4]黄棕色
构造异构: 5、键合异构 同一种多原子配体与金属离子配位时,由于 键合原子的不同而造成的异构现象称为键合构体。
如:NO2-作为配体时 可用O原子配位亚硝酸根配合物。 可用N原子配位硝基配合物。
[Cr(H2O)5SCN]2+和[Cr(H2O)5NCS]2+
如[Co(NH3)5NO2]2+黄色, [Co(NH3)5(ONO )]2+红色 硝基· 五氨合钴(Ⅲ)离子 亚硝酸根· 五氨合钴(Ⅲ)离子
4.聚合异构 聚合异构并非真正的异构体,它们具有相同的 最简式,习惯上称它们为聚合异构。 如:[Co(NH3)3(NO2)3] n=1 [Co(NH3)6][Co(NO2)6] n=2 [Co(NH3)4(NO2)2][Co(NH3)2(NO2)4] n=2 [Co(NH3)5(NO2)][Co(NH3)2(NO2)4]2 n=3 [Co(NH3)4(NO2)2]3[Co(NO2)6] n=4 [Co(NH3)5(NO2)]3[Co(NO2)6]2 n=5
顺式,抗癌活性
NH3 NH3
Cl Pt NH3
NH3 Cl
反式,无抗癌活性
旋光异构现象 (optical isomerism)
旋光活性:
手性分子对偏振光有作用, 能使偏振光向某一方向旋 转某一角度,而且组成相 同的一对对映体使偏振光 向不同的方向旋转,一个 对映体使偏振光旋转的性 质称为旋光活性或光学活性。
