第四章 物料衡算
第四章化工工艺计算

设反应器入口至循环压缩机进口压降为450kpa,进口温度313k,压缩机出口压 力3500kpa,压缩过程的多变指数n=1.4,效率η=0.72,压缩因子Z=1,则每 kmol循环压缩机的理论功耗:
W= n P2 × ZRT ( ) ( n −1) / n − 1 n −1 P1
则:
x3 = 0.995(0.98x1 + 0.95x2) 0.90x3/2 = 0.95x2 0.99(0.98x1 + 0.95x2) = 200
(1) (2) (3)
联立(1)(2)得 x2 = 0.995(0.98x1 + 0.95x2) ×0.9/1.9 x2 = 0.837x1 联立 (3)(4) x1=113.8 x2=95.3 因此:Cl2流量=x1=113.8kmol/h C2H4=x1+x2=209.1kmol/h HCl循环量x3=0.995 ×(0.98×113.8+0.95 ×95.3)=201.1kmol/h 解(2) 直接迭代法 设以HCl的循环量x3作为迭代变量 (4)
(1)物料衡算提纲。 )物料衡算提纲。
(2)工艺流程图及说明。 )工艺流程图及说明。 (3)热量计算参数和设备计算数据(∆H、Cp、K、λ、 )热量计算参数和设备计算数据( 、 、 、 、 α等)。 等 (4)流体输送过程参数(粘度 、密度 、摩擦系数 )流体输送过程参数(粘度µ、密度ρ、 等)。
(5)传质过程系数,相平衡数据。 )传质过程系数,相平衡数据。 (6)冷冻过程的热力学参数。 )冷冻过程的热力学参数。 (7)具体的工艺操作条件(温度 、压力 、流量 ) )具体的工艺操作条件(温度T、压力P、流量G) (8)介质物性和材质性能,材质数据,腐蚀数据。 )介质物性和材质性能,材质数据,腐蚀数据。 (9)车间平立面布置的参考资料。 )车间平立面布置的参考资料。 (10)管道设计资料(管道配置、管道材质、架设方 )管道设计资料(管道配置、管道材质、 式、管件、阀件等) 管件、阀件等) (11)环境保护、安全保护等规范和资料。 )环境保护、安全保护等规范和资料。
第四章物料衡算

第四章物料衡算第四章物料衡算1.教学⽬的与要求掌握化⼯过程物料衡算的基本⽅法,包括⽆化学反应的物料衡算、有化学反应的物料衡算。
2.主要教学内容物料衡算式、物料衡算的基本⽅法、⽆化学反应的物料衡算、有化学反应的物料衡算以及物料衡算的计算机解题。
3.重点与难点:重点:⽆化学反应及有化学反应的物料衡算⽅法难点:具有循环、排放及旁路过程的物料衡算4.学时分配: 8+6S 学时物料衡算是化⼯计算中最基本、也是最重要的内容之⼀,它是能量衡算的基础。
通常,物料衡算有两种情况,⼀种是对已有的⽣产设备或装置,利⽤实际测定的数据,算出另—些不能直接测定的物料量。
⽤此计算结果,对⽣产情况进⾏分析、作出判断、提出改进措施。
另⼀种是设计⼀种新的设备或装置,根据设计任务,先作物料衡算,求出进出各设备的物料量,然后再作能量衡算,求出设备或过程的热负荷,从⽽确定设备尺⼨及整个⼯艺流程。
物料衡算的理论依据是质量守恒定律,即在—个孤⽴物系中,不论物质发⽣任何变化,它的质量始终不变(不包括核反应,团为核反应能量变⽐⾮常⼤,此定律不适⽤)。
第⼀节物料衡算式4-1 化⼯过程的类型化⼯过程根据其操作⽅式可以分成间歇操作、连续操作以及半连续操作三类。
或⾏将其分为稳定状态操作和不稳定状态操作两类。
在对某个化⼯过程作物料或能量衡算时,必须先了解⽣产过程的类型。
间歇操作过程:4-2 物料衡算式物料衡算是研究某⼀个体系内进、出物料量及组成的变化。
根据质量守恒定律,对某⼀个体系,输⼊体系的物料量应该等于输出物料量与体系内积累量之和。
所以,物料衡算的基本关系式应该表⽰为;如果体系内发⽣化学反应,则对任⼀个组分或任⼀种元素作衡算时,必须把由反应消耗或⽣成的量亦考虑在内。
所以(4—1)式成为:上式对反应物作衡算时.由反应⽽消耗的量,应取减号,对⽣成物作衡算时,由反应⽽⽣成的量,应取加号。
但是,列物料衡算式时应该注意,物料平衡是指质量平衡,不是体积或物质的量(摩尔数)平衡。
第四章物料衡算

生成CO2量
3mol
剩余氧量
6.25-5=1.25mol
产生烟道气的量=3+4+1.25+23.51 =31.76mol
100mol烟道气所需空气的量 100×29.76/31.76=93.7mol (二)取1mol 空气为计算基准 1mol 空气为计算基准中氧量为0.21mol 燃烧丙烷耗氧量 0.21/1.25=0.168 mol
2)采用适当方法求解方程
7、将计算结果列成输入—输出物料表
组分
输入
输出
kg/h w% kmol/h y% kg/h w% kmol/h y% A B
C 总计
由计算结果查核计算正确性,必要时说明误差范围。
8、必要时画出物料衡算图(过程复杂时)
对于复杂过程的物料衡算,上述各步均不可 少。但对于较简单的物料衡算问题,有的步骤可 省略。但(2)、(3)、(4)、(5)、(6)、 (7)是必有的。
(4—1)
化学反应时,对任一组分或元素的物料衡算式为:
输入体 反应生 反应消 输出体 体系内
系的物 + 成的物 - 耗的物 = 系的物 + 积累的
料的量 料的量 料的量 料的量 物料量
(4-2) (4—2)式可作为
总物料衡算式
组分物料衡算式 元素物料衡算式
对稳定操作状态,积累量=0。
无化学反应体系:
3、体积基准 对气体选用体积作基准。通常取标况下体积Nm3。 4、干湿基准 干基不计所含水量,湿基考虑所含水量。 恰当的选取计算基准可简化计算。
例题 丙烷充分燃烧时,通入的空气量为理论量 的125%,反应式为
C3H8+5O2==3CO2+4H2O 问100mol 燃烧产物需要多少摩尔空气?
第四章 物料衡算

G3
G1
330 10000 1000 kg 330
106 .17 1000 1404 .6kg 151 .17 0.50
1404 .6 1478 .6kg 95 %
• 杂质1478.6-1404.6=74kg
17
• (3)计算混酸量及配制混酸的硫酸、硝酸和水量
• 所需混酸量:1478.6×1.855=2742.8kg • 纯硝酸重:2742.8×32%=877.7Kg • 96%硝酸量:877.6/0.96=914.3kg • 硝酸中水量:914.3-877.7=36.6kg
16
• (2)对间歇生产可确定计算基准为kg/天,则需计算每天产量及原料投 料量。反应式为:
C2H5 + HNO3 106.17 G1 63 G2 H2SO4.H2O NO2 151.17 G3 G5 G4 C2H5 [ C2H5 NO2 C2H5 NO2 ] + H2O
• 每天产对硝基乙苯:
• 每天投料纯乙苯量: • 原料乙苯量
4.物料衡算式
• 根据质量守恒定律可以写出: • 进入系统的物料质量 Fi+系统内生成量 Dp-系统内消 耗量 Dr= 输出系统的物料质量 Fo +系统内积累的物 料质量W • 即:(Fi-Fo)+(Dp-Dr)=W • 对于稳定的连续生产过程: (Fi-Fo)+(Dp-Dr)=0 • 对于系统内无化学反应:(Fi-Fo)=W
• 纯硫酸量:2742.8×56%=1536kg
• 93%硫酸量:1536/0.93=1651.6kg • 硫酸中水量:1651.6-1536=115.6kg
• 补加水量:2742.8-914.3-1651.6=176.9kg
(整理)第四章能量衡算及热数据的估算习题解答
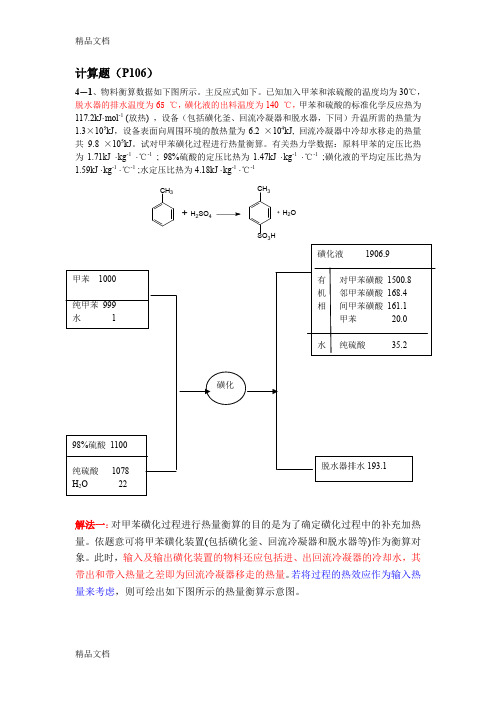
计算题(P106)4-1、物料衡算数据如下图所示。
主反应式如下。
已知加入甲苯和浓硫酸的温度均为30℃,脱水器的排水温度为65 ℃,磺化液的出料温度为140 ℃,甲苯和硫酸的标准化学反应热为117.2kJ·mol -1 (放热) ,设备(包括磺化釜、回流冷凝器和脱水器,下同)升温所需的热量为1.3×105kJ ,设备表面向周围环境的散热量为6.2 ×104kJ, 回流冷凝器中冷却水移走的热量共9.8 ×105kJ 。
试对甲苯磺化过程进行热量衡算。
有关热力学数据:原料甲苯的定压比热为1.71kJ ·kg -1 ·℃-1 ; 98%硫酸的定压比热为1.47kJ ·kg -1 ·℃-1 ;磺化液的平均定压比热为1.59kJ ·kg -1 ·℃-1 ;水定压比热为4.18kJ ·kg -1 ·℃-1解法一:对甲苯磺化过程进行热量衡算的目的是为了确定磺化过程中的补充加热量。
依题意可将甲苯磺化装置(包括磺化釜、回流冷凝器和脱水器等)作为衡算对象。
此时,输入及输出磺化装置的物料还应包括进、出回流冷凝器的冷却水,其带出和带入热量之差即为回流冷凝器移走的热量。
若将过程的热效应作为输入热量来考虑,则可绘出如下图所示的热量衡算示意图。
CH 3+H 2SO 4CH 33H+H 2O则热量平衡方程式可表示为 取热量衡算的基准温度为25o C (若取0 ℃作为基准,结果又如何?),则(1)(2)磺化过程热效应反应中共加入98%浓硫酸的质量为1100kg ,其中含水22kg 。
若以SO 3计,98%硫酸的质量分率为80%。
由式(4-44)得反应结束后,磺化液含硫酸35.2kg,水21.4kg 。
以SO 3计,硫酸的质量分率为50.8%。
则1234567Q Q Q Q Q Q Q ++=+++141000 1.71(3025)1100 1.47(3025) 1.6610Q kJ=⨯⨯-+⨯⨯-=⨯3p cQ Q Q =+1-122111 2.989(2515)110.20130.062 4773.4 kJ (kg H )s H m mm mO -∆=+--++=⋅2-122111 2.989(2515)10.50810.5080.20130.0620.5080.5081833.6 kJ (kg H )s H O ⨯-∆=+--++=⋅所以有反应消耗的甲苯量为979 kg ,则(3)反应产物(磺化液、脱水器排出的水)带走的热量Q 4 Q 4=1906.9 x 1.59 x (140-25)+193.1 x 4.18 x (65-25)=3.77 x 105 KJ (4)由题意知 Q 5=1.3 x 105 KJ Q 6=6.2 x 104 KJ Q 7=9.8 x 105 KJ 所以Q 2=Q 4+Q 5+Q 6+Q 7-Q 1-Q 3=2.12 x 105 KJ4224773.421.41833.6 6.610p Q kJ=⨯-⨯=⨯kJ1025.1 2.1179210979Q 63c ⨯=⨯⨯=kJ1032.1 1025.1106.6 Q Q Q 664cp 3⨯=⨯+⨯=+=解法二:对甲苯磺化过程进行热量衡算的目的是为了确定磺化过程中的补充加热量。
第四章物料衡算

① 反应器的循环物流;② 分离器的循环物流
38
4.8 复杂化工过程的物料衡算
3.循环过程的物料衡算
N4
N1
U
混合器
N2
单元设备
N3
S
分离设备
N5
3个子体系,总体系3个独立的
39
1.收率和转化率
反应消耗的反应物的量 转化率 100% 进入反应器的反应物的 量
连续稳定流动过程收率的计算:
xj
xj
r 'j N 进, j
( N 进, j N 出, j ) N 进, j
26
100 %
4.7 有化学反应过程的物料衡算
1.收率和转化率——选择性
生成目的产物所消耗的 反应物的量 选择性 100% 反应消耗的反应物的量
E s
i
i, j
i,k mk 0
i, j
N i xi, j σ j,k 0
k 1 i 1 j 1
E
c
N x
k 1 i 1 j 1 i
17
c
σ j,k mk 0
4.4 物料衡算式
(4)自由度分析 方程组自由度≡变量数-方程数
方程组自由度﹤0 方程组自由度﹥0 方程组自由度=0 无解 多解(超定解、不定 解) 有唯一确定解
平均质量流量 摩尔流量 流股i 的流量
N 进和N出
X i, j ; x i, j
组分j在流股i的组成 组分j在流股i的原子系数 元素k的原子量
M i ; Fi ; N i
i, j mK
12
4.4 物料衡算式
1.物料平衡式 (1)总质量平衡式 敞开(开放)系统的物料平衡式
第四章 物料衡算

第四章物料衡算❖第一节概述❖第二节物料衡算基本理论❖第三节物料衡算举例4.1 概述❖4.1.1.物料衡算的重要性❖求出各种物料的数量和组成,设计由定性转入定量。
❖设计中,物料衡算是最先进行的计算项目,其结果是后续各单项设计的依据,物料衡算结果的直接关系到整个工艺设计可靠程度。
❖4.1.2.物料衡算的依据❖工艺流程示意图以及为物料衡算收集的有关资料。
4.1.3.物料衡算的作用❖将工艺流程示意图进一步深化,可绘制出物料流程图。
❖在物料衡算的基础上,可进行能量衡算、设备的选型或工艺设计,以确定设备的容积、台数和主要工艺尺寸、确定消耗定额、进行车间布置设计和管道设计。
❖对已投产的设备、装置、车间或工厂进行物料衡算,以寻找薄弱环节,为改进生产、完善管理提供可靠的依据❖可作为判断工程项目是否达到设计要求以及检查原料利用率和三废处理完善程度的一种手段。
4.1.4.物料衡算的类型❖按物质变化分为:❖物理过程的物料衡算❖化学过程的物料衡算❖按操作方式分为:❖连续过程的物料衡算❖间歇过程的物料衡算❖按衡算目的分为:4.2 物料衡算的基本理论4.2.1物料平衡方程式❖理论基础是质量守恒定律。
❖1.物理过程❖稳态过程,物料在体系内没有累积2.化学过程❖对于稳态过程使用上述各式时要注意以下几点:4.2.2 衡算基准❖1、时间基准❖对连续稳定流动体系,以单位时间作基准。
该基准可与生产规模直接联系❖对间歇过程,以处理一批物料的生产周期作基准。
❖2、质量基准❖对于液、固系统,因其多为复杂混合物选择一定质量的原料或产品作为计算基准。
❖若原料产品为单一化合物或组成已知,取物质量(mol)作基准更方便。
3、体积基准❖对气体选用体积作基准。
通常取标况下体积Nm3(Hm3)❖在进行物料衡算或热量衡算时,均须选择相应的衡算基准。
合理地选择衡算基准,不仅可以简化计算过程,而且可以缩小计算误差基准选取中几点说明:❖(1)上面几种基准具体选哪种(有时几种共用)视具体条件而定,难以硬性规定。
第四章 物料衡算

以流程中某一点的汇集或分支处的交点, 即 节点来进行衡算, 可以使计算简化
36
37
38
39
6、 带有物料循环的流程的物料衡算
带有物料循环的流程示意图
40
对循环系统来说, 有单程转化率、单程收率和总转
化率、总收率之分, 由于原料循环, 新鲜原料在系
统内经过反应器若干次, 达到的转化率和收率比经
第四章 物料衡算及热量衡算
14.1 ຫໍສະໝຸດ 料衡算一、物料衡算的目的
(1)原材料消耗定额,判断是否达到设计要求。 (2)各设备的输入及输出的物流量,摩尔分率组成及 其他组成表示方法。 (3)作为热量计算的依据。
2
二、物料衡算的依据
(1)设计任务书中确定的技术方案、产品生产能力、
年工作时及操作方法。
13
对于流动物系: xi=Fi/Ft , Fi – i组分的摩尔流量; Ft - 混合物总物汁的量。
质量分数:混合物中, 某组分的质量与混合物
质量之比。ωi
14
质量分数与摩尔分数的相互转换:
摩尔分数 xi=(ωi/Mi) ÷ (ωi/Mi +ωj/Mj)
质量分数 ωi=(xiMi) ÷ (xiMi + xjMj)
过反应器一次的转化率和收率高。
41
如果有循环物流的话, 由于循环量不知道, 逐次单元计算 不能算出循环量。 这类问题有两种解法。
(1) 试差法: 估计循环流量, 继续循环至循环回流的那一点。
将估计值与计算值进行比较, 并重新估计一个循环值,
一直计算到估计值与计算值之差在一定误差范围内。
42
(2) 代数解法: 在循环存在时, 列出物料平衡方程式,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章物料衡算第四章物料衡算1.教学目的与要求掌握化工过程物料衡算的基本方法,包括无化学反应的物料衡算、有化学反应的物料衡算。
2.主要教学内容物料衡算式、物料衡算的基本方法、无化学反应的物料衡算、有化学反应的物料衡算以及物料衡算的计算机解题。
3.重点与难点:重点:无化学反应及有化学反应的物料衡算方法难点:具有循环、排放及旁路过程的物料衡算4.学时分配: 8+6S 学时物料衡算是化工计算中最基本、也是最重要的内容之一,它是能量衡算的基础。
通常,物料衡算有两种情况,一种是对已有的生产设备或装置,利用实际测定的数据,算出另—些不能直接测定的物料量。
用此计算结果,对生产情况进行分析、作出判断、提出改进措施。
另一种是设计一种新的设备或装置,根据设计任务,先作物料衡算,求出进出各设备的物料量,然后再作能量衡算,求出设备或过程的热负荷,从而确定设备尺寸及整个工艺流程。
物料衡算的理论依据是质量守恒定律,即在—个孤立物系中,不论物质发生任何变化,它的质量始终不变(不包括核反应,团为核反应能量变比非常大,此定律不适用)。
第一节物料衡算式4-1 化工过程的类型化工过程根据其操作方式可以分成间歇操作、连续操作以及半连续操作三类。
或行将其分为稳定状态操作和不稳定状态操作两类。
在对某个化工过程作物料或能量衡算时,必须先了解生产过程的类型。
间歇操作过程:4-2 物料衡算式物料衡算是研究某一个体系内进、出物料量及组成的变化。
根据质量守恒定律,对某一个体系,输入体系的物料量应该等于输出物料量与体系内积累量之和。
所以,物料衡算的基本关系式应该表示为;如果体系内发生化学反应,则对任一个组分或任一种元素作衡算时,必须把由反应消耗或生成的量亦考虑在内。
所以(4—1)式成为:上式对反应物作衡算时.由反应而消耗的量,应取减号,对生成物作衡算时,由反应而生成的量,应取加号。
但是,列物料衡算式时应该注意,物料平衡是指质量平衡,不是体积或物质的量(摩尔数)平衡。
若体系内有化学反应,则衡算式中各项用摩尔/时为单位时,,必须考虑反应式中的化学计量系数。
出为反应前后物料中的分子数不守恒。
第二节物料衡算的基本方法进行物料衡算时,为了能顺利地解题,避免错误,必须掌握解题技巧,按正确的解题方法和步骤进行。
尤其是对复杂的物料衡算题,更应如此,这样才能获得准确的计算结果。
4-3 画物料流程简图方法求解物料衡算问题,首先应该根据给定的条件画出流程简图。
图中用简单的方框表示过程中的设备,用线条和箭头表示每个流股的途径和流向。
并标出每个流股的已知变量(如流量、组成)及单位。
对一些未知的变量,可用符号表示。
4—4 计算基准及其选择进行物料、能虽衡算时,必须选择一个计算基准。
从原则上说选择任何一种计算基准,都能得到正确的解答。
但是,计算基准选择得恰当,可以使计算简化,避免错误。
对于不同化工过程,采用什么基准适宜,需视具体情况而定,不能什硬性规定。
根据不同过程的特点,选样计算基准时,应该注意以下几点:1. 应选择已知变量数最多的流股作为计算基准。
2.对液体或固体的体系,常选取单位质量作基准。
3. 对连续流动体系,用单位时间作计算基准有时较方便。
4. 对于气体物料,如果环境条件(如温度、压力)已定,则可选取体积作基准。
4—5物料衡算的步骤1搜集计算数据。
2画出物料流程简图。
3确定衡算体系。
4写比化学反应方程式,包括主反应和副反应,标出有用的分子量,如果无化学反应,则此步可免去。
5选择合适的计算基准,并在流程图上注明所选的基准值。
6.列出物料衡算式,然后用数学方法求解。
7.将计算结果列成输入一输出物料表。
第三节无化学反应过程的物料衡算在化工过程中,—些只有物理变化不发生化学反应的单元操作,如混合、蒸馏、蒸发、干燥、吸收、结晶、萃取等,这些过程的物料衡算都可以根据物料衡算式(4—3),列出总物料和各组分的衡算式,再用代数法求解。
4-6 简单过程的物料衡算简单过程是指仅有一个设备或一个单元操作或整个过程简化成一个设备的过程。
这种过程由物料衡算比较简单,在物料流程简图中,设备边界就是体系边界。
当利用代数法求解时,列衡算式应注意下列几点:1.无化学反应体系,能列出的独立物料衡算式数目,最多等于输入和输出物料中化学组分的数目。
2.首先列出含未知量数目最少的物料衡算方程,以便于解题。
3.总体系内具有很多多组分的物料,则最好将每个流股编号.并列表表示出己知的量和组成.检查能列出的衡算方程数目是否等于未知量的数目。
4—7 有多个设备过程的物料衡算对有多个设备的过程,进行物料衡算时,可以划分多个衡算体系。
此时,必须选择恰当的衡算体系,这是很重要的步骤。
不然会使计算繁琐,甚至无法求解。
例4—7 有两个蒸馏塔的分离装置,将含50%苯、30%甲苯和20%(mol %)二甲苯的混合物分成较纯的三个馏试份,其流程图及各流股组成如下图,计算蒸馏1000mol /h 原料所得各流股的量及进塔2物料组成。
有化学反应过程的物料衡算有化学反应的过程,物料中的组分比较复杂。
因为,工业上的化学反应,,各反应物的实际用量.并不等于化学反应式中的理论量。
为了使所需的反应顺利进行,或使其中较昂贵的反应物全部转化,常常使价格较低廉的一些反应物用量过量。
4—8 反应转化率、选择性及收率等概念工业化学反应过程中,当反应原料的配比不按化学计量比时,根据反应物的化学计量数大小可称其为限制反应物与过量反应物。
1.限制反应物:化学反应原料不按化学计量比配料时,其中以最小化学计量数存在的反应物称为限制反应物。
2.过量反应物:不按化学计量比配料的原料中,某种反应物的量超过限制反应物完全反应所需总的理论量,该反应物称为过量反应物。
3.过量百分数:过量反应物超过限制反应物所需理论量的部分占所需理论量的百分数。
4.转化率:5.选择性;6.收率:4—9 一般反应过程的物料衡算对有化学反应过程的物料衡算,由于各组分在过程中发生了化学反应,因此就不能简单地按(4—3)式列组分的衡算式,必须考虑化学反应中生成或消耗的量,应该根据化学反应式,按(4—4)式列衡算方程。
对一般的反应过程,可用下列几种方法求解。
一、直接求解法有些化学反应过程的物料衡算,有时只含一个未知量或组成,这类问题比较简单可根据化学反应式直接求解,不必列出衡算式,如下例。
二、元素衡算元素衡算是物料衡算的一种重要形式。
在作这类衡算时,并不需要考虑具体的化学反应,而是按照元素种类被转化及重新组合的概念表示为输入(某种元素)=输出(同种元素)对反应过程中化学反应很复杂,无法用一、两个反应式表示的物料衡算题,可以列出元素衡算式,用代数法求解。
三、用联系组分作衡算“联系组分”是指随物料输入体系,但完全不参加反应,又随物料从体系输出的组分。
在整个反应过程中,它的数量不变。
如果体系中存在联系组分,那么输入物料和输出物料之间就可以根据联系组分的含量进行关联。
例如,F、P分别为输入、输出物料,T为联系组分。
T在F中的质量分数为xfT在P中的质量分数为xPT,则F 与P之间的关系为4—10 有平衡反应过程的物料衡算对有平衡反应过程的物料衡算,除了需要建立物料或元素衡算式以外,常常还需要利用反应的平衡关系来计算产物的平衡组成。
讨算方法见下例。
4—11 具有循环、排放及旁路过程的物料衡算在化工过程中,有一些具有循环、排放及旁路的过程,这类过程的物料衡算与以上介绍的方法相类似,只是需要先根据已知的条件及所求的未知量选择合适的衡算体系,列出物料衡算式再求解。
如果存在联系组分,则可以利用联系组分计算。
一、循环过程的物料衡算在化工生产中,有一些反应过程每次经反应器后的转化率不高,有的甚至很低。
如乙烯氧化制环氧乙烷的过程,乙烯的单程转化率(即原料一次通过反应器的转化率)约30%左右;由氢、氮合成氨的单程转化率一般也只有20%左右。
而乙烯直接水合制乙醇的过程,乙烯的单程转化率只有4—5%。
因此在反应器出口的产物中有大量原料未反应。
为提高原料的利用率,把这部分末反应的原料从反应产物中分离出来,然后把它循环返回反应器,与新鲜物料一起再进行反应。
此过程即为循环过程。
其流程如图4—5。
某些无化学反应过程,如蒸发.结晶过程、精馏过程等,为了提高原料利用率或为保证产品质量、改善经济指标、也有采用循环过程的。
二、具有循环及排放过程的物料衡算循环过程在稳定状态下操作时,物料的质量既不积累也不消失,各流股的组分恒定。
但是,如果原料中含有不反应的杂质或惰性物质,经长时间的循环会使其浓度逐渐增加,因此就必须把一部分循环物料不断地排放掉,以维持进料中杂质的含量不再增大。
例如,假定反应器进料A的最初流量是100kg/h,进料含10ppm的惰性物质(以I表示),单程转化率为50%。
经反应后,剩下50kg/h未反应的原料和惰性物,将其与产物分离后全部循环。
由于总量减少了一半,所以循环料中惰性杂质含量增加一倍,为20ppm。
如图4—6①。
第二次进反应器的原料变成新鲜原料50%和循环物料50%的混合料,其中含I组份15ppm(因为循环料中含20ppm的I),第二次循环料中I组分含量增加到30ppm。
第三次通过反应器的原料中I组分就变成20ppm。
这样经长时间不停地循环,将会使循环料中杂质积累.浓度增高,以至影响正常生产。
为了排除积累的杂质,就必须排放一部分循环料。
图4—7为具有循环及排放过程的物料流程图。
图中W为排放物料,即从分离器出来的分三、具有旁路过程的物料衡算具有旁路的过程,就是把一部分物料绕过一个或多个设备,直接与另一流股物料相混,其流程如图4—8。
这类过程的物料衡算与循环过程的物料衡算相类似,计算时应注意结点平衡。
