课件:第一章 气体的pVT性质
合集下载
第一章气体的pVT关系-PPT精品

pB yBpp
B
B
上一内容 下一内容 回主目录
返回
2019/12/3
§1.2 理想气体混合物
• 理想气体混合物中某一组分 的分压力等于这个组分以同 混合物相同的温度和体积单 独存在时的压力。
pO2 yO2 p
pyO2pyN2p
上一内容 下一内容 回主目录
pN2 yN2 p
§1.2 理想气体混合物
nnO2 1 mo3 l.49mol yO2 0.29
VnpRT 5255 m 3
0.08m 53
上一内容 下一内容 回主目录
返回
2019/12/3
§1.3 气体的液化及临界参数
上一内容 下一内容 回主目录
返回
2019/12/3
§1.2 理想气体混合物
• 理想气体混合物的总体积等于 等于各个组分 以同混合物相同的温度和压力单独存在时的分 体积之和。
VVO2 VN2
V
O
2
V
N
2
上一内容 下一内容 回主目录
返回
2019/12/3
§1.2 理想气体混合物
例. 空气中氧气的体积分数为0.29,求 101.325kPa、25℃时的1m3空气中氧气的 摩尔分数、分压力、分体积,并求若想 得到1摩尔纯氧气,至少需多少体积的空 气。(将空气近似看成理想气体)
2019/12/3
§1.1 理想气体的状态方程
例:计算25℃,101325Pa时空气的密度。
(空气的分子量为29) 解:
V nR pT 8.31 15 2071 .1335 2 25 5 mom l3
4.0 87mom l3
d 空 = V 气 n M 4.8 0 2 79 g m 3 1.k 1m g 8 35
《气体的PVT关系》ppt课件

3 .导出量的计算质量m、密度等 如: =m/V=n•M/V=pM/(RT)
理想气体的模型
真实气体微观模型 分子间有相互作用,分子本身有体积。
吸引力: 分子相间隔较远时, 有范德华引力
排斥力 :分子相间隔较近时,
不
电子云及原子核产 生
可
无 限
排斥力
紧
缩
假设用E 代表分子间相互作用的势能,那么: E 吸引 -1/r6 E 排斥 1/rn
体〕 对于物质B
xB或yB
nB nB nA n
A
显然
xB 1
B
yB 1
B
用质量分数表示:
wB
mB mB mA m
A
wB 1
B
理气形状方程对理气混合物的运用
pVnRT nB RT
B
pV m RT Mmix
Mmix混合物的摩尔质
量
Mmix yBMB
B
3.道尔顿分压定律
分压定律:混合气体的总压等于混合气体中各组
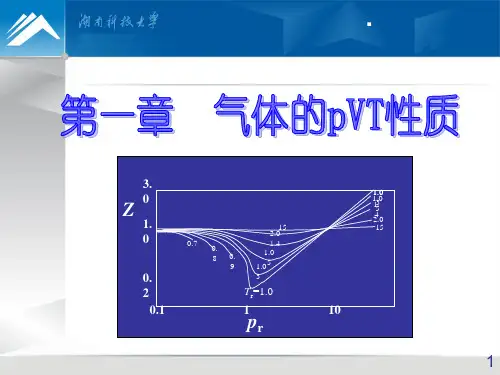
• Z >1,Vm(真实)> Vm (理想),
难紧缩
• 真实气体 Z 随温度、压力的种类而变化
§1.5 对应形状原理及普遍化紧缩因子
•对比参数:
Tr = T / TC
对比温度
pr = p /
pC对比
Vr = V / VC
对比体积
•对应形状原理—压—力各种不同的气体,只需
两个对比参数一样,那么第三个也一样。
P 0 V TTc
2P V2
TTc
0
§1.5 对应形状原理及普遍化紧缩因子
1. 紧缩因子
真实气体 pV=ZnRT Z—紧缩因子
或 pVm=ZRT
理想气体的模型
真实气体微观模型 分子间有相互作用,分子本身有体积。
吸引力: 分子相间隔较远时, 有范德华引力
排斥力 :分子相间隔较近时,
不
电子云及原子核产 生
可
无 限
排斥力
紧
缩
假设用E 代表分子间相互作用的势能,那么: E 吸引 -1/r6 E 排斥 1/rn
体〕 对于物质B
xB或yB
nB nB nA n
A
显然
xB 1
B
yB 1
B
用质量分数表示:
wB
mB mB mA m
A
wB 1
B
理气形状方程对理气混合物的运用
pVnRT nB RT
B
pV m RT Mmix
Mmix混合物的摩尔质
量
Mmix yBMB
B
3.道尔顿分压定律
分压定律:混合气体的总压等于混合气体中各组
• Z >1,Vm(真实)> Vm (理想),
难紧缩
• 真实气体 Z 随温度、压力的种类而变化
§1.5 对应形状原理及普遍化紧缩因子
•对比参数:
Tr = T / TC
对比温度
pr = p /
pC对比
Vr = V / VC
对比体积
•对应形状原理—压—力各种不同的气体,只需
两个对比参数一样,那么第三个也一样。
P 0 V TTc
2P V2
TTc
0
§1.5 对应形状原理及普遍化紧缩因子
1. 紧缩因子
真实气体 pV=ZnRT Z—紧缩因子
或 pVm=ZRT
第01章 气体的pVT性质
16
.
§ 1.1 理想气体
例 1.2.1 :今有 300 K,104 . 365 kPa 的湿烃类 混合气体(含水蒸气的烃类混合气体),其中水 蒸气的分压为3.167 kPa,现欲得到除去水蒸气 的 1 kmol 干烃类混合气体,试求:(1)应从湿烃 混合气体中除去水蒸气的物质的量;(2)所需湿 烃类混合气体的初始体积。
25
.
§ 1.2 真实气体
•压力修正: 实际气体分子间有相互作用力
器 壁
内部分子
靠近器壁的分子
分子间相互作用减弱了分子对器壁的碰撞,形成内压力
p内,所以
p = p理 - p内 因为分子间引力反比于分子间距离 r 的六次方,反比于
Vm2 ,引力越大,a 越大。 p内= a / Vm2 。
p理= p + p内 = p + a / Vm2
R=pVm/T=8.3145 J·mol-1
在压力取向0的极限条件下, 任何气体的行为均服从的定量 关系,R是一个对各种气体都 适用的常数。
R[lp i0m (pV)]T/T=8.3145J·mol-1·K-1 (是一种极限结果
8
2. 理想气体模型
(1) 分子间力
.
§ 1.1 理想气体
吸引力- 分子相距较远时,有范德华引力;
排斥力- 分子相距较近时,电子云及核产生排斥力。
若用E代表分子间相互作用势能,有:
E吸引 -1/r 6 Lennard-Jones理论 E排斥 1/r 12
E 总 E 吸 引 + E 排 斥 r A 6r B 1 2 1 .1 .2
9
.
§ 1.1 理想气体
式中:A-吸引常数;B-排斥常数
26
.
.
§ 1.1 理想气体
例 1.2.1 :今有 300 K,104 . 365 kPa 的湿烃类 混合气体(含水蒸气的烃类混合气体),其中水 蒸气的分压为3.167 kPa,现欲得到除去水蒸气 的 1 kmol 干烃类混合气体,试求:(1)应从湿烃 混合气体中除去水蒸气的物质的量;(2)所需湿 烃类混合气体的初始体积。
25
.
§ 1.2 真实气体
•压力修正: 实际气体分子间有相互作用力
器 壁
内部分子
靠近器壁的分子
分子间相互作用减弱了分子对器壁的碰撞,形成内压力
p内,所以
p = p理 - p内 因为分子间引力反比于分子间距离 r 的六次方,反比于
Vm2 ,引力越大,a 越大。 p内= a / Vm2 。
p理= p + p内 = p + a / Vm2
R=pVm/T=8.3145 J·mol-1
在压力取向0的极限条件下, 任何气体的行为均服从的定量 关系,R是一个对各种气体都 适用的常数。
R[lp i0m (pV)]T/T=8.3145J·mol-1·K-1 (是一种极限结果
8
2. 理想气体模型
(1) 分子间力
.
§ 1.1 理想气体
吸引力- 分子相距较远时,有范德华引力;
排斥力- 分子相距较近时,电子云及核产生排斥力。
若用E代表分子间相互作用势能,有:
E吸引 -1/r 6 Lennard-Jones理论 E排斥 1/r 12
E 总 E 吸 引 + E 排 斥 r A 6r B 1 2 1 .1 .2
9
.
§ 1.1 理想气体
式中:A-吸引常数;B-排斥常数
26
.
物理化学课件(天津大学第五版)--课件:第一章 气体的pVT性质

•真实气体只在温度不太低、压力不太高 的情况下近似符合理想气体状态方程。
上一内容 下一内容 回主目录
返回
2020/7/30
摩尔气体常数R的求导
3) 外推至p=0,可得
R
lim (
p0
pVm )T
/T
(2494.2 /
300)J
mol1
K
用于p, V, T, n, m, M, ρ的计算
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
例:计算25℃,101325Pa时空气的密度。
(空气的分子量为29)
解:
一定是常数么?
n V
p RT
101325
8.315
273.15
25
mol m3
40.87 mol m3
B
返回
2020/7/30
§1.2 理想气体混合物
• 用质量分数表示:
wB
mB mB mA m
A
wB 1
B
量纲为1
上一内容 下一内容 回主目录
返回
2020/7/30
§1.2 理想气体混合物
• 用体积分数表示:
B
xBVm*, B xAVm*, A
nBVm*, B nAVm*, A
A
A
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
理想气体:分子间无相互作用,分子本身无体积
××
×
×
×× ×
×
× ×
×
××
可无限压缩
在任何温度、压 力下均符合理想 气体模型,或服 从理想气体状态 方程的气体为理 想气体
上一内容 下一内容 回主目录
返回
2020/7/30
摩尔气体常数R的求导
3) 外推至p=0,可得
R
lim (
p0
pVm )T
/T
(2494.2 /
300)J
mol1
K
用于p, V, T, n, m, M, ρ的计算
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
例:计算25℃,101325Pa时空气的密度。
(空气的分子量为29)
解:
一定是常数么?
n V
p RT
101325
8.315
273.15
25
mol m3
40.87 mol m3
B
返回
2020/7/30
§1.2 理想气体混合物
• 用质量分数表示:
wB
mB mB mA m
A
wB 1
B
量纲为1
上一内容 下一内容 回主目录
返回
2020/7/30
§1.2 理想气体混合物
• 用体积分数表示:
B
xBVm*, B xAVm*, A
nBVm*, B nAVm*, A
A
A
上一内容 下一内容 回主目录
返回
2020/7/30
§1.1 理想气体的状态方程
理想气体:分子间无相互作用,分子本身无体积
××
×
×
×× ×
×
× ×
×
××
可无限压缩
在任何温度、压 力下均符合理想 气体模型,或服 从理想气体状态 方程的气体为理 想气体
第一章 气体的pVT性质

30.31× 10−3 kg.mol −1 × 0.201 = 6.29 ≈ 6 1× 10−3 kg.mol −1 ∴ C2 H 6
3. 在生产中 用电石 CaC2 CaC2 分析碳酸氢氨产品中水分的含量 = C2H2 g +Ca OH
2
其反应式如下
s + 2H2O l
现称取 2.000g 碳酸氢氨样品与过量的电石完全作用 在 27 50.0cm3 解 试计算碳酸氢氨样品中水分的质量分数为多少
VB = yBV
VB =
nB RT p
压缩因子的定义
Z=
5 范德华方程
pV nRT
或
Z=
pVm RT
a p + 2 (Vm − b ) = RT Vm 二. 本章练习
(一) 选择题
n2a 或 p + 2 (V − nb ) = nRT V
1 对于实际气体,处于下列哪种情况时,其行为与理想气体相近
n=
2 pV p2V p2V = + RT1 RT1 RT2 2 p1T2 = 57900 Pa = 57.9kPa T2 + T1
p2 =
6. 298.15K 时 在一抽空的烧瓶中充入 2.00g 的 A 气体 此时瓶中压力为 1.00 105Pa 今若再充入 3.00g 的 B 气体 解 发现压力上升为 1.50 105Pa 试求两物质 A B 的摩尔量之比
充入气体质量为
0.3897g 时 解
试计算混合气体中乙烷和丁烷的摩尔分数与分压力
M = y1M 1 + y2 M 2 = =
mRT pV
0.3897 g × 8.314 J .K −1.mol −1 × 293.15 K = 46.87 g .mol −1 −4 3 101.325kPa × 2.00 ×10 m M 1 = 30 g / mol M 2 = 58 g / mol
第一章 气体的PVT性质

pV ( nB ) RT
B
混合理气
m pV RT M mix
M mix : 混合物的摩尔质量
M mix yB M B
B
26
三、道尔顿分压定律与分压力 3.1 道尔顿定律 恒温、恒容条件下,理想混合气体的总压力等
于组成它的各组分在同温下单独存在于相同容
器内产生压力之和。 p pB pA pB pC
m pM V RT 3 3 20010 16.0410 3 kg m 8.315 (25 273.15) 1.294 kg m
3
17
状态变化时,计算系统各宏观性质 基本公式: 当n 一定时,
p1V1 p2V2 nR T1 T2
p1V1 p2V2 R n1T1 n2T2
36
3.2 临界参数
p*=f (T)
T ,p* ,气体液化需要加更大的压力 ;
当T=Tc 时,液相消失,加压不再可以使气体液化
临界温度Tc
:能够以加压方法使气体液化的
最高温度;
V = f(p,T)
对于数量可以变动的纯气体系统:
V=f(p,T,n)
13
2.3 理想气体状态方程
pV = nRT
n:物质的量 (mol)
T :热力学温度(K, 开尔文)
T= t + 273.15
p :压力(pa)
V:气体的体积(m3)
R:8.3145 J· mol-1 · K-1,摩尔气体常数
(1)玻义尔定律(R.Boyle,1662): pV = 常数 (n,T 一定)
在物质的量和温度恒定的条件下气体的体积 与压力成反比
9
(2)盖.吕萨克定律(J. Gay Lussac,1808): V / T = 常数 (n, p 一定)
物理化学课件分压定律和分体积定律.
一般情况下,范氏方程只能满足几十标准压力 下气体的PVT性质的描述。
2023/11/10
压缩因子法
由Z的定义式可知, pV=ZnRT
维里方程
pVm=RT(1+B/Vm+C/Vm2+D/Vm3+•••)
气体的液化与液体的饱和蒸汽压
实际气体分子间存在吸引力, 从而能发生一种理 想气体不可能发生的变化——液化.气体的液化一般 需要降温和加压. 降温可减小分子热运动产生的离 散倾向, 加压则可以缩小分子间距从而增大分子间 引力.
值.
00-7-22
20
普遍化压缩因子图
将对比状态参数的表达式引入压缩因子 Z 的定义中, 得
def Z
pVm RT
pCVC prVr RTC Tr
ZC
pr Vr Tr
式中右方第一项为临界点处的压缩因子ZC, 实验 表明多数实际气体的 ZC 在 0.270.29 的范围内(参
阅表1-2), 可看作常数;根据对应状态原理,在Tr和pr 一定时, pr也一定,因而,压缩因子Z近似为一定值,即 处于对比状态的各种气体具有相同的压缩因子,它是
分压力:混合气体中某一组分B的分压力pB是该
组份单独存在并具有与混合气体相同温度和体积
时所具有的压力。
注: 总压是构成该混合物的各组分对压力所做的贡 献之和; 气体混合物中每一种气体叫做组分气体。
yB = 1
p = pB
混合理想气体:
pB (nA nB
B
nC
) RT V
B
nB
Tr和pr的一个双变量函数.
00-7-22
21
VB yBV
y B=1
V 混合气体总体积, yB 组分B的物质的量分数
2023/11/10
压缩因子法
由Z的定义式可知, pV=ZnRT
维里方程
pVm=RT(1+B/Vm+C/Vm2+D/Vm3+•••)
气体的液化与液体的饱和蒸汽压
实际气体分子间存在吸引力, 从而能发生一种理 想气体不可能发生的变化——液化.气体的液化一般 需要降温和加压. 降温可减小分子热运动产生的离 散倾向, 加压则可以缩小分子间距从而增大分子间 引力.
值.
00-7-22
20
普遍化压缩因子图
将对比状态参数的表达式引入压缩因子 Z 的定义中, 得
def Z
pVm RT
pCVC prVr RTC Tr
ZC
pr Vr Tr
式中右方第一项为临界点处的压缩因子ZC, 实验 表明多数实际气体的 ZC 在 0.270.29 的范围内(参
阅表1-2), 可看作常数;根据对应状态原理,在Tr和pr 一定时, pr也一定,因而,压缩因子Z近似为一定值,即 处于对比状态的各种气体具有相同的压缩因子,它是
分压力:混合气体中某一组分B的分压力pB是该
组份单独存在并具有与混合气体相同温度和体积
时所具有的压力。
注: 总压是构成该混合物的各组分对压力所做的贡 献之和; 气体混合物中每一种气体叫做组分气体。
yB = 1
p = pB
混合理想气体:
pB (nA nB
B
nC
) RT V
B
nB
Tr和pr的一个双变量函数.
00-7-22
21
VB yBV
y B=1
V 混合气体总体积, yB 组分B的物质的量分数
第一章_气体的PVT性质
1.2 道尔顿定律和阿马格定律
• 理想气体混合物的总体积等于各个组分以同混 合物相同的温度和压力单独存在时的分体积之 和。
V VO2 VN 2
VO2
即理想气体的分体积等同于恒温恒压混合前的体积 ,但实际气体并不等同。
1.2 道尔顿定律和阿马格定律
例. 空气中氧气的体积分数为0.29,求101.325kPa、25℃时的1m3 空气中氧气的摩尔分数、分压力、分体积,并求若想得到1摩尔 纯氧气,至少需多少体积的空气。(将空气近似看成理想气体)
最后一式可用来计算气体的摩尔质量 M = RT(ρ/ p) p→0
§1.1 理想气体的状态方程 例:计算25℃,101325Pa时空气的密度。 (空气的分子量为29) 解:
n p 101325 3 mol m V RT 8.315 273.15 25 40.87 mol m
3
n 空气= M 40.87 29 g m 3 1.185 kg m 3 V
应用举例
例1.1· 1某空气压缩机每分钟吸入压力为101325Pa、温度为30º C
的空气41.2m3。经压缩后所排出的空气压力为192517Pa、温度
90º C,求每分钟排出的空气体积。 解:压缩机稳定操作时,每分钟吸人的空气的量与每分钟排出的 空气的量是相等的,但p、V、T均已改变,即 吸人量n1 = 排出量n2
jB = xB Vm,B / S xcVm,c
Vm,c : T, p一定时纯 c 组分的摩尔体积
2.分压力的定义与道尔顿定律
生产和科研实践中遇到的气体往往不是单一的气体,而
是由多种气体组成的气体混合物,例如空气就是。
若在一体积为V的容器中,放入n(N2)、n(O2),那
第1章气体的PVT性质
理想气体状态方程
p Pa; V m3; T K; n mol ;
R 摩尔气体常数 8.314J mol-1 K-1 理想气体状态方程也可表示为: pVm=RT pV = (m/M)RT pM= (m/V)RT=RT
理想气体状态方程也可表示为:
pVm= RT pV = (m/M)RT pM= (m/V)RT = RT
阿马加定律表明理想气体混合物的体积具有加和性,在 相同温度、压力下,混合后的总体积等于混合前各组分的体 积之和。 由二定律有:
pB VB nB yB p V n
高压下,混合前后气体体积一般将发生变化,阿马加定律 不再适用。这时需引入偏摩尔体积的概念进行计算。(见第 四章)
第三节 气体的液化和临界参数 一、理想气体 pV = nRT
理想气体混合物中某一组分B的分压 pB 等于该组分单独 存在于混合气体的T、V时产生的压力。
而理想气体混合物的总压等于各组分单独存在于混合气 体的T、V时产生的压力总和 道尔顿定律 对低压下真实气体混合物适用。在高压下,分子间的相互作
用不可忽视,且混合物不同分子间的作用与纯气体相同分子间
的作用有差别,所以某气体B的分压不再等于它单独存在时的 压力,所以分压定律不再适用
pV nRT nB RT B
及
pV = (m / Mmix) RT
式中:m 混合物的总质量; Mmix 混合物的摩尔质量; p,V 为混合物的总压与体积。
又 m = mB = nB MB = n yB MB = nMmix Mmix= m/n = yB MB 即混合物的摩尔质量又等于混合物的总质量除以混 合物的总的物质的量。 混合物的(平均)摩尔质量定义为: 混合物中各物质的摩尔 质量与其摩尔分数的乘积的和:
第一章 气体的PVT关系PPT精品文档56页
2020/1/7
第一章 气体的PVT关系
§1.1 理想气体状态方程 §1.2 理想气体混合物 §1.3 真实气体的液化及临界参数 §1.4 真实气体状态方程 §1.5 对应状态原理及普遍化压缩因子图
§1.2 理想气体混合物
1. 混合物的组成
(1)摩尔分数x或y
xB(或yB) nB nA
A
E吸引 1/r 6 E排斥 1/r n 兰纳德-琼斯(Lennard-Jones)理论:
n = 12 E 总 E 吸 引 + E 排 斥 = - r A 6 r B 1 2
式中:A 吸引常数;B 排斥常数。
图1.1.1 兰纳德-琼斯势能 曲线示意图
2020/1/7
(2) 理想气体模型
pVnRT(nB)RT
B
pV m RT Mmix
Mmix yBMB B
m m B n B M B ny B M B n M m ix
B
B
B
M m ixmn m B nB
B
B
3. 道尔顿定律
分压力
pB yBp
yB 1
p pB
B
B
pV( nB)RT
第一章 气体的PVT关系
物质的聚集状态可以分为三种
流体
气体 液体 固体
V 受 T,p 的影响很大
凝聚态
V 受 T,p的影响较小
在众多宏观性质中,p,V,T三者物理意义非常明确,又易 于直接测量,对于纯物质只要p,V,T中任意两个量确定, 第三个量就随之确定,此时即认为物质处于一定的状态。
联系 p,V,T 之间关系的方程称为状态方程
)R/T p
B
(nB p R)T BV B *
第一章 气体的PVT关系
§1.1 理想气体状态方程 §1.2 理想气体混合物 §1.3 真实气体的液化及临界参数 §1.4 真实气体状态方程 §1.5 对应状态原理及普遍化压缩因子图
§1.2 理想气体混合物
1. 混合物的组成
(1)摩尔分数x或y
xB(或yB) nB nA
A
E吸引 1/r 6 E排斥 1/r n 兰纳德-琼斯(Lennard-Jones)理论:
n = 12 E 总 E 吸 引 + E 排 斥 = - r A 6 r B 1 2
式中:A 吸引常数;B 排斥常数。
图1.1.1 兰纳德-琼斯势能 曲线示意图
2020/1/7
(2) 理想气体模型
pVnRT(nB)RT
B
pV m RT Mmix
Mmix yBMB B
m m B n B M B ny B M B n M m ix
B
B
B
M m ixmn m B nB
B
B
3. 道尔顿定律
分压力
pB yBp
yB 1
p pB
B
B
pV( nB)RT
第一章 气体的PVT关系
物质的聚集状态可以分为三种
流体
气体 液体 固体
V 受 T,p 的影响很大
凝聚态
V 受 T,p的影响较小
在众多宏观性质中,p,V,T三者物理意义非常明确,又易 于直接测量,对于纯物质只要p,V,T中任意两个量确定, 第三个量就随之确定,此时即认为物质处于一定的状态。
联系 p,V,T 之间关系的方程称为状态方程
)R/T p
B
(nB p R)T BV B *
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
压力分数等于该组分B的摩尔分数 此规律只近似应用于低压下的实际混合气体
上一内容 下一内容 回主目录
返回
2018/11/9
4.阿马加定律ቤተ መጻሕፍቲ ባይዱ
1) 分体积 混合气体中,组分B单独存在,并且处于与混 合气体相同的温度和压力时,所产生的体积称组
分B的分体积。
nB RT V p
B
上一内容 下一内容 回主目录
返回
2018/11/9
§1.1 理想气体的状态方程
理想气体:分子间无相互作用,分子本身无体积
× ×
× ×
可无限压缩
在任何温度、压 力下均符合理想
× × × × × × × × ×
上一内容 下一内容
气体模型,或服
从理想气体状态
方程的气体为理
想气体
回主目录
返回
2018/11/9
§1.1 理想气体的状态方程 • 理想气体的状态方程是理想气体的宏 观外在表现
pVm=RT
m pV RT M
Vm=V/n ρ=m/V
或
用于p, V, T, n, m, M, ρ的计算
上一内容 下一内容 回主目录
返回
2018/11/9
§1.1 理想气体的状态方程 例:计算25℃,101325Pa时空气的密度。
(空气的分子量为29)
解: n p 101325 3 mol m V RT 8.315 273.15 25 3 40.87 mol m n 3 3 d空气= M 40.87 29 g m 1.185 kg m V
• 理想气体的微观模型反映了理想气体
的微观内在本质
• 理想气体是真实气体在 p→ 0 情况下
的极限状态。
上一内容 下一内容 回主目录
返回
2018/11/9
§1.1 理想气体的状态方程
• 真实气体并不严格符合理想气体状态方
程,也就是说真实气体在方程 pV=nRT
中的R不为常数。 •真实气体只在温度不太低、压力不太高 的情况下近似符合理想气体状态方程。
B
pB nB RT / V pA nA RT / V
p B nB p A nA
分压定律是理想气体的必然规律
上一内容 下一内容 回主目录
返回
2018/11/9
3. 道尔顿定律
压力分数:混合气体中某组分 B 的分压与总压之
比称该组分B的压力分数。
p B nB RT / V nB yB P nRT / V n
上一内容 下一内容 回主目录
返回
2018/11/9
临界温度时气体液化所需的最小压力称临界压力pc 在p--Vm图上,临界点是Tc恒温 线的拐点,有两特征:
•
p ( )Tc 0 Vm
2 p ( ) 0 2 Tc Vm
pc的确定
上一内容
下一内容
回主目录
返回
2018/11/9
为止,达到平衡。
上一内容 下一内容 回主目录
返回
2018/11/9
相对湿度 (RH)
0 相对湿度 100%
大气中水蒸气的分压 相对湿度 同温下水的饱和蒸汽压
1) 为什么海拔越高水的沸点越低?
2) 为什么春雨贵如油? 3) 为什么夏天更容易下暴雨?
上一内容 下一内容 回主目录
1) 分压力 (分压) 混合气体中,组分B单独存在,并且处于与混 合气体相同的温度和体积时,所产生的压力称组分
B的分压。
pB y B p
返回
上一内容
下一内容
回主目录
2018/11/9
3 道尔顿定律
混合气体的总压力等于各组分单独存在于混合气体 的温度、体积条件下所产生压力的总和。
p pB
上一内容
下一内容
回主目录
返回
2018/11/9
摩尔气体常数R的求导
1) T不变,求不同p下Vm 2) 做该T下pVm~p曲线
3) 外推至p=0,可得
R lim ( pVm )T / T (2494.2 / 300) J mol 1 K 1
p 0
8.314J mol1 K 1
隐形飞机涂层材料
上一内容 下一内容 回主目录
返回
2018/11/9
开心一练
×
1.Tc是使气体能够液化所允许的最低温度 2.Tc是使气体能够液化所允许的最高温度
√
3.pc是临界温度下使气体液化所需要的最高压力 4. pc是临界温度下使气体液化所需要的最低压力 5. pc是使气体液化所需要的最低压力
B
上一内容 下一内容 回主目录
Mmix混合物的摩尔质量
返回
2018/11/9
§1.2 理想气体混合物
m
B
mB
n
B
nM n y M M mix B B B B
B
m M mix n
y
B
B MB
上一内容
下一内容
回主目录
返回
2018/11/9
3. 道尔顿定律
R:摩尔气体常数,数值为8.314
Pa m 3 3 1 1 [ R] Pa m mol K mol K J mol 1 K 1
上一内容 下一内容 回主目录
返回
2018/11/9
§1.1 理想气体的状态方程 理想气体的状态方程的其他表示 也可以写为
返回
2018/11/9
水 t/℃ P*/kPa
20
40 60
2.338
7.736 19.916
80
100 120
上一内容 下一内容 回主目录
47.343
101.325 198.54
返回
2018/11/9
真实气体的p-Vm图及气体的液化
T2 > T1
如果在较宽的温度、 压力范围内对实际气体 的 pVT 性 质 进 行 实 验 , 发现两个重要性质:液 化与临界现象。
上一内容
下一内容
回主目录
返回
2018/11/9
(2) 临界温度还有另一重要意义: 当气体温度在临界温度之上,
则无论加多大的压力都不能液化。
即临界温度 Tc 是气体发生液
•
化现象的极限温度。当气体温度
在临界温度以下,随着气体压力
的增加,气体能液化。当气体温
度在临界温度以上,无论加多大
压力,都不能使气体液化。
2018/11/9
超临界流体
超临界流体萃取优势
对于萃取物的选择能力非常强
可以精确地控制要从物料中萃取哪些组分
温度、压力、流速和时间 无毒、无污染、操作简单、能耗低
上一内容
下一内容
回主目录
返回
2018/11/9
上一内容
下一内容
回主目录
返回
2018/11/9
无 醇 葡 萄 酒
固 体 火 箭 推 进 剂
* VB nB RT / P nB yB V nRT / P n
体积分数等于压力分数
等于该组分B的摩尔分数
上一内容 下一内容 回主目录
返回
2018/11/9
§1.3
气体的液化与临界现象
饱和蒸汽
气—液平衡
nl g ng l
v蒸发 v凝结
上一内容 下一内容
微观
宏观
饱和液体
恒温水平线右端为该温
度下饱和蒸气的摩尔体
积,左端为该温度下饱
T2 T1
和液体的摩尔体积。水
平段中间不同的点对应
着不同的液化量。
上一内容
下一内容
回主目录
返回
2018/11/9
温度升高,恒温线水平段升高,
即对应的压力增大,反映了饱和
C
蒸气压随温度升高而增大的性质。
温度升高至最终使恒温线水平段 缩成一个点 ( 图中 C 点 ) ,此点称 临界点。
回主目录
返回
2018/11/9
§1.3
气体的液化与临界现象
1.饱和蒸气压
在温度为 T,物质气液两相达平衡时的气相压
力为饱和蒸气压 p* 1) 纯物质在指定温度下有确定的饱和蒸气压。 2) 随着温度升高,饱和蒸气压增大。 3) p*=pamb时,此时的温度为沸点
Why?
上一内容
下一内容
回主目录
返回
2018/11/9
当气相压力超过物质所在温度下的饱和蒸气压时,
凝结速度大于蒸发速度,总的宏观效果是气体凝结。
直到气相压力等于所在温度下的饱和蒸气压为止,达
到平衡。
若气相压力小于物质所在温度下的饱和蒸气压 时,凝结速度小于蒸发速度,总的宏观效果是气体
蒸发。直到气相压力等于所在温度下的饱和蒸气压
上一内容 下一内容 回主目录
返回
2018/11/9
§1.2 理想气体混合物 1.混合物组成表示:
• 用物质的量的分数表示: 对于物质B
量纲为1 显然
上一内容
(x表示气体,y表示液体)
xB 或yB
A
nB nB n nA
x
B
下一内容
B
1
y
B
B
1
2018/11/9
回主目录
T2 T1
上一内容
下一内容
回主目录
返回
2018/11/9
T2 > T1
各恒温线上描述的 P--Vm 数据均为平衡数据,在 气 - 液共存时,在指定压
T2 T1
力下只有一个平衡压力 即饱和蒸气压。气 - 液共 存部分为水平线。
上一内容
下一内容
回主目录
返回
上一内容 下一内容 回主目录
返回
2018/11/9
4.阿马加定律ቤተ መጻሕፍቲ ባይዱ
1) 分体积 混合气体中,组分B单独存在,并且处于与混 合气体相同的温度和压力时,所产生的体积称组
分B的分体积。
nB RT V p
B
上一内容 下一内容 回主目录
返回
2018/11/9
§1.1 理想气体的状态方程
理想气体:分子间无相互作用,分子本身无体积
× ×
× ×
可无限压缩
在任何温度、压 力下均符合理想
× × × × × × × × ×
上一内容 下一内容
气体模型,或服
从理想气体状态
方程的气体为理
想气体
回主目录
返回
2018/11/9
§1.1 理想气体的状态方程 • 理想气体的状态方程是理想气体的宏 观外在表现
pVm=RT
m pV RT M
Vm=V/n ρ=m/V
或
用于p, V, T, n, m, M, ρ的计算
上一内容 下一内容 回主目录
返回
2018/11/9
§1.1 理想气体的状态方程 例:计算25℃,101325Pa时空气的密度。
(空气的分子量为29)
解: n p 101325 3 mol m V RT 8.315 273.15 25 3 40.87 mol m n 3 3 d空气= M 40.87 29 g m 1.185 kg m V
• 理想气体的微观模型反映了理想气体
的微观内在本质
• 理想气体是真实气体在 p→ 0 情况下
的极限状态。
上一内容 下一内容 回主目录
返回
2018/11/9
§1.1 理想气体的状态方程
• 真实气体并不严格符合理想气体状态方
程,也就是说真实气体在方程 pV=nRT
中的R不为常数。 •真实气体只在温度不太低、压力不太高 的情况下近似符合理想气体状态方程。
B
pB nB RT / V pA nA RT / V
p B nB p A nA
分压定律是理想气体的必然规律
上一内容 下一内容 回主目录
返回
2018/11/9
3. 道尔顿定律
压力分数:混合气体中某组分 B 的分压与总压之
比称该组分B的压力分数。
p B nB RT / V nB yB P nRT / V n
上一内容 下一内容 回主目录
返回
2018/11/9
临界温度时气体液化所需的最小压力称临界压力pc 在p--Vm图上,临界点是Tc恒温 线的拐点,有两特征:
•
p ( )Tc 0 Vm
2 p ( ) 0 2 Tc Vm
pc的确定
上一内容
下一内容
回主目录
返回
2018/11/9
为止,达到平衡。
上一内容 下一内容 回主目录
返回
2018/11/9
相对湿度 (RH)
0 相对湿度 100%
大气中水蒸气的分压 相对湿度 同温下水的饱和蒸汽压
1) 为什么海拔越高水的沸点越低?
2) 为什么春雨贵如油? 3) 为什么夏天更容易下暴雨?
上一内容 下一内容 回主目录
1) 分压力 (分压) 混合气体中,组分B单独存在,并且处于与混 合气体相同的温度和体积时,所产生的压力称组分
B的分压。
pB y B p
返回
上一内容
下一内容
回主目录
2018/11/9
3 道尔顿定律
混合气体的总压力等于各组分单独存在于混合气体 的温度、体积条件下所产生压力的总和。
p pB
上一内容
下一内容
回主目录
返回
2018/11/9
摩尔气体常数R的求导
1) T不变,求不同p下Vm 2) 做该T下pVm~p曲线
3) 外推至p=0,可得
R lim ( pVm )T / T (2494.2 / 300) J mol 1 K 1
p 0
8.314J mol1 K 1
隐形飞机涂层材料
上一内容 下一内容 回主目录
返回
2018/11/9
开心一练
×
1.Tc是使气体能够液化所允许的最低温度 2.Tc是使气体能够液化所允许的最高温度
√
3.pc是临界温度下使气体液化所需要的最高压力 4. pc是临界温度下使气体液化所需要的最低压力 5. pc是使气体液化所需要的最低压力
B
上一内容 下一内容 回主目录
Mmix混合物的摩尔质量
返回
2018/11/9
§1.2 理想气体混合物
m
B
mB
n
B
nM n y M M mix B B B B
B
m M mix n
y
B
B MB
上一内容
下一内容
回主目录
返回
2018/11/9
3. 道尔顿定律
R:摩尔气体常数,数值为8.314
Pa m 3 3 1 1 [ R] Pa m mol K mol K J mol 1 K 1
上一内容 下一内容 回主目录
返回
2018/11/9
§1.1 理想气体的状态方程 理想气体的状态方程的其他表示 也可以写为
返回
2018/11/9
水 t/℃ P*/kPa
20
40 60
2.338
7.736 19.916
80
100 120
上一内容 下一内容 回主目录
47.343
101.325 198.54
返回
2018/11/9
真实气体的p-Vm图及气体的液化
T2 > T1
如果在较宽的温度、 压力范围内对实际气体 的 pVT 性 质 进 行 实 验 , 发现两个重要性质:液 化与临界现象。
上一内容
下一内容
回主目录
返回
2018/11/9
(2) 临界温度还有另一重要意义: 当气体温度在临界温度之上,
则无论加多大的压力都不能液化。
即临界温度 Tc 是气体发生液
•
化现象的极限温度。当气体温度
在临界温度以下,随着气体压力
的增加,气体能液化。当气体温
度在临界温度以上,无论加多大
压力,都不能使气体液化。
2018/11/9
超临界流体
超临界流体萃取优势
对于萃取物的选择能力非常强
可以精确地控制要从物料中萃取哪些组分
温度、压力、流速和时间 无毒、无污染、操作简单、能耗低
上一内容
下一内容
回主目录
返回
2018/11/9
上一内容
下一内容
回主目录
返回
2018/11/9
无 醇 葡 萄 酒
固 体 火 箭 推 进 剂
* VB nB RT / P nB yB V nRT / P n
体积分数等于压力分数
等于该组分B的摩尔分数
上一内容 下一内容 回主目录
返回
2018/11/9
§1.3
气体的液化与临界现象
饱和蒸汽
气—液平衡
nl g ng l
v蒸发 v凝结
上一内容 下一内容
微观
宏观
饱和液体
恒温水平线右端为该温
度下饱和蒸气的摩尔体
积,左端为该温度下饱
T2 T1
和液体的摩尔体积。水
平段中间不同的点对应
着不同的液化量。
上一内容
下一内容
回主目录
返回
2018/11/9
温度升高,恒温线水平段升高,
即对应的压力增大,反映了饱和
C
蒸气压随温度升高而增大的性质。
温度升高至最终使恒温线水平段 缩成一个点 ( 图中 C 点 ) ,此点称 临界点。
回主目录
返回
2018/11/9
§1.3
气体的液化与临界现象
1.饱和蒸气压
在温度为 T,物质气液两相达平衡时的气相压
力为饱和蒸气压 p* 1) 纯物质在指定温度下有确定的饱和蒸气压。 2) 随着温度升高,饱和蒸气压增大。 3) p*=pamb时,此时的温度为沸点
Why?
上一内容
下一内容
回主目录
返回
2018/11/9
当气相压力超过物质所在温度下的饱和蒸气压时,
凝结速度大于蒸发速度,总的宏观效果是气体凝结。
直到气相压力等于所在温度下的饱和蒸气压为止,达
到平衡。
若气相压力小于物质所在温度下的饱和蒸气压 时,凝结速度小于蒸发速度,总的宏观效果是气体
蒸发。直到气相压力等于所在温度下的饱和蒸气压
上一内容 下一内容 回主目录
返回
2018/11/9
§1.2 理想气体混合物 1.混合物组成表示:
• 用物质的量的分数表示: 对于物质B
量纲为1 显然
上一内容
(x表示气体,y表示液体)
xB 或yB
A
nB nB n nA
x
B
下一内容
B
1
y
B
B
1
2018/11/9
回主目录
T2 T1
上一内容
下一内容
回主目录
返回
2018/11/9
T2 > T1
各恒温线上描述的 P--Vm 数据均为平衡数据,在 气 - 液共存时,在指定压
T2 T1
力下只有一个平衡压力 即饱和蒸气压。气 - 液共 存部分为水平线。
上一内容
下一内容
回主目录
返回
