促肾上腺皮质激素(ACTH)测定试剂盒(电化学发光免疫分析法)产品技术要求北京联众泰克
标本存储方式对促肾上腺皮质激素检测结果的影响论文

2.ACTH质控血清在不同保存条件下的检测结果:
以22℃、30 rain内测定结果为对照,ACTH配套质控品室温
存放4
h、4℃48 h、一20℃48
h测定结果无显著变化(偏
倚≤8.3%),而室温存放8、24 h测定结果明显偏低(偏倚≥ 8.3%)。第三方质控品室温和4℃存放不同时间点ACTH 测定结果具有明显差异,质控品一20℃保存测定结果无明 显变化(偏倚≤8.3%)。结果见表2。 三、讨论 目前,ACTH主要采用电化学发光法测定¨J,具有较高 的敏感度和特异度。由于ACTH的释放呈现昼夜节律性变 化∞1,且具有自身分泌的特点¨J,室温放置易受蛋白酶的影 响而降解,极不稳定,而ACTH的检测结果又受标本容器、标 本类型和标本保存方式等因素的影响,对检测的要求极高。 为保证检测的准确性,实验室应按照试剂生产厂商对标本检 测的要求进行检测。在分析过程的质量控制中,标本的采集 和储存是分析前的重要影响因素。另外,也有标本存放时间 对血常规、血糖浓度等检测结果影响的报道¨…,但对ACTH 的影响未见报道。
24 h、一20℃24 h、4℃
脑、垂体和肾上腺(HPA轴)三者处于相对的动态平衡,HPA
轴是体内最重要的自稳系统,在应激状态下HPA轴活跃,促 使机体产生应激反应‘1引。临床上检测ACTH是诊断库欣 病、垂体前叶功能减退等疾病的重要指标∞…,因此患者检验 结果的准确与否直接影响着临床医生对疾病的诊断和治疗。 按照ACTH检测的实验要求和相关资料报道¨J,要求采血后 立即将乙二胺四乙酸二钾(EDTA—K:)采样管存放于冰水中, 低温离心,分离血浆标本于22℃2 h内完成检测。可见标 本采集后的保存时间和温度对ACTH检测至关重要,在实际 工作中由于工作流程等因素可能会延误标本的送检,不能达 到实验规定的要求,本研究旨在了解临床上标本存放时间和 温度对ACTH测定的影响。 一、材料与方法 1.标本采集:选取来我院就诊患者20例,其中男12例, 女8例,年龄17~58岁。所有受试者均禁食10~12 h后采 集清晨空腹静脉EI)TA-K:血浆,在1 h内上机测定,然后分 别测定室温(22.0±0.5)℃放置2、3、4、8、24 h,4℃放置4、
促肾上腺皮质激素(ACTH)标准操作规程

促肾上腺皮质激素(ACTH)标准操作规程一、目的:规范促肾上腺皮质激素测定的标准操作程序,确保促肾上腺皮质激素测定的结果准确有效。
二、适用范围:在AutoLumo A2000化学发光检测仪上定量测定人血清中的促肾上腺皮质激素。
三、临床意义ACTH是脊椎动物脑垂体分泌的一种多肽类激素,含39个氨基酸,分子量为4500。
它能促进肾上腺皮质的组织增生以及皮质激素的生成和分泌。
它的生成和分泌受下丘脑促肾上腺皮质激素释放因子(CRF)的直接调控。
分泌过盛的皮质激素反过来也能影响垂体和下丘脑,减弱它们的活动[1]。
ACTH的分泌呈现日节律波动,入睡后ACTH分泌逐渐减少,午夜最低,随后又逐渐增多,至觉醒起床前进入分泌高峰,白天维持在较低水平,入睡时再减少。
由于ACTH分泌的日节律波动,糖皮质激素的分泌也出现相应的波动[4]。
ACTH 增高可见于原发性肾上腺皮质功能减退症、异位ACTH综合征、库欣病、Nelson综合征、先天性肾上腺皮质增生症、遗传性肾上腺皮质对ACTH不反应综合征、周期性ACTH、ADH分泌增多综合征、其他(如手术、创伤、休克、低血搪、使用SU4885等均可使ACTH分泌增多)[3]。
ACTH 降低可见于垂体前叶功能减退症、肾上腺皮质腺瘤或癌、单纯性ACTH缺乏综合征、医源性ACTH减少等[2]。
四、方法原理本试剂盒采用夹心法原理进行检测。
用ACTH抗体包被磁微粒,辣根过氧化物酶标记ACTH抗体制备酶结合物。
通过免疫反应形成抗体-抗原-酶标抗体复合物,该复合物催化发光底物发出光子,发光强度与ACTH的含量成正比。
五、标本的采集与处理5.1.应用正确医用技术采集患者上午7:00~10:00 EDTA血浆样本用于测定。
5.2.样本中的沉淀物和悬浮物可能会影响试验结果,应离心除去。
5.3.严重溶血、脂血或浑浊的样本不能用于测定。
5.4.样本收集后如果不能在1小时内检测,需将样本放置在2~8℃的冰箱中;若需24小时以上保存或运输,则应冻存于-20℃以下,避免反复冻融。
牛促肾上腺皮质激素(ACTH)说明书
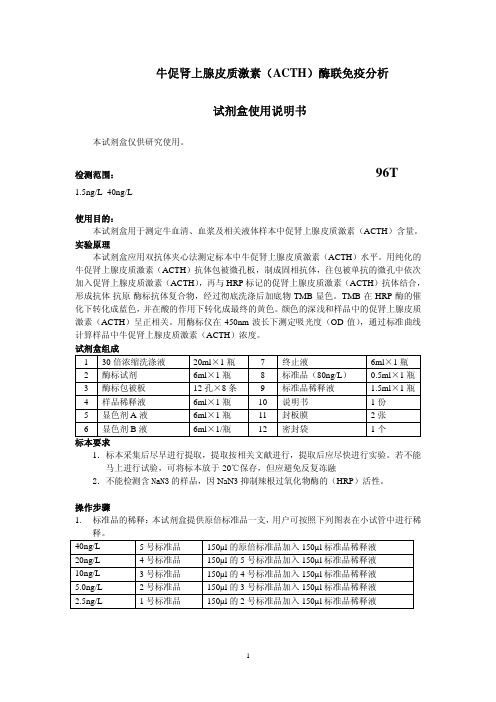
10ng/L
3 号标准品
150µl 的 4 号标准品加入 150µl 标准品稀释液
5.0ng/L
2 号标准品
150µl 的 3 号标准品加入 150µl 标准品稀释液
2.5ng/L
1 号标准品
150µl 的 2 号标准品加入 150µl 标准品稀释液
1
2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、 待测样品孔。在酶标包被板上标准品准确加样 50µl,待测样品孔中先加样品稀释液 40µl, 然后再加待测样品 10µl(样品最终稀释度为 5 倍)。加样将样品加于酶标板孔底部,尽 量不触及孔壁,轻轻晃动混匀。
3. 温育:用封板膜封板后置 37℃温育 30 分钟。 4. 配液:将 30 倍浓缩洗涤液用蒸馏水 30 倍稀释后备用。 5. 洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置 30 秒后弃去,如此
重复 5 次,拍干。 6. 加酶:每孔加入酶标试剂 50µl,空白孔除外。 7. 温育:操作同 3。 8. 洗涤:操作同 5。 9. 显色:每孔先加入显色剂 A50µl,再加入显色剂 B50µl,轻轻震荡混匀,37℃避光显色
大于标准品孔第一孔的 OD 值),请先用样品稀释液稀释一定倍数(n 倍)后再测定,计 算时请最后乘以总稀释倍数(×n×5)。 5. 封板膜只限一次性使用,以避免交叉污染。 6.底物请避光保存。 7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准. 8.所有样品,洗涤液和各种废弃物都应按传染物处理。 9.本试剂不同批号组分不得混用。 10. 如与英文说明书有异,以英文说明书为准。 保存条件及有效期 1.试剂盒保存:;2-8℃。 2.有效期:6 个月
用完,板条应装入密封袋中保存。 2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。 3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。一次加样时间最好
促肾上腺皮质激素(ACTH)测定试剂盒(磁微粒化学发光法)产品技术要求利德曼生化

促肾上腺皮质激素(ACTH)测定试剂盒(磁微粒化学发光法)2.1外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3液体组分应无沉淀或絮状物;2.1.4包装标签应清晰,易识别。
2.2准确度回收率应在85.0%-115.0%范围内。
2.3空白限应不大于1.00 pg/mL。
2.4线性在[1.50,2000.00]pg/mL的测量范围内,试剂盒的相关系数r应≥0.9900。
2.5重复性用(50.00±10.00)pg/mL和(500.00±100.00)pg/mL的样本各重复检测10次,变异系数(CV)应不大于10.00%。
2.6批间差用三个不同批号的试剂盒分别检测(50.00±10.00)pg/mL和(500.00±100.00)pg/mL的样本,其批间变异系数应≤15%。
2.7质控品的赋值有效性质控品的测量值应在质控范围内。
2.8 校准品和质控品的批内瓶间差2.8.1 校准品的批内瓶间差校准品B~校准品F的批内瓶间差CV≤10.0%。
2.8.2 质控品的批内瓶间差质控品的批内瓶间差CV≤10.0%。
2.9 稳定性2.9.1 效期稳定性试剂盒2℃~8℃保存有效期为12个月,在有效期满后检测试剂盒的准确度、空白限、线性、重复性、质控品的赋值有效性,应符合2.2、2.3、2.4、2.5、2.7的要求。
2.9.2 复溶稳定性2.9.2.1 校准品和质控品开瓶复溶后,室温保存,可稳定4小时,试剂盒用新开瓶复溶的校准品和质控品定标、质控,检测室温放置5小时后的校准品和质控品,校准品B~校准品F和质控品的相对偏差应在±10%范围内。
用复溶后室温放置5小时的校准品给试剂盒定标后检测试剂准确度和线性,结果应符合2.2、2.4要求。
用复溶后室温放置5小时的质控品对试剂盒进行质控后检测试剂批内精密度和质控品的赋值有效性,结果应符合2.5、2.7要求。
促肾上腺皮质激素质控品产品技术要求mairui

2性能指标
2.1外观和性状
2.1.1颜色性状
质控品复融前外观应呈现粉末块状固体,不起泡,不塌陷,复融后应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2包装
分装瓶应为棕色玻璃瓶,应盖有塑料外盖;盒贴、瓶贴、标签标识、说明书、参考值表应完整、清晰牢固。
塑料瓶盖与玻璃瓶身配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2测量准确度
2.2.1质控参考值表
质控品应可提供一份参考值表,包含适用型号的迈瑞化学发光免疫分析系统
的检测项目参考值及参考范围。
2.2.2赋值准确性
经校准的迈瑞全自动化学发光免疫分析仪检测质控品所包含的检测项目,结果应在参考范围内(不同批次的质控品参考范围参见参考值表)。
2.3均一性
2.3.1瓶内均一性
质控品瓶内均一性应满足变异系数CV≤8.0%。
2.3.2瓶间均一性
质控品瓶间均一性应满足变异系数CV≤5.0%。
2.4生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对质控品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体
(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
1。
促肾上腺皮质激素ACTH

警告及注意事项: 1. 不能使用过期产品。 2. 如果可能传播疾病,所有的样品都应管理好,按照规定的程序处理样品和检测装置。
操作步骤: 试剂盒应平衡至室温(20-25°C )再试验。 取出所需反应板。 1. 加入 100ul 标准品(Standards)、血浆于相应反应板孔中。
试剂盒组成: 酶标板(Coated Wells) 浓缩洗涤液(10X)(Washing Concente) 显色液 终止液(Stop Solution) 质控品
96wells ACTH Antibody- Biotin
5.5ml
100ml 标准品(Standards)
1 set
11ml 酶联物稀释液
2. 每孔加入 50ul ACTH Antibody Biotin。 3. 封住板孔,摇动状态下(500-700rpm)室温孵育 180 分钟。 4. 洗板:甩尽板内液体,用洗涤液洗涤反应板(每孔内加入 350ul 洗涤液),并去除水滴
(在厚叠吸水纸上拍干);反复洗涤 5 次。 5. 每孔加入 100ul 酶联物,封住板孔,摇动状态下(500-700rpm)室温孵育 30 分钟。 6. 洗板:涤液),并去除水滴
11ml
11ml 酶联物(Streptavidin-Enzyme Conjugate) 51x
2vial
保存: 贮藏于 2-8°C。
样品: 在此检测中,可使用血浆(应抗凝)样品。
准备工作: 1. 浓缩洗涤液(10X)用双蒸水稀释成 1X。 2. 按实际需要量将浓缩酶联物用酶联物稀释液作 1:51 稀释,即 40ul 浓缩酶联物加入 2ml
(在厚叠吸水纸上拍干);反复洗涤 5 次。 7. 每孔加入 100ul 显色液,封住板孔,摇动状态下(500-700rpm)室温温育 12±3 分钟。 8. 每孔加入 100ul 终止液(Stop Solution)。轻轻混匀 30 秒;30 分钟内在 450nm 处读 OD
2024年国家卫生健康委临床检验中心室间质量评价标准
靶值±11%
α-羟丁酸脱氢酶
靶值±30%
胆碱酯酹
靶值±20%
脂肪酶
靶值±20%
肌酸激醯-MB(U/L).
靶值±25%
糖化血清蛋白
靶值±20%
NCCL-C-03心肌标志物
肌酸激醯-MB(IIg/L)
靶值±30%
肌酸激酶-MB(U/L)
靶值士25%
肌红蛋白
靶值±30%
肌钙蛋白-1
靶值±30%
网织红细胞百分比(%)
手工法:靶值±1(W4%时)或靶值±2(>4%时)
仪器法:靶值±30%
NCCL-H-Il全血细胞计数正确度验证
白细胞(WBC)
靶值±5%
红细胞(RBC)
靶值±2.5%
血红蛋白(Hb)
靶值±2.5%
血小板(PLT)
靶值±10%
红细胞比容(HCT)
靶值±5%
平均红细胞体积(MeV)
钾
靶值±3.0%
钙
靶值±2.5%
镁
靶值±7.5%
氯
靶值±2.0%
NCCL-C-20血清视黄醇结合蛋白
视黄醇结合蛋白
靶值±25%
NCCL-C-21尿液蛋白标志物I
尿免疫球蛋白G(UlGG)
靶值±30%
尿转铁蛋白(UTRF)
靶值±30%
5微球蛋白(5-MG)
靶值±30%
β2微球蛋白(%-MG)
靶值±30%
靶值士30%
NCCL-C-41细胞因子(原白细胞介素6)白细Leabharlann 介素6(IL-6)靶值±30%
NCCL-C-42精神类治疗药物监测
奥氮平
靶值士30%
促肾上腺皮质激素(ACTH)测定试剂盒(化学发光免疫分析法)产品技术要求mairui
2性能指标
2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于1 pg/mL。
2.5线性
试剂盒在1 pg/mL~2000 pg/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 6%。
2.7批间差
变异系数CV 应≤ 10%。
北京联众泰克皮质醇(Cortisol)测定试剂盒(电化学发光免疫分析法)产品技术要求
皮质醇(Cortisol)测定试剂盒(电化学发光免疫分析法)结构组成:试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(Cortisol-Cal)(选配)组成。
组成及含量见下表:预期用途:本试剂盒用于体外定量测定人体血清样本中皮质醇(Cortisol)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.5nmol/L。
2.3 准确度将已知浓度的Cortisol标准溶液加入到血清中,其回收率应在(85%~115%)范围内。
2.4 线性在[2.0,1750.0]nmol/L范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 重复性在试剂盒的线性范围内,检测高、低两个水平的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差在试剂盒的线性范围内,用3个批号试剂盒分别检测高、低两个水平的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求提供皮质醇(Cortisol)定标品的来源、赋值过程以及测量不确定度等内容,定标品溯源至企业工作校准品。
ACTH(1-24) human (人促肾上腺皮质激素, 1-24)说明书
ACTH(1-24) human (人促肾上腺皮质激素, 1-24)保存条件:-20ºC 或更低温度保存,至少一年有效。
由于多肽的每次冻融均会引起部分失活,所以首次配制成相应浓度的储存液后(请根据产品简介中Reconstitution 一栏的信息配制储存液),须分装后-20ºC 或更低温度冻存,以避免反复冻融。
注意事项:本产品为冻干粉,由于微量的多肽在冻干过程中沉积在管内,形成很薄或不可见的多肽层,所以在打开管盖前,我们建议在离心机中约8,000-12,000g 离心10-30秒,使附着在管盖或管壁上的多肽聚集于管底。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:1. 收到产品后请立即按照说明书推荐的条件保存。
除非特别注明,碧云天相关产品均为冻干粉,由于微量的多肽在冻干过程中沉积在管内,形成很薄或不可见的多肽层,所以在打开管盖前,我们建议在离心机中约8,000-12,000g 离心10-30秒,使附着在管盖或管壁上的多肽聚集于管底。
Beyotime Biotechnology 400-1683301800-8283301 e-mail *********************************** 2.请根据实验目的并按照产品简介中Reconstitution一栏中的信息配制储存液。
大多数多肽冻干粉是非常容易溶解的,一般用移液枪的枪头轻吹几下或者轻轻摇晃瓶子,即可使多肽完全溶解。
请勿用vortex剧烈振荡,以免多肽变性而失活。
3.具体的最佳工作浓度请自行参考相关文献,或者根据实验目的,以及特定细胞和动物,通过实验进行摸索和优化。
Version 2022.12.30 2 / 2 P9019ACTH(1-24) human (人促肾上腺皮质激素, 1-24) 400-1683301/800-8283301 碧云天/Beyotime。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
促肾上腺皮质激素(ACTH)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中促肾上腺皮质激素(ACTH)的含量。
1.1包装规格:50人份/盒、100人份/盒。
1.2主要组成成分
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(ACTH-Cal)(选配)组成。
组成及含量见下表:
注:1、定标品靶值批特异,详见靶值单。
2、试剂盒条码卡内含主校准曲线。
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于1.0pg/mL。
2.3 准确度
将已知浓度的ACTH标准溶液加入到血清中,其回收率应在(85%~115%)范围内。
2.4 线性
在[3.00,2000.0]pg/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 重复性
在试剂盒的线性范围内,测定高、低两个水平的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差
在试剂盒的线性范围内,用3个批号试剂盒分别测定高、低两个水平的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性
依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求提供促肾上腺皮质激素(ACTH)定标品的来源、赋值过程以及测量不确定度等内容,定标品溯源至企业工作校准品。
