GSH含量的测定SOP
HPLC-FL检测GSH-确定实验方法
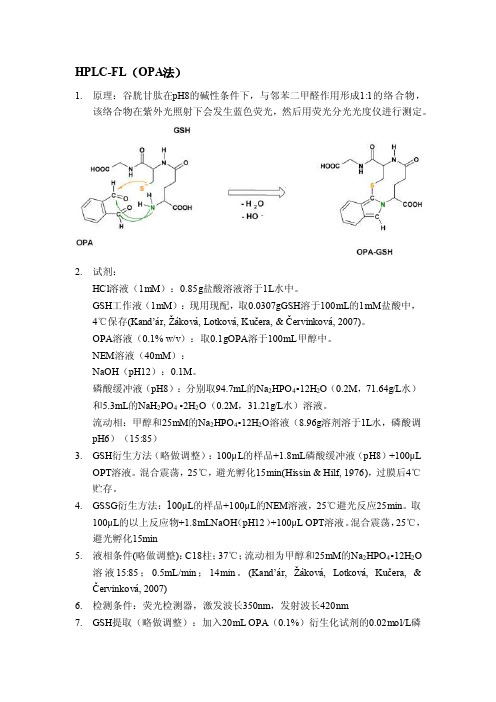
HPLC-FL(OPA法)1.原理:谷胱甘肽在pH8的碱性条件下,与邻苯二甲醛作用形成1:1的络合物,该络合物在紫外光照射下会发生蓝色荧光,然后用荧光分光光度仪进行测定。
2.试剂:HCl溶液(1mM):0.85g盐酸溶液溶于1L水中。
GSH工作液(1mM):现用现配,取0.0307gGSH溶于100mL的1mM盐酸中,4℃保存(Kand’ár, Žáková, Lotková, Kučera, & Červinková, 2007)。
OPA溶液(0.1% w/v):取0.1gOPA溶于100mL甲醇中。
NEM溶液(40mM):NaOH(pH12):0.1M。
磷酸缓冲液(pH8):分别取94.7mL的Na2HPO4▪12H2O(0.2M,71.64g/L水)和5.3mL的NaH2PO4▪2H2O(0.2M,31.21g/L水)溶液。
流动相:甲醇和25mM的Na2HPO4▪12H2O溶液(8.96g溶剂溶于1L水,磷酸调pH6)(15:85)3.GSH衍生方法(略做调整):100μL的样品+1.8mL磷酸缓冲液(pH8)+100μLOPT溶液。
混合震荡,25℃,避光孵化15min(Hissin & Hilf, 1976),过膜后4℃贮存。
4.GSSG衍生方法:100μL的样品+100μL的NEM溶液,25℃避光反应25min。
取100μL的以上反应物+1.8mLNaOH(pH12)+100μL OPT溶液。
混合震荡,25℃,避光孵化15min5.液相条件(略做调整):C18柱;37℃;流动相为甲醇和25mM的Na2HPO4▪12H2O溶液15:85;0.5mL/min;14min。
(Kand’ár, Žáková, Lotková, Kučera, & Červinková, 2007)6.检测条件:荧光检测器,激发波长350nm,发射波长420nm7.GSH提取(略做调整):加入20mL OPA(0.1%)衍生化试剂的0.02mol/L磷酸盐缓冲溶液,超声波清洗仪振荡40min,抽滤,取上清液。
人还原型谷胱甘肽 (GSH)酶联免疫分析 试剂盒使用说明书.

人还原型谷胱甘肽 (GSH)酶联免疫分析试剂盒使用说明书产品编号:E1825h℃不应超过2个月;标本溶血会影响最后检测结果,因此溶血标本不宜进行此项检测;高血脂的标本不需进行特殊处理,可直接检测。
操作步骤实验开始前,请提前配制好所有试剂;试剂或样品稀释时,均需混匀,混匀时尽量避免起泡。
每次检测都应该做标准曲线。
如样品浓度过高时,均应用样品稀释液进行稀释,以使样品符合试剂盒的检测范围。
建议各实验室在操作前先进行预实验以建立最佳稀释倍数。
1.加样:分别设空白孔、标准孔、待测样品孔。
空白孔加样品稀释液100ul,余孔分别加标准品或待测样品100ul,注意不要有气泡,加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀,酶标板加上盖或覆膜,37℃反应120分钟。
为保证实验结果有效性,每次实验请使用新的标准品溶液。
2.弃去液体,甩干,不用洗涤。
每孔加检测溶液A工作液100ul(在使用前一小时内配制),37℃,60分钟。
3.温育60分钟后,弃去孔内液体,甩干,洗板3次,每次浸泡1-2分钟,350ul/每孔,甩干(也可轻拍将孔内液体拍干)。
4.每孔加检测溶液B工作液(同检测A工作液)100ul,37℃,60分钟。
5.温育60分钟后,弃去孔内液体,甩干,洗板5次,每次浸泡1-2分钟,350ul/每孔,甩干(也可轻拍将孔内液体拍干)。
6.依序每孔加底物溶液90ul,37℃避光显色(30分钟内,此时肉眼可见标准品的前3-4孔有明显的梯度兰色,后3-4孔梯度不明显,即可终止)。
7.依序每孔加终止溶液50ul,终止反应,此时蓝色立转黄色。
终止液的加入顺序应尽量与底物液的加入顺序相同。
为了保证实验结果的准确性,底物反应时间到后应尽快加入终止液。
8.用酶联仪在450nm波长依序测量各孔的光密度(OD值)。
在加终止液后立即进行检测。
注:1.每次实验留一孔作为空白调零孔(不同于空白孔),该孔不加任何试剂,只是最后加底物溶液及2N H2SO4。
人谷胱甘肽(GSH)ELISA试剂盒说明书
人谷胱甘肽(GSH)酶联免疫分析试剂盒使用说明书厦门慧嘉生物科技有限公司本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中谷胱甘肽(GSH)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人谷胱甘肽(GSH)水平。
用纯化的人谷胱甘肽(GSH)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中加入谷胱甘肽(GSH),再与HRP标记的谷胱甘肽(GSH)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的谷胱甘肽(GSH)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人谷胱甘肽(GSH)的含量。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
谷胱甘肽过氧化物酶(GSH-Px)试剂盒说明书

谷胱甘肽过氧化物酶(GSH-Px)试剂盒说明书微量法100T/96S注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:GSH-Px是谷胱甘肽氧化还原循环中催化还原型谷胱甘肽(GSH)氧化的主要酶之一。
GSH-Px不仅能够特异地催化还原型谷胱甘肽与ROS反应,生成氧化型谷胱甘肽GSSG,从而保护生物膜免受ROS的损害,维持细胞的正常功能;而且具有保护肝脏、提高机体免疫力、拮抗有害金属离子对机体的伤害和增加机体抗辐射等能力。
测定原理:GSH-Px催化有机过氧化物氧化GSH,产生GSSG;谷胱甘肽还原酶(GR)催化NADPH还原GSSG,再生GSH,同时NADPH氧化生成NADP+;NADPH在340 nm有特征吸收峰,而NADP+没有;通过测定340 nm光吸收减少速率来计算GSH-Px活性。
自备仪器和用品:低温离心机、水浴锅、可调节移液器、酶标仪、96孔板、和蒸馏水。
试剂组成和配置:试剂一:液体120mL×1瓶,室温保存。
试剂二:粉剂×1瓶,4℃保存。
试剂三:液体10μL×1支,-20℃保存。
试剂四:液体200μL×1瓶,4℃保存。
粗酶液提取:1. 组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
8000g,4℃离心10min,取上清置冰上待测。
2. 细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心10min,取上清置于冰上待测。
3. 血清等液体:直接测定。
GSH-Px测定操作:1. 酶标仪预热30 min,调节波长到340 nm。
2. 混合试剂在25℃或者37℃(哺乳动物)水浴中预热30min。
3. 混合试剂配制:临用前,在试剂二中加入试剂一20 mL,充分震荡溶解后加入全部试剂三,混匀。
谷胱甘肽(GSH)含量测定

谷胱甘肽(GSH)含量测定一、实验目的1.了解植物组中中抗坏血酸-谷胱甘肽循环代谢过程;2.学习还原型谷胱甘肽含量的测定原理和方法。
二、实验原理谷胱甘肽是有谷氨酸(Glu)、半胱氨酸(Cys)、甘氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。
它作为体内重要的抗氧化剂和自由基清除剂,如与自由基、重金属等结合,从而把机体内有害的毒物转化为无害的物质,排泄出体外。
谷胱甘肽能和2-硝基苯甲酸(DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG),2-硝基-5-巯基苯甲酸为一黄色产物,在波长412nm 处具有最大光吸收。
因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
三、实验材料小麦幼嫩叶片四、实验方法及步骤1.制作标准曲线取7只干净的试管编号,按如下表格加入各试剂,反应20分钟后在412nm 下用分光光度计测其吸光度,制作标准曲线;2.样品测定a、称取小麦叶片0.2g,加入少量5%偏磷酸缓冲液研磨提取,并用5%偏磷酸缓冲液定容至6ml,8000rpm离心10min,取上清液;b、取上述上清液2ml显色,操作同标准曲线。
3.结果计算:GSH含量(ug/Gfw)= (Cx*Vt)/(Fw*Vs)注:Cx---2ml样品中GSH含量(ug),即每管中GSH的含量Vt---样品提取液总体积(ml);Vs----显色时所取样的体积(ml);FW---样品鲜重(g)。
五、实验结果1.标准曲线1.样品测定结果六、注意事项1.使用移液管吸取试剂时,视线要垂直于移液管且与液面凹面水平,不能斜视,以免量取试剂不准确。
2.在提取样品时,最好沉淀出去蛋白质,以防止蛋白质中所含巯基及相关酶对测定结果的影响。
3.在研磨叶片时,为方便研磨,刚开始时加入少量的提取液。
谷胱甘肽(GSH)含量测定

谷胱甘肽(GSH)含量测定一、实验目的1.了解植物组中中抗坏血酸-谷胱甘肽循环代谢过程;2.学习还原型谷胱甘肽含量的测定原理和方法。
二、实验原理谷胱甘肽是有谷氨酸(Glu)、半胱氨酸(Cys)、甘氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。
它作为体内重要的抗氧化剂和自由基清除剂,如与自由基、重金属等结合,从而把机体内有害的毒物转化为无害的物质,排泄出体外。
谷胱甘肽能和2-硝基苯甲酸(DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG),2-硝基-5-巯基苯甲酸为一黄色产物,在波长412nm 处具有最大光吸收。
因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
三、实验材料小麦幼嫩叶片四、实验方法及步骤1.制作标准曲线取7只干净的试管编号,按如下表格加入各试剂,反应20分钟后在412nm 下用分光光度计测其吸光度,制作标准曲线;2.样品测定a、称取小麦叶片0.2g,加入少量5%偏磷酸缓冲液研磨提取,并用5%偏磷酸缓冲液定容至6ml,8000rpm离心10min,取上清液;b、取上述上清液2ml显色,操作同标准曲线。
3.结果计算:GSH含量(ug/Gfw)= (Cx*Vt)/(Fw*Vs)注:Cx---2ml样品中GSH含量(ug),即每管中GSH的含量Vt---样品提取液总体积(ml);Vs----显色时所取样的体积(ml);FW---样品鲜重(g)。
五、实验结果1.标准曲线1.样品测定结果六、注意事项1.使用移液管吸取试剂时,视线要垂直于移液管且与液面凹面水平,不能斜视,以免量取试剂不准确。
2.在提取样品时,最好沉淀出去蛋白质,以防止蛋白质中所含巯基及相关酶对测定结果的影响。
3.在研磨叶片时,为方便研磨,刚开始时加入少量的提取液。
还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定
还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定关键词:还原型谷胱甘肽GSH氧化型谷胱甘肽GSSG测定2009-04-24 00:00 来源:互联网点击次数:6147GSH和GSSG 参照Anderson等(1992)。
取0.5 g样品,加入3 mL冰冷的6%的偏磷酸(含1 mmol•L-1 EDTA ,pH 2.8),冰浴研磨,匀浆液以20,000 g,4 ℃离心15 min,取上清液来马上测定GSH和GSSG的含量或储存在-20 ℃下等待测定。
总的GSH和GSSG含量测定如下:200 μL提取液加 1.2 mL反应液包含400 μL反应液1(110 mmol•L-1 Na2HPO4•7H20,40 mmol•L-1NaH2PO4•H2O,15 mmol•L-1EDTA,0.3 mmol•L-15,5‘-dithiobis-(2-nitrobenzoic acid)DTNB,0.04% BSA)、320 μL反应液2 (1 mmol•L-1 EDTA,50 mmol•L-1 imidazole 咪唑solution and 0.02% BSA)、400 μL反应液3(5% Na2HPO4,pH 7.5的溶液稀释50倍)、80 μL 9.0 mmol•L-1 NADPH。
测定OD412下的吸收值。
GSSG 含量测定如下:200 μL提取液加入1 mL的2-2乙烯嘧啶(稀释50倍)在25°C下水浴1 h再测定OD412下的吸收值。
GSH的含量可以从总的GSH和GSSG含量中减去GSSG含量获得。
GSH测定方法:取样品0.5 g,加入预冷的5%磺基水杨酸2.5 ml和少许石英砂,充分冰预研磨,转入离心管中,于4℃下20,000×g离心20min,将上清液分装,液氮冷冻后于-20℃保存或直接进行抗氧化剂分析。
取50 μL上清液,用5% 磺基水杨酸定容至100 μL (即加入5% 磺基水杨酸50 μL),加入24 μL 1.84 mol•L-1三乙醇胺triethlene diamine以中和样液,加入50 μL 10% 乙烯吡啶Polyvinyl pyridine (用70% 乙醇配制),25℃水浴1 h,以除去GSH,到时加入706 mL 50 mmol•L-1磷酸缓冲液,pH 7.5,内含2.5 mmol•L-1 EDTA,加入20 μL 10 mmol•L-1 NADPH 和80 μL 12.5 mmol•L-1 DTNB(二硫硝基苯甲酸),混匀,25℃保温10 min,到时加入20μL 50 U•mL-1 GR,总体积为1 mL,立即混匀,读出3 min时的OD值。
GssgGsh测定
谷胱甘肽含量测定测定原理:还原型GSH:DTNB能被-SH基团还原,产生等克分子2-硝基-5-巯基苯甲酸。
硝基巯基苯甲酸阴离子呈黄色,在可见光412nm波长处有吸收峰,可用于测定巯基总谷胱甘肽:类上,只不过多了一个辅酶Ⅱ还原体系利用2GSH的氧化还原DTNB生成2TNB+2H+,氧化后的GSH(GSSG)又被NADPH还原;在反应中,NADPH量逐渐减少,TNB量逐渐增加,TNB在412nm光吸收增加速率(△A412/min)与总GSH量呈正比。
由于GSH和GSSG循环交替,周而复始,总量不变,故称循环法。
仪器:分光光度计试剂:1)5%磺基水杨酸2)磷酸盐缓冲液:0.1mol/l 磷酸钾缓冲液PH8.0 含1mmol/l EDTA(分子量372)3)1mmol/l DTNB(分子量396.35)用1%柠檬酸钠溶液配制:0.396354)1%柠檬酸钠溶液5)NADPH(分子量833.4)1mmol/l6) GR酶液(现配现用):酶标品20ul (NH4)2SO4(3.6M)930ul7)1mmol/L的GSH(分子量307.33)注:分子量:EDTA(372),DTNB(396.35) KH2PO4(136.09) K2HPO43H2O(228.22)样品的处理:取样品,加入5%磺基水杨酸1ml,冰浴迅速研磨匀浆;6000rpm8分钟左右取上清标准曲线的绘制:(由于测GSH和总GSSG共用了同一个反应,可以绘制一条标准曲线)GSH(um) 0 20 40 60 80 1001.0mmol/L GSH(ml)0 0.05 0.1 0.15 0.2 0.25双蒸水0.5 0.45 0.4 0.35 0.3 0.250.1mol/L PBS 4.0 4.0 4.0 4.0 4.0 4.0DTNB试剂0.5 0.5 0.5 0.5 0.5 0.5混匀,5min内412nm比色,以双蒸水调零。
以标准GSH溶液为X轴,相应的吸光度为Y 轴,绘制标准曲线,并求得回归方程样品液GSH测定:试剂测定管空白管待测样品液0.1 0.10.1mol/L PBS 4.4 4.4DNTB 0.5 ------双蒸水——0.5混匀,5分钟内,412nm处读取光密度样品液总谷胱甘肽测定反应体系:0.1ml 样+0.1mlDTNB+0.1mlNADPH+0.05mlGR+0.65mlPBS测△A412=(A412)2—(A412)1对于谷胱甘肽还原酶的用量影响最终测定结果,故每批测定必须同时做标准曲线。
(完整版)GSH-Px活力的测定SOP
主要目的:——测定物质谷胱甘肽过氧化物酶(GSH —Px )活力。
主要原理:--谷胱甘肽过氧化物酶(GSH —Px)可以促使过氧化氢(H 2O 2)与还原性谷胱甘肽(GSH )反应生成H 2O 及氧化性谷胱甘肽(GSSG ),谷胱甘肽过氧化物酶的活力可用其酶促反应的速度来表示,测定此酶促反应中还原型谷胱甘肽的消耗,则可求出酶的活力.H 2O 22O+GSSG GSH —Px 的活力以催化GSH 的反应速度来表示,由于这两个底物在没有酶的条件下,也能进行氧化还原反应(称为非酶促反应),所以最后计算此酶活力时必须扣除非酶促反应引起的GSH 减少的部分。
而GSH 含量的测定可以跟据GSH 和二硫代二硝基苯甲酸作用生成5—硫代二硝基苯甲酸阴离子呈现较稳定的黄色,在412nm 处测其吸光度即可计算出实验室签章一、试剂-—谷胱甘肽过氧化物酶(GSH—Px)测定试剂盒(南京建成生物研究所)二、仪器设备——96孔酶标板—-UV—Vis可见多功能酶标仪-—旋涡混匀器——离心机-—水浴锅-—移液枪及其相应量程枪头三、实验方法根据试剂盒说明书具体操作步骤如下:1. 非酶管和酶管各加入 1 mmol/LGSH 0。
2 mL,酶管加入稀释后的待测血清和组织匀浆液0.2 mL ,37 ºC 水浴预温5分钟,酶管和非酶管分别加入试剂一应用液0。
1 mL ,37 ºC 水浴准确反应5分钟,酶管和非酶管分别加入试剂二应用液2 mL ,同时非酶管加入待测细胞上清液0.2 mL 。
混匀,3500-4000转/分,离心10分钟,取上清1 mL 作显色反应。
2。
空白管加入1 mL GSH 标准品溶剂应用液,标准管加入1 mL 20 μmol/LGSH 标准液,非酶管和酶管各加入上一步骤1 mL 上清液,然后空白管、标准管、非酶管和酶管各加入1 mL 试剂三应用液,0。
25 mL 试剂四应用液和0。
05 mL 试剂五应用液。
GSH含量测定
GSH含量测定一、原理还原性谷胱甘肽(GSH)是植物细胞重要的抗氧化剂之一,是一个良好的表示氧化胁迫的指标。
GSH+TDBN在pH=7时生成黄色物质,其颜色深浅与GSH的浓度成线性关系。
即:在巯基化合物的存在下,无色的DTNB将被转变成黄色的5-巯基-2-硝基苯甲酸。
由于5-巯基-2-硝基苯甲酸在412 nm处具有最大吸收,DTNB的吸收光谱并不干扰巯基的测定。
二、材料、试剂、仪器1、材料:小麦叶片2、试剂(1)GSH标准溶液:称取10mg 分析纯GSH,溶于蒸馏水中,并定容于10ml,即为1mg/ml 之标准母液,用稀释10倍(0.1mg/ml GSH);(2)5%偏磷酸;(3)0.2mol/L 磷酸钾缓冲液,pH7.0;(4)TDNB试剂:称取39.6mg二硫代双-二硝基苯甲酸(TDNB),用0.2mol/L磷酸钾缓冲液溶解并定容于100ml;(5)1mol/L NaOH溶液。
2、仪器(1)可见分光光度计:4台;(2)离心机:1台(10000转/分);(3)1/千天平-2台;(4)离心管:3支×16(10ml)(5)刻度试管:4×16支;(10或15ml)(6)普通试管(刻度试管):7支×4(15*150 标准曲线)(7)刻度吸管:0.5ml-8支; 1ml-8支; 2ml-16支; 5ml-8支;(8)研钵:1×16个;(9)比色杯4套;(10)吸水纸适量;(11)剪刀8把;(12)玻棒8支;三、方法步骤:1、制作标准曲线:取7支刻度试管,编号,按表加入试剂:将上述溶液混合均匀,在室温下显色5min。
在412nm波长下测定吸光度。
以标准溶液中GSH浓度为X,吸光度为y,制作标准回归方程,(并求出GSH含量。
)2 、样品测定:称取植物鲜样0.204g加入少量5%偏磷酸研磨提取,并用5%偏磷酸定容到10ml。
10000rpm 离心10min。
离心后取上清液2 ml,同标准曲线操作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
主要目的:
——测定物质还原性谷胱甘肽(GSH)的含量。
主要原理:
参照GSH检测分析试剂盒说明书,5,5’–二硫代–双–(2–硝基苯甲酸)能和谷胱甘肽(GSH)反应产生2–硝基–5–巯基苯甲酸和谷胱甘肽二硫化物(GSSG),由于2–硝基–5–巯基苯甲酸是一黄色产物,通过测定其在412 nm处的最大吸收可确定样品中谷胱甘肽的含量用纯化的谷胱甘肽(GSH)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中加入谷胱甘肽(GSH),再与HRP标记的谷胱甘肽(GSH)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的谷胱甘肽(GSH)呈正相关。
用酶标仪在412 nm波长下测定吸光度(OD值),通过标准曲线计算样品中谷胱甘肽(GSH)的含量。
实验室签章
一、试剂
——谷还原性胱甘肽(GSH)测定试剂盒(南京建成生物研究所)
二、仪器设备
——96孔酶标板
——UV-Vis可见多功能酶标仪
——旋涡混匀器
——离心机
——移液枪及其相应量程枪头
三、实验方法
根据试剂盒说明书具体操作步骤如下:
1.上清液的制备:取稀释后的血清或组织匀浆液0.5 mL,加试剂一应用液
2 mL 混匀,4000 rpm离心10分钟,取上清液1 mL进行显色反应。
2.显色反应:空白管中加入1 mL试剂一,标准管加入20μmol/LGSH标准液
1 mL,测定管加入上步骤得到的上清液1 mL,然后各管中分别加入1.25 mL试剂
二、0.25ml试剂三、0.05 mL试剂四。
3.混匀,室温静置5分钟后,在412 nm处将酶标板空板进行扫描,准确吸取0.2 mL各管反应液加入到新的96孔板中,酶标仪测定各孔吸光度(OD值)。
4.血清中GSH含量计算公式
GSH含量(mg/L)
-
-
OD OD
=
测定OD值空白OD值
标准值空白值
×标准品浓度(20×10-3mmol/L)×GSH
分子量(307)×样本测试前稀释倍数组织中GSH含量公式
GSH含量(mg/gprot)
-
-
OD OD
=
测定OD值空白OD值
标准值空白值
×标准品浓度(20×10-3mmol/L)
×GSH分子量(307)×样本测试前稀释倍数÷待测组织匀浆液蛋白浓度(gprot/L)
参考文献
Lapshina E A, Sudnikovich E J, Maksimchik J Z, et al. Antioxidative enzyme and glutathione S-transferase activities in diabetic rats exposed to long-term ASA treatment [J]. Life sciences, 2006, 79(19): 1804-1811.。
