大鼠灌注取脑
脑原位缺血预处理通过Nrf2HO-1信号通路减轻大鼠缺血再灌注损伤

脑梗死性痴呆大鼠海马CUAT、AChE活性的影响〔J〕.亚太传统医药6019;—(1):9A2.1Yu J,Lin C,Zhang X, et al.Acupuucture improved cognitive impair) men-caused by multi-infarct demeotiv in/ts〔J〕.Physiol Bedav, 200520(4):43461.1罗本华,王燕J长亚飞,等.三种针法对PCPA失眠大鼠海马7 HTh-HIdA含量影响观察〔J〕.中国中医基础医学杂志2017;22(1—:13176.1Kanedo D,Nakamura N,Ogawa T.Ceredral infa/dou in rats using Uomoloaoxs blood emboli:develoumeo-of a new experimental model [J].2troUe,1785;17(—:70-34.1陈俊抛,田时雨,于薇薇,等•多发性脑梗塞痴呆动物模型的研究〔〕•中华神经精神科杂志4994;27(5):511-A1刘存志•“益气调血,扶本培元”针法改善多性痴呆(MID)大鼠认知功能和氧化损伤的研究〔D〕.天津:天津中医学院6004.17Modi K.PaPoWgical and patUopUysWmaicai studies on central ue/-oxs system in experimental ceredral ishemia of the/g J〕•HoPkaido Igabn Zasshi,1992;67(—:109-20.1彭康,郑文权,臧坤堂,等.乌龙丹对多发性脑梗塞痴呆大鼠学习记忆功能的影响及其机理〔J〕中医杂志J999;46(12):740-3.1张崇泉,孙兆泉J长炜宁.健脑通络胶囊对血管性痴呆大鼠大脑神经递质的影响〔〕•中国医药学报6<025(1):55-5.20Lopes-Aguiar C,Romcy-Pe/Wa RN,Escouim SR,et al.Musca/nic acetyWho/ne neoro/ansmission exUances the lam-phase of long-temi potentiatiou in the hippocampa-i prefrontal codex pathway of rats in vive:a possible iuvolvemeo-of monoaminergic systems〔J〕.Neuro-wieocc,2008;—5(4):—69A0.01Muradami Y,Zhao Q,Harada K,et al.CUotc-sau,a kampo founula, improves chronic ceredral UypoperfusWu indxceO spatial Warning deficit via stimulatiou of musca/nic Ml receptor^J..Pharmacol Bio) chem Bedav,20052〕(5-:917-F5.22程红亮,蔡荣林,殷红彪,等•电针井穴对血管性痴呆大鼠行为学及海马CA1区CREB表达的影响〔J〕.中医药临床杂志, 2010;28(8)7105-8.〔20196960修回〕(编辑王一涵)脑原位缺血预处理通过NUU/HOA信号通路减轻大鼠缺血再灌注损伤王欢欢王刚仲婷婷孙健贺宏梅寇文辉宋爱霞邹玉安薛茜(河北北方学院附属第一医院神经内科,河北张家口077700)〔摘要〕目的研究脑原位缺血预处理(CISC)对大鼠脑缺血再灌注损伤后核因子E2相关因子(NU)2/血红素加氧酶(HO)T信号通路的影响。
线栓法大鼠大脑中动脉阻断实验(MCAO模型)的经验

线栓法大鼠大脑中动脉阻断实验(MCAO模型)的经验本人现在正在做线栓法大鼠大脑中动脉阻断实验(MCAO模型),这方面的资料我查了一些,这个实验我也作了一段时间,不敢说很专业了,不过现在基本上我能在15min左右完成手术,而且手术过程中不出一滴血,造模后缺血程度基本一致。
虽然前面有很多前辈发了很多MCAO的很专业的贴子,不过我觉得比较凌乱,现在我把我的心得体会和以前的贴子的精华部分奉献给大家,希望这会对将要做这个实验的朋友有一丝的帮助。
虽然做实验总会有郁闷的时候,不过风雨之后总会见到彩虹的,这可以也是我的心得体会。
衷心祝福大家能把实验做的成功、完美!实验前准备麻醉剂:水合氯醛(应较好的控制大鼠体温)保温:60W白炙灯高度为37cm直接照射能使肛温保持在 37℃栓线的制备:1.取熔点为56℃的固体石蜡一块,在瓷杯中加热熔化。
直径为0.24mm、长5cm的鱼线一端5mm长的一段,垂直在熔化的石蜡中迅速浸入并提起,立即凝固的一薄层石蜡可牢固地粘附在鱼线一端的表面,其直径为0.26mm。
就这样,普通的鱼线即可变成规相一致头端光滑圆钝的栓线。
2.在鱼线18mm的位置用涂改液标记一个白色点。
TTC的配制:用0.2mol/L磷酸缓冲液(PBS)配成2%TTC溶液(pH7.5),避光保存体重与栓线直径:线栓直径0.24mm采用的SD大鼠,体重250-300g。
实验方法:动物用10%水合氯醛(35mg/kg)腹腔注射麻醉。
仰卧位固定,颈正中线切口,沿胸锁乳突肌内缘分离肌肉和筋膜,分离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),在CCA远心端和近心端与ECA处挂线备用。
用微动脉夹暂时夹闭ICA,然后近心端结扎CCA、ECA。
然后在距CCA分叉部4mm处剪一小口,将拴线插入到ICA,这时用绕在CCA远心端的细线轻轻系牢拴线。
(不可过紧,否则进线困难,但松了又会出血。
)用眼科镊轻推拴线,从血管分叉处开始算距离,当插入深度在18 mm时(一定要将血管放松至原来状态, 且保证标记点在分叉处,由于标记的是白色的所以很容易看的),紧紧系牢CCA远心端的细线,此时的关键是动作轻柔,不要使ICA有任何的牵拉,否则栓线会脱出ACA,可能会造成缺血失败。
TNHH对大鼠全脑缺血再灌注损伤的抗氧化性保护作用

・技术交流・T NHH 对大鼠全脑缺血再灌注损伤的抗氧化性保护作用于晓彦,魏欣冰,陈 琳,张岫美(山东大学医学院药理学研究所,山东济南250012) 摘 要:目的观察T NHH 对大鼠全脑缺血再灌注损伤的抗氧化性保护作用。
方法以改良的四血管阻塞法(Pulsinelli four 2vessel occlusion m odel )建立大鼠全脑缺血模型,于缺血30min ,再灌注48h 后进行脑组织超氧化物歧化酶(S OD )、丙二醛(M DA )、髓过氧化物酶(MPO )测定。
结果T NHH 能显著降低大鼠缺血损伤脑组织中M DA 含量,降低MPO 活性,提高S OD 活性。
结论T NHH 对大鼠全脑缺血再灌注损伤的具有明显的抗氧化作用。
关键词:脑缺血再灌注损伤;T NHH ;抗氧化 中图分类号:R965 文献标识码:A 文章编号:100521678(2009)0120036203Antioxidant effects of TNHH on whole brain ischemia/reperfusion injury in ratsY U X iao 2yan ,WEI X in 2bing ,CHE N Lin ,ZH ANG X iu 2mei(Department o f Pharmacology ,School o f Medicine ,Shandong Univer sity ,Jinan 250012,China ) Abstract :Purpose T o investigate the antioxidant effects of T NHH on global cerebral ischemia reperfusion injury in rats.Methods M odified Pulsinelli four 2vessel occlusion m odel in rat was prepared to produce the cerebral ischemia reperfusion injury.A fter ischemia for 30min and reperfusion for 48h ,superoxide dismutase(S OD )activity ,malondialdehyde (M DA )level ,and myeloperoxidase (MPO )activity in brain tissue were mea 2sured.R esults T NHH produced significant reductions in M DA content ,MPO activity and elevation in S OD activity.Conclusion T NHH possesses the antioxidant effects in whole brain ischemia reperfusion injury in rats.K ey w ords :brain ischemical reperfusion injury ;T NHH ;antioxidation收稿日期:2008205205作者简介:于晓彦(19832),女,山东菏泽人,硕士研究生,研究方向为脑血管药理学;张岫美,男,通信作者,教授,博士生导师,T el :0531288383146,E 2mail :zhangxm @ 。
罗布麻提取物对大鼠脑缺血再灌注后细胞凋亡的影响

t e d ro g u p ( 2 5 mg・ k g ~・ d 。 。 ) , h i g h d o s e A V E t r e a t e d ro g u p ( 5 0 m g・ k g 一・ d 。 。 ) ,a n d g i n k g o l e a f c a p s u l e s t r e a t e d ro g u p .T h e a n i m l a s o f
r e p e r f u s i o n i n r a t s . Me t h o d s 5 0 Wi s t a r ma le r a t s w e r e r a n d o ml y d i v i d e d i n t o s h a m o p e r a t i o n g r o u p, u n t r e a t e d g r o u p , me d i u m d o s e AVE t r e a ・
t o i n d u c e t h e m i d d l e c e r e b r a l a r t e r y o c c l u s i o n ( M C A O ) m o d e l i n r a t s w i t h t h e m e t h o d o f i n t r a l u mi n a l t h r e a d .T h e m i d d l e c e r e b r a l a t r e y r b l o o d
大鼠线栓(MCAO)模型+灌注取脑+TTC染色
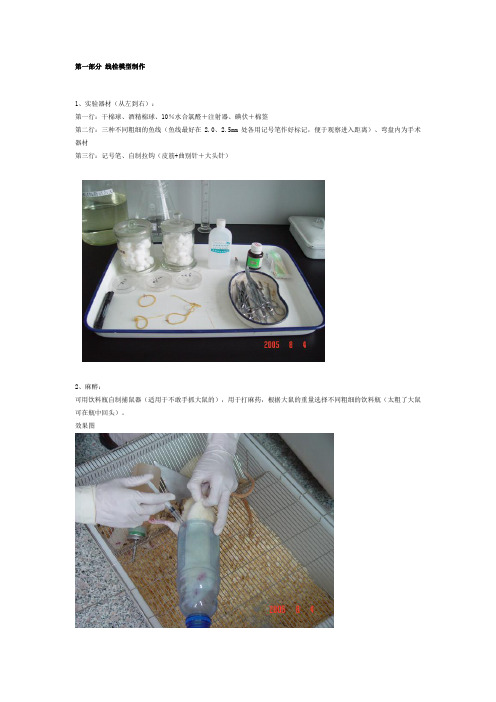
第一部分 线栓模型制作1、实验器材(从左到右):第一行:干棉球、酒精棉球、10%水合氯醛+注射器、碘伏+棉签第二行:三种不同粗细的鱼线(鱼线最好在2.0、2.5mm处各用记号笔作好标记,便于观察进入距离)、弯盘内为手术器材第三行:记号笔、自制拉钩(皮筋+曲别针+大头针)2、麻醉:可用饮料瓶自制捕鼠器(适用于不敢手抓大鼠的),用于打麻药,根据大鼠的重量选择不同粗细的饮料瓶(太粗了大鼠可在瓶中回头)。
效果图3、麻倒后绑在手术台上。
4、剪去颈前的鼠毛,碘伏消毒。
5、沿经部正中切开皮肤。
说明:切开皮肤前最好将结扎动脉的线事先剪好(后面会用到)。
6、钝性分离皮下组织。
如图:大鼠腹侧可见事先剪好的结扎线。
7、分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。
8、分离动脉鞘。
如图:分离好后见光滑的颈总动脉。
9、分离出颈总、颈外、颈内动脉,结扎颈总、颈外动脉,注意中间那根线不要系紧,用来插鱼线时防止出血的。
10、夹闭颈内动脉,用眼科剪将颈总动脉剪一小口。
11、插入鱼线,鱼线进入颈内动脉后按图中注释方法插(成功率在90%以上)。
说明:(1)这一步鱼线选择是关键,根据大鼠重量(作的多了后根据动脉粗细就可选择了)选鱼线。
我们的经验是:250g以下的选0.26mm的线,250-300g的选0.26mm蘸腊的或0.28的都可以。
(2)如果遇到鱼线怎么也查不进去的情况,可让大鼠休息一会,换细点的鱼线再试,这种情况不一定都是进到翼腭动脉了,我曾解剖过4例这种情况的大鼠,有三例都是在如颅的地方卡住了,可惜我们手里没有0.24mm的鱼线。
(3)通过实践,我们认为结扎或夹闭翼腭动脉没有必要,按我们的方法,熟练的话,从切开到缝合完毕也就是15分钟,算上准备工作(如麻醉、消毒等)半小时也可以搞定了,这样一上午两人作10只大鼠不成问题。
(4)我们体会最好用蘸腊的鱼线作模型,好处是进线深度控制的好,不容易出现蛛网膜下腔出血。
大鼠灌注固定取脑

优点:可用单人用注射器直接完成,不用输液管架,而且平均每只仅需5~10ml固定液,时间也仅为5~10min。
注意事项:1)开胸时不要伤到心脏 2)心脏穿刺最好用留置针,软,不宜穿通室间隔,见血即退针芯.插针部位是心尖部,方向向中线.3)生理盐水冲血管,到右心耳流出无色液体.4)多基甲醛固定成功的表现是SD鼠四肢抽搐.5)先断头再一步一步取脑6)根据你实验设计,需要切片的部位,有重点的取,常见的体表标志是前囟和外耳道.7)去颅骨后脑表面有一层硬脑膜,要去掉.
5 灌流:缓慢灌注PBS 10ml,见到老鼠两前肢及两肺变白可改灌注多聚甲醛,多聚甲醛的灌流也同PBS。
6 灌注成功的标志:刚开始灌注时老鼠剧烈抽动;成功后老鼠后肢绷直,尾部竖起成一直线;所灌注的脑组织白而硬。
7 取脑:分离除去后颈部肌肉 ,用弯镊小心取出脑组织。
8 后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h,过夜最好。
3.制作灌注装置,用两瓶塑料包装的生理盐水,一瓶底部开口,倒出盐水,倒置灌入多聚甲醛,悬挂,输液器链接,远端结一个三通后到一个输液器粗针头端
2. 经心脏行灌注固定:麻醉,剪开胸廓,见到搏动的心脏,心尖插入灌注针头,止血钳固定,剪开右心耳,开放静脉血,首先快速滴入生理盐水100-200ml,再注入4%多聚甲醛300-350ml固定液
大鼠灌注固定取脑科研实验
具体方法:
1. 配好4%多聚甲醛PBS缓冲液,配法:称取40g PFA溶于装有500ml DEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。用1.0mol/L的NaOH直至7.0,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
舒芬太尼后处理对大鼠局灶性脑缺血再灌注损伤的保护作用

舒芬太尼后处理对大鼠局灶性脑缺血再灌注损伤的保护作用程岑;顾尔伟;鲁显福;刘训芹;张雷;陈菁菁【期刊名称】《安徽医科大学学报》【年(卷),期】2014(49)7【摘要】Objective To investigate whether sufentanil postconditioning induces protection aganist focal cerebral ischemia-reperfusion injury in rats. Methods Seventy healthy adult male SD rats weighing 250~300 g were ran-domly divided into five groups. All rats in IR group,SP1 group,SP2 group and SP3 group were subjected to the right middle cerebral artery occlusion( MCAO) for 90 min and 24 h reperfusion. At 5 min beforereper fusion, the rats were intravenously injected sufentanil 0. 3 μg/kg(SP1 group),1 μg/kg (SP2 group), 3 μg/kg (SP3 group) or normal saline ( sham group and IR group ) . The neurological deficit scores ( NDS ) were evaluated at 24 h after reperfusion,then all the animals were executed. Six rats in each group were executed to evaluate the infarct volume of the brain. The remaining rats in each group were executed to detect the apoptosis index. Infarct volume,as a percentage of volume at normal cerebral hemisphere,was determined by 2,3,5-triph-enyltetrazolium ( TTC) stai-ning. The neuronal apoptosis was detected by terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay( TUNEL) . Results At 24 h after reperfusion,the neurological deficit scores and the apoptosis index in the SP2 group and SP3 group weresignificantly lower than those in the IR group(P<0. 05),the infarct volume in the SP2 group and SP3 group was significantly smaller than that in the IR group(P<0. 05). There were no sig-nificant differences in the neurological deficit scores,apoptosis index and infarct volume between groups of SP1 and IR. Conclusion Sufentanil postconditioning at a dosage of 1 μg/kg can provide neuroprotection against focal is-chemia-reperfusion injury in rats.%目的:观察舒芬太尼后处理对大鼠大脑中动脉栓塞( MCAO)所致局灶性脑缺血再灌注损伤( CIRI )的保护作用。
线栓法大鼠脑缺血再灌注模型的制备

线栓法制备大鼠脑缺血再灌注模型的方法研究马贤德1孙宏伟1 柴纪严1 赵金茹1(1 辽宁中医药大学,辽宁沈阳 110032;)摘要①目的建立一种比较系统,操作简单,成功率高的大鼠大脑中动脉缺血(MCAO)再灌注动物模型,达到只要读者根据本文所述的方法操作就能制作出MCAO再灌注模型的目的。
②方法成年健康雄性 SD大鼠40只,参照Longa法并适当改进建立MCAO模型20只,假手术组20只。
本文将详细叙述手术过程以及再灌注时间点的合理选择。
最后利用行为学测试、四氮唑(TTC)染色对模型成功与否进行判定。
③结论线栓法是一种操作简单的制备MCAO 再灌注动物模型的方法,并且此方法的再灌注效果较为明显。
关键词动物模型;脑缺血;再灌注;线栓法Establishment a model of rat ischemia-reperfusion injury with intraluminal sutureMa Xian-de1 Sun Hong-wei1 Chai Ji-yan1 Zhao Jin-ru1(1.Liaoning University of Chinese Traditional Medicine, Shenyang, 110032) Abstract: Objective To establish a model of rat ischemia-reperfusion injury, in terms of the model, the operation will be simple, and the achievement ratio will be high. Methods: 40 Male Sprague-Dawley ( SD ) rats were separated into two groups randomly: 20 were model of rat ischemia-reperfusion injury based on Longa method, and the other 20 were sham-operated group. The process of the operation and the selection of different time point following ischemic-reperfusion were discussed in the paper. What’s more , the model was appraised by behavioral test and Triphenyl Tetrazolium Choloride(TTC)Staining. Conclusion: The operation of intraluminal suture method is very simple for the establishment of model of rat ischemia-reperfusion, what’s more, the effect of reperfusion is very obvious.Key words: Animal Model, ischemia, reperfusion, intraluminal suture脑缺血再灌注动物模型是研究缺血性脑血管病的一条重要途径,因为脑缺血再灌注动物模型具有很好的重复性并能最大程度模拟人类缺血性卒中的发生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大鼠灌注取脑
用途:
1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:
心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:
1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):
流程:
1)麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取
脑7)保存或切片.
具体过程:
大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:
1.多聚甲醛的配置:
一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L 的NaOH值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。
2.制作灌注装置,用两瓶塑料包装的输液瓶装灌注液。
同时配好输液器备用。
3.10%水合氯醛按4mL/100g的剂量腹腔注射麻醉动物。
4.沿两侧肋弓剪开皮肤,打开腹腔,用一血管钳夹持剑突并向上提拉,用弯剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧顺延,剪断膈肌及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定,充分暴露心脏,直视下穿刺针左心室心尖处,用血管钳固定。
5.快速滴注生理盐水(室温),同时剪开右心耳。
约注入100~150mL,至流出液体血色较浅基本澄清,停止灌注。
肝脏、眼珠、爪子迅速变白是排出血液的有效观察指标。
6.继续用4%多聚甲醛灌流250ml固定。
7.后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h,过夜最好。
补充:
还有一种省时省剂的方法。
夹闭腹主动脉:只灌注上肢及头脑,固定的好又快,又省试剂。
先灌注生理盐水约100ml,见到老鼠两前肢及两肺变白可改灌注多聚甲醛。
多聚甲醛用100ml以下即可。
灌注成功的标志:刚开始灌注时老鼠前肢剧烈抽动(下肢不抽动证明腹主动脉夹闭完全);前肢及颈部僵硬;所灌注的脑组织白而硬。
注意事项:
1.多聚甲醛气味刺激,配置时做好自我保护。
2.暴露心脏这一步骤,容易损伤肺、心脏或者肝脏,“夹持剑突并向上提拉,用弯剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸”,人工气胸后,肺萎缩,胸腔里的空间增大,提拉剑突后,不容易损伤肺、心及肝脏,出血少。
3.经心脏灌注,有时穿刺针会误进右心室,那样灌注主要在肺循环起作用,体循环的血液影响不大。
所以观察将穿刺针插入到主动脉内可以确保起到体循环灌注冲洗血液的效果,脑组织的血液冲干净后,才不会影响免疫组化的效果,不然到处都是红细胞造成的背景染色。
4.灌注时注意排空输液管中的气泡不然容易气栓,影响灌注效果。
一定要看到大鼠较剧烈抽搐,不然证明灌注不好。
5.关于生理盐水的温度的选择,有人认为因为是快速冲刷血管里的血液,低温造成血管收缩,灌注的效果反而没有室温的好。
但是用低温的认为,低温有利于组织完整。
6.灌注成功的标志:刚开始灌注时老鼠剧烈抽动;成功后老鼠后肢绷直,尾部竖起成一直线;
所灌注的脑组织白而硬。
7.去颅骨后脑表面有一层硬脑膜,要去掉。
常见问题:
1.灌注取脑不可用于Western blot及PCR的原因。
答:多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
Western中,要用去污剂使各种蛋白发生变性、解聚,并变成统一的线性肽链,从而能够用凝胶电泳进行分子量的梯度分离。
多聚甲醛会影响蛋白的解聚,从而使其无法用凝胶分离。
另外,WB和免疫组化所使用抗体的抗原表位也不同,WB的抗体一般识别蛋白的一级结构,所以可能也无法识别甲醛处理的蛋白。
PCR要提RNA,RNA非常容易降解,必须新鲜取组织,然后尽快超低温冷藏或者马上抽提,否则非常容易降解。
灌注固定的组织,原则上是能够提得出DNA和RNA的,但是肯定会有较多的降解,一般不会这样做。
2. 没有灌注固定的大鼠脑组织,能不能做切片和免疫组化?
答:如果没有灌注固定,而是直接取材然后放入固定液中,可以进行免疫组化染色,只是效果不如灌注固定的好,尤其是要做电镜时更明显。
有的标记蛋白要求较高,固定不好就难以染好。
3. 用4%多聚甲醛固定但保存了2周才做石蜡切片,不知对免疫组化有无影响?
答:固定时间过长蛋白多肽链都交连在一起了,抗原性就很弱了,很可能没有阳性结果,抗原修复时一般的修复很难把抗原性恢复. 可能会有影响,但不会太大。
固定时间长,抗原修复时间也要长一些。
4.灌注多长时间?灌注液多少?
看了很多经验,每个人的灌注液用量都不一样,灌注速度也能没有很清楚的说法,灌注时间也不确定。
我的总结为,还是看灌注成功的标志。
现将看到的比较详细的处理方法列出。
灌注速度,大家比较公认的是先快后慢。
短期灌注:采用心脏穿刺快速灌注20 min,其中生理盐水灌注50~100mL,4 %多聚甲醛缓冲液灌注150 mL。
长期灌注:灌注时间延长到1 h,其中生理盐水灌注200mL,4 %多聚甲醛缓冲液灌注400 mL。
短期灌注组脑组织结构保留基本良好,与长期灌注组相比稍差,研究皮层和海马结构损伤基本可以满足;长期灌注组结构保留最好,但是耗时长、固定液用量大,致使试验进度慢等缺点不容忽视。
,对皮层和海马缺血再灌注损伤研究选择短期灌注取脑尚可满足需要,深部脑白质及核团缺血再灌注损伤研究还是要用长期灌注固定取脑法,或者在取脑后立即根据实验取材要求将脑切成块再浸泡入固定液充分固定。
下面是夹闭腹主动脉:
每只大鼠先快速推注生理盐水50 ml冲洗,继而灌注固定液(如4%多聚甲醛等)50~80 ml,先快后慢,需10~15 min,在灌注固定液过程中,颈部逐渐变硬;灌注结束后,开颅取出脑组织,置于固定液中后固定24 h。
5. 体循环与肺循环的鉴别?
体循环时大鼠肝脏变白现象出现较早,在灌注多聚甲醛后,四肢会出现明显的抽搐现象,尾巴和四肢明显僵硬。
若灌流针误插入右心室,会导致灌流液沿肺循环途径灌流,这时肝脏变白出现的较慢,四肢的抽搐现象没有体循环明显,且鼻腔中有时会有灌流液流出。
因肺循环会影响组织器官的灌流效果,因此进针时要准确,避免肺循环的发生。
一旦出现肺循环指征,应及时调整进针角度。
6.适宜的灌注压?
灌注压过小,不利于灌注液在组织中的灌流,灌注压过大,会造成毛细血管和器官组织的损害,不利于组织切片的观察。
一般灌注生理盐水时灌注压在20伏左右,快速灌流多聚甲醛时一般在10伏左右,待大鼠四肢出现明显抽搐后,再缓慢灌流多聚甲醛30min,灌注压一般在5伏左右。
