初中化学方程式大全(高级书写版)
九年级化学上册5

化学方程式的定义
用化学式表示化学反应的式子,包括 反应物和生成物的化学式、反应条件、 配平等。
书写化学方程式的步骤
写出反应物和生成物的化学式;配平 化学方程式;注明反应条件;将短线 改为等号。
化学方程式的配平方法
观察法、最小公倍数法、奇数配偶法 等。
化学反应类型
化合反应、分解反应、置换反应和复 分解反应。
02
减小误差措施
04
2. 严格控制反应条件,如温度、压力等,确保实验条件的 一致性。
05
3. 重复实验多次,取平均值以减小偶然误差的影响。
03
1. 提高称量精度,使用精确的天平进行称量。
06
4. 对实验数据进行合理的处理和分析,采用适当的统计方 法减小系统误差。
总
结
延 伸
回 顾 与
拓
展
关键知识点总结回顾
您思想的提炼,请尽量言简意赅
的阐述观点
contents
单击此处输入你的正文,文字是 您思想的提炼,请尽量言简意赅 的阐述观点
化 概学 念方 与程 意式 义基
本
化学方程式定义及作用
用化学式表示化学反应的式子,即化学方程式。它表明 了反应物、生成物和反应条件。 化学方程式定义 化学方程式是化学研究的基础,它有助于我们理解和描 述化学反应的本质和过程,以及预测反应结果。 化学方程式作用
箭头含义及用法
箭头表示化学反应的方向,即反应物和生成物之间的转化关系。在化学方程式 中,箭头通常指向生成物方向,表示反应向生成物方向进行。箭头上方或下方 可以标注反应条件,如温度、压力、催化剂等。
程正 式确 原书 则写 与化 步学 骤方
遵循客观事实原则
化学反应确实存在
中考化学化学方程式分类总汇

中考化学化学方程式分类总汇一.物质与氧气的反应:1. 镁在空气中燃烧:2Mg + O 22MgO 2. 铁在氧气中燃烧:3Fe + 2O 2Fe 3O 4 3. 铜在空气中受热:2Cu + O 2 2CuO4. 铝在空气中变暗:4Al + 3O 2 === 2Al 2O 35. 氢气中空气中燃烧:2H 2 + O 2 2H 2O6. 红磷(白磷)在空气中燃烧:4P + 5O 2 2P 2O 57. 硫粉在空气中燃烧: S + O 2SO 2 8. 碳在空气中充分燃烧:C + O 2CO 2 9. 碳在空气中不充分燃烧:2C + O 22CO 10. 一氧化碳在空气中燃烧:2CO + O 22CO 2 11. 甲烷在空气中燃烧:CH 4 + 2O 2CO 2 + 2H 2O (天然气、沼气主要成分燃) 12. 酒精在空气中燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O 二.几个分解反应:13. 水在直流电的作用下分解:2H 2O2H 2↑+ O 2 ↑ 14. 加热高锰酸钾:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ (实验室制取氧气)15. 过氧化氢的分解(有少量的二氧化锰):2H 2O 2 2 H 2O + O 2↑ (实验室制取氧气)16. 加热氯酸钾(有少量的二氧化锰):2KClO 32KCl + 3O 2 ↑ (实验室制取氧气) 17. 碳酸不稳定而分解:H 2CO 3 === H 2O + CO 2↑18. 高温煅烧石灰石:CaCO 3高温CaO + CO 2↑ (工业 制取二氧化碳原理) 三.几个氧化还原反应:19. 氢气还原氧化铜:H 2 + CuOCu + H 2O 20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO 2↑21. 焦炭还原氧化铁:3C+ 2Fe 2O 3高温4Fe + 3CO 2↑22. 焦炭还原四氧化三铁:2C+ Fe 3O 4高温3Fe + 2CO 2↑ 23. 一氧化碳还原氧化铜:CO+ CuO Cu + CO 224. 一氧化碳还原氧化铁:3CO+ Fe 2O 3高温2Fe + 3CO 2 (炼铁原理:赤铁矿) △ △ △ △25. 一氧化碳还原四氧化三铁:4CO+ Fe 3O 4高温3Fe + 4CO 2 (炼铁原理:磁铁矿)四.单质、氧化物、酸、碱、盐的相互关系 (1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)26. 锌和稀硫酸反应:Zn + H 2SO 4 === ZnSO 4 + H 2↑ (实验室制取氢气)27. 铁和稀硫酸反应:Fe + H 2SO 4 === FeSO 4 + H 2↑ 反应慢28. 镁和稀硫酸反应:Mg + H 2SO 4 === MgSO 4 + H 2↑ 反应太快29. 铝和稀硫酸反应:2Al +3H 2SO 4 === Al 2(SO 4)3 +3H 2↑30. 锌和稀盐酸反应:Zn + 2HCl=== ZnCl 2 + H 2↑ (实验室制取氢气)31. 铁和稀盐酸反应:Fe + 2HCl=== FeCl 2 + H 2↑ 反应慢32. 镁和稀盐酸反应:Mg+ 2HCl=== MgCl 2 + H 2↑ 反应太快33. 铝和稀盐酸反应:2Al + 6HCl === 2AlCl 3 + 3H 2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO 4 === FeSO 4 + Cu (湿法炼铜)35. 铝和硫酸铜溶液反应:2Al + 3CuSO 4 === Al 2(SO 4)3 + 3Cu36. 铝和硝酸银溶液反应:Al + 3AgNO 3 ===Al(NO 3)3 + 3Ag37. 铜和硝酸银溶液反应:Cu + 2AgNO 3 === Cu(NO 3)2 + 2Ag(3)酸 + 盐 -------- 另一种酸 + 另一种盐38. 大理石与稀盐酸反应:CaCO 3 + 2HCl === CaCl 2 + H 2O + CO 2↑(实验室制取二氧化碳原理)39. 碳酸钠与稀盐酸反应: Na 2CO 3 + 2HCl === 2NaCl + H 2O + CO 2↑(灭火器原理)40. 碳酸氢钠与稀盐酸反应: NaHCO 3 + HCl === NaCl + H 2O + CO 2↑( 除C O 2中的HCl )五.其它反应:41. 二氧化碳溶于水:CO 2 + H 2O === H 2CO 3 (解释二氧化碳通入石蕊溶液变红)42. 生石灰溶于水:CaO + H 2O === Ca(OH)2 (放热反应)43. 三氧化硫溶于水:SO 3 + H 2O === H 2SO 4 (硫酸型酸雨形成原因之一)44. 碳与二氧化碳在高温下的反应:C + CO 2 高温2CO (吸热反应)45. 二氧化碳通入澄清石灰水CO 2 + Ca(OH)2 === CaCO 3 ↓+ H 2O 检验或验证CO 246. 氢气在氯气中燃烧:H 2 + Cl 22HCl (氯化氢气体溶于水后就是盐酸) 47. 钠在氯气中燃烧:2Na+ Cl 2 2NaCl48. 硫酸铜晶体受热分解:CuSO 4·5H 2O CuSO 4 + 5H 2O ↑49. 无水硫酸铜检验水:CuSO 4 + 5H 2O === CuSO 4·5H 2O (证明水存在)50.拉瓦锡测定空气成分:2Hg + O 2 2HgO△△。
课外化学方程式的书写

课外化学方程式的书写1、铜器在潮湿的空气中,在氧气、二氧化碳和水份的作用下、表面会慢慢地生成一层绿色的铜锈,主要成分的化学式为Cu2(OH)2CO3。
该反应的化学方程式为:___________________________ 。
2、人类很早就发现,孔雀石[主要成分的化学式Cu2(OH)2CO3]在熊熊燃烧的树木中灼烧后,发生分解反应,生成三种氧化物,剩余固体再与碳反应,余烬里有一种红色光亮的金属显露出来。
试用化学方程式表示孔雀石变化的两个主要反应:(1)____________________ _。
(2)______________________。
3、将铜粉放入稀硫酸中并通入氧气,溶液的颜色变成蓝色。
这一反应的化学方程式是________ 。
4、黑火药是我国古代四大发明之一,它是由木炭、硫黄、火硝(硝酸钾)按一定比例混合而成的,爆炸时生成硫化钾、氮气和二氧化碳。
黑火药爆炸的化学方程式是_______________________ 。
5、家庭使用的液化气是碳氢化合物,化学式可写为CxHy在空气中完全燃烧生成 ________,化学方程式为_______________________________________________________。
6、取8克某有机化合物(相对分子质量为32),在氧气中完全燃烧生成11克二氧化碳和9克水,则该有机物中一定含有________________元素,误服该有机物会使人中毒失明甚至死亡,写出此有机物在空气中燃烧的化学方程式____________________________________。
7、海洛因、鸦片、大麻都是严重危害人类健康的毒品,其中大麻主要成分的化学式为C21H30O2,在空气中焚烧大麻主要成分的化学方程式是_______________________________。
8、河水里的微生物使有机物(以C6H10O5表示)转化为CO2和H2O的过程中所需的O2量叫生化需氧量(BOD),BOD是衡量水体质量的一个指标。
九年级化学方程式大全最全整理

九年级化学方程式大全最全整理化学方程式是描述化学反应过程的一种表示方法,通过化学方程式,我们可以了解反应物、生成物之间的量比关系以及反应过程中的能量变化。
在九年级的化学学习中,了解常见的化学方程式以及它们的意义是非常重要的。
本文将为大家整理九年级化学方程式的大全,以供参考。
一、氧化还原反应方程式氧化还原反应是指物质中的原子的氧化态和还原态发生改变的反应。
我们可以通过化学方程式来描述氧化还原反应。
1. 单质与非金属元素反应:- 氧化反应示例:C + O2→ CO2- 还原反应示例:2H2O → 2H2 + O22. 单质与金属元素反应:- 氧化反应示例:S + O2 → SO2- 还原反应示例:2Ag2O → 4Ag + O23. 金属之间的氧化还原反应:- 同金属不同氧化态:Cu + 2AgNO3 → Cu(NO3)2 + 2Ag- 不同金属不同氧化态:Zn + 2HCl → ZnCl2 + H2二、酸碱反应方程式酸碱反应是指酸和碱发生中和反应的过程。
下面是几组常见的酸碱反应方程式。
1. 碱与酸反应:- 碱氢氧化物和酸:NaOH + HCl → NaCl + H2O- 碱氮氢化合物和酸:NH3 + HCl → NH4Cl2. 碱与金属氢氧化物反应:- NaOH:NaOH + KOH → NaK + H2O- Mg(OH)2:2Mg(OH)2 + 2HCl → MgCl2 + 2H2O三、置换反应方程式置换反应是指一个元素或离子被另一个元素或离子取代的反应。
下面是几组典型的置换反应方程式。
1. 金属与酸的置换反应:- 镁与稀盐酸:Mg + 2HCl → MgCl2 + H2↑- 铁与硫酸:Fe + H2SO4 → FeSO4 + H2↑2. 金属与金属盐溶液的置换反应:- 铜与硫酸铁:Cu + FeSO4 → CuSO4 + Fe四、还原反应方程式还原反应是指物质从氧化态还原为较低的氧化态或还原为金属的过程。
科粤版初三化学上册 化学方程式书写及其计算(提高) 知识点讲解(常考点练习)

科粤版初三化学上册知识点梳理重点题型(常考知识点)巩固练习化学方程式书写及其计算(提高)【学习目标】1. 通过具体化学反应分析,理解化学方程式的含义。
2.掌握化学方程式的书写原则和步骤;了解几种化学方程式的配平方法;能熟记并能书写常见反应的化学方程式。
3.掌握有关反应物、生成物质量的计算;掌握解计算题的基本格式。
【要点梳理】要点一、化学方程式1.定义:用化学式来表示化学反应的式子,叫做化学方程式,又叫反应方程式。
2.化学方程式的含义:3.化学方程式的读法(以S+O2SO2为例):(1)质的方面:硫和氧气在点燃条件下反应生成二氧化硫。
(2)量的方面:每32份质量的硫和32份质量的氧气完全反应生成64份质量的二氧化硫。
(3)粒子方面:每1个硫原子和1个氧分子反应生成1个二氧化硫分子。
【要点诠释】1.在化学反应中,反应物、生成物之间的质量比就是化学计量数与相对分子质量之积的比;2.化学式前面的数字之比是反应物与生成物之间的粒子数之比,而不是质量比。
要点二、化学方程式的书写原则和步骤1.书写化学方程式时应遵循两条原则:(《化学方程式的书写及其计算》)(1)一是以科学实验的事实为依据,写出反应物和生成物的化学式。
(2)二是以质量守恒定律为根据,等号两边各种原子的种类和数目必须相同。
2.书写化学方程式的五个步骤(以高锰酸钾受热分解为例)(1)“写”:根据实验事实,短线左边写反应物的化学式,右边写生成物的化学式,不止一种物质的用加号连接。
KMnO4─K2MnO4+MnO2+O2(2)“配”:调整化学式前边的化学计量数,使短线左右两边同种原子的数目相等。
2KMnO4─K2MnO4+MnO2+O2(3)“注”:注明反应条件、气体放出符号“↑”和沉淀符号“↓”。
如果反应物和生成物中都有气体或都有固体,气体生成物或固体生成物就不要注“↑”或“↓”。
(4)“改”:配平后必须把短线改为等号。
2KMnO4K2MnO4+MnO2+O2↑(5)“查”:一查化学式;二查配平(等号两边各种原子的总数是否相等);三查条件;四查生成物的状态。
5.2.1 化学方程式(上)(学生版) 24-2025学年九年级化学上册同步学与练(人教版2024)
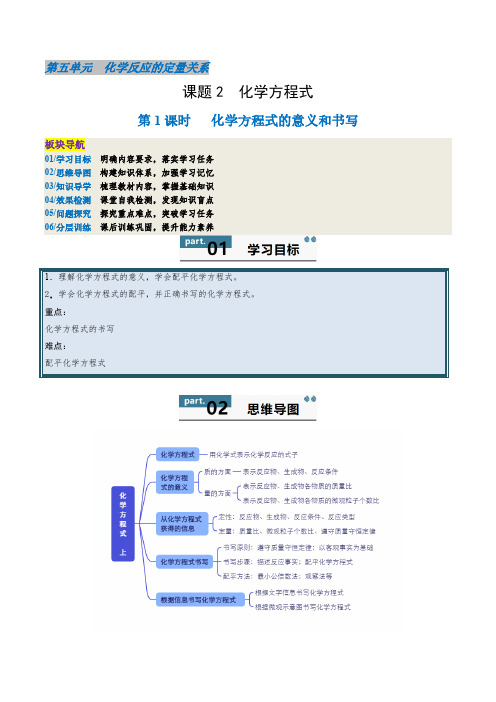
第五单元化学反应的定量关系课题2 化学方程式第1课时化学方程式的意义和书写板块导航01/学习目标明确内容要求,落实学习任务02/思维导图构建知识体系,加强学习记忆03/知识导学梳理教材内容,掌握基础知识04/效果检测课堂自我检测,发现知识盲点05/问题探究探究重点难点,突破学习任务06/分层训练课后训练巩固,提升能力素养一、化学方程式及意义1.化学方程式:用 来表示化学反应的式子。
2.化学方程式的意义3.从化学方程式获得的信息二、化学方程式的书写1.书写原则(1)要以为基础,写出反应物、生成物和反应条件,体现化学反应中的关系。
(2)要遵守,使等号两边各原子的种类与数目相等,体现化学反应中的关系。
2.书写化学方程式的步骤(以磷在氧气中燃烧生成五氧化二磷的反应为例)【易错提醒】(1)如果反应物和生成物中都有气体,气体生成物就不注“↑”号,如C+O2 点燃CO2;(2)溶液中的反应,若反应物和生成物中都有固体,固体生成物也不注“↓”号,如Fe+CuSO4==FeSO4+Cu。
(3)“↑”和“↓”只能标注在生成物中,不能标注在反应物中。
(4)“点燃”不能与“加热”、“∆”混淆,也不能写成“燃烧”。
3.化学方程式的配平方法三、根据信息书写化学方程式1.根据文字信息书写化学方程式从文字表述中找出、和,然后配平。
典例:写出下列与氢气有关的反应的化学方程式。
(1)在1200~1300 ℃时,三氯化硼(BCl3)蒸气与干燥、纯净的氢气反应可制得单质硼(B)和氯化氢:。
(2)氢化钙(CaH2)固体是一种储氢材料,能与水反应生成氢氧化钙和氢气:。
【易错提醒】(1)反应条件要严格按照题给信息书写,不能擅自改动。
如“1200℃”不能写成“高温”;“一定条件”、“催化剂”、“高温高压”等都要原文照抄,不可改动。
(2)关注反应物和生成物的状态,考虑是否需要添加气体符号和沉淀符号。
2.根据微观反应示意图书写化学方程式(1)恰好完全反应时典例:二氧化碳转化为甲醇的微观示意图如图所示,请回答:写出该反应的化学方程式:。
高一化学必修化学方程式电子式电极反应式总汇

物质结构元素周期律1、4Li + O 2--------- 2Li2 O 4Na+O= 2Nc fe O 2Na+O 2------------- N aQ22Na+2H 2O===2NaOH+H 2 f 2K+2H 2O===2KOH+H 2 f 2、卤素单质与氢气反响(条件、现象不同)F2 + H 2 === 2HF C12 + H 2 === 2HCl B Q + H 2 === 2HBr I2 + H 2 === 2HI 3、卤素单质间的置换反响:(1)CI2可以从溴化物(或碘化物)中置换出B「2 (或12):①Cl2+2NaBr=Br 2+2NaCI ② Cb+2KI=I 2+2KCI(2) Br2可以从碘化物中置换出I2 :Br2+2KI=I 2+2KBr 4、Mg+2H 2O === Mg(OH) 2+H 2f(沸水)2AI+6HCI===2AICI 3+3H 2 f Mg+2HCI :===MgCI 2+ H 2 f 5Cl£+£Ma gUad第二章化学反响与能量1、Ba(0H)2 • 8H2O+2NH 4CI==BaCl2+2NH 3 f +10H2O NaOH+HCI==NaCI+H 2O2、原电池原理(1)概念:原电池是把化学能转变成电能的装置(2)典型的原电池(Zn-Cu原电池)负极(锌):Zn-2e=Zn 2+(氧化反响) 正极(铜):2H++2e =H 2 f (复原反响) 电子流动方向:由锌经过外电路流向铜。
总反响离子方程式:Zn+2H +=Zn 2++H 2 f 催化剂3、2HQ= △ 2HzO+Q f4、2C + 0 2空2CO Fe2O3 + 3C0 局丘2Fe + 3CO2第三章有机化合物1、甲烷的主要化学性质(1)氧化反响占燃CH 4(g)+2O 2(g)占燃CO2(g)+2H 2O(I) (2)取代反响n—C—村亠LAjY:厶H—c—Cl + H^ C| (I)r【H CJ14 + Cl£—亠cn3ci + nciI t…光"CH^C1£斗Cl2——> CHC13-1- MCI CRjCl 4- 4- HC1I , 光亠小卄+ Cl2—-* CCI4 十HC1⑶聚合反响::;-r/・::.|(1)氧化反响(2)取代反响①②苯与硝酸(用状液体硝基苯。
九年级常考的15个化学方程式

九年级常考的15个化学方程式以下是九年级常考的一些化学方程式:1. 氧化反应:- 2Mg + O2 →2MgO (镁和氧气生成氧化镁)2. 酸碱中和反应:- HCl + NaOH →NaCl + H2O (盐酸和氢氧化钠生成氯化钠和水)3. 单质与氧气反应:- 2H2 + O2 →2H2O (氢气和氧气生成水)4. 金属与非金属氧化物反应:- 2Al + 3CuO →3Cu + Al2O3 (铝和铜氧化物生成铜和氧化铝)5. 水解反应:- CaCl2 + H2O →Ca(OH)2 + 2HCl (氯化钙和水生成氢氧化钙和盐酸)6. 还原反应:- 2K + 2H2O →2KOH + H2 (钾和水生成氢氧化钾和氢气)7. 燃烧反应:- C3H8 + 5O2 →3CO2 + 4H2O (丙烷和氧气燃烧生成二氧化碳和水)8. 置换反应:- Zn + CuSO4 →ZnSO4 + Cu (锌和硫酸铜置换生成硫酸锌和铜)9. 分解反应:- 2HgO →2Hg + O2 (氧化汞分解成汞和氧气)10. 碱金属与水反应:- 2Na + 2H2O →2NaOH + H2 (钠和水生成氢氧化钠和氢气)11. 碳酸盐分解反应:- CaCO3 →CaO + CO2 (碳酸钙分解成氧化钙和二氧化碳)12. 氢氧化物分解反应:- 2AgOH →Ag2O + H2O (氢氧化银分解成氧化银和水)13. 硫酸盐分解反应:- Na2SO4 →Na2O + SO3 (硫酸钠分解成氧化钠和三氧化硫)14. 过氧化物分解反应:- 2H2O2 →2H2O + O2 (过氧化氢分解成水和氧气)15. 含氧酸盐分解反应:- 2KClO3 →2KCl + 3O2 (高氯酸钾分解成氯化钾和氧气)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学方程式大全(高级书写版)
(1)单质与氧气的反应:
1、镁在空气中燃烧:
2、铁在氧气中燃烧:
3、铜在空气中受热:
4、铝在空气中燃烧:
5、氢气中空气中燃烧:
6、红磷在空气中燃烧:
7、硫粉在空气中燃烧:
8、碳在氧气中充分燃烧:
9、碳在氧气中不充分燃烧:
(2)化合物与氧气的反应:
一氧化碳在氧气中燃烧:
甲烷在空气中燃烧:
酒精在空气中燃烧:
辛烷在空气中燃烧:
二、分解反应:(1)分解反应制氧气双氧水催化分解:氯酸钾(二氧化锰)分解:
高锰酸钾受热分解:
水在直流电的作用下分解:
(2)不溶性碳酸盐受热分解碱式碳酸铜受热分解:
煅烧石灰石:
碳酸镁受热分解:
(3)碳酸氢盐受热分解碳酸氢钠受热分解:碳酸氢钙受热分解:
碳酸氢铵受热分解:
(4)不溶性碱受热分解氢氧化镁受热分解:氢氧化铜受热分解:
氢氧化铁受热分解:
氢氧化铝受热分解:
(5)其他碳酸不稳定而分解:
三、氧化还原反应:
氢气还原氧化铜:
氢气还原氧化亚铁:
氢气还原氧化铁:
氢气还原四氧化三铁:
木炭还原氧化铜:
焦炭还原氧化亚铁:
焦炭还原氧化铁:
焦炭还原四氧化三铁:
一氧化碳还原氧化铜:
一氧化碳还原氧化亚铁:
一氧化碳还原氧化铁:
一氧化碳还原四氧化三铁:
木炭与二氧化碳反应:
四、金属的化学性质金属通性:①活泼金属酸═ 盐②相对活泼金属置换相对不活泼金属(1)金属 + 酸═ 盐 + 氢气(置换反应)镁和稀硫酸反应:
铝和稀硫酸反应:
锌和稀硫酸反应:
铁和稀硫酸反应:
镁和稀盐酸反应:
铝和稀盐酸反应:
锌和稀盐酸反应:
铁和稀盐酸反应:
(2)金属+ 盐(溶液)═ 新金属+新盐铝和硫酸铜溶液反应:
锌和氯化铜溶液反应:
锌和硫酸铜溶液反应:
铁和硫酸铜溶液反应:
铁和硝酸银溶液反应:
铜和硝酸银溶液反应:
铜和硝酸汞溶液反应:
五、酸的化学性质酸的通性:①使指示剂变色②和氢以前活泼金属发生置换反应③碱性氧化物 + 酸═ 盐水④酸 + 碱
═ 盐 + 水⑤酸 + 盐═新酸 + 新盐(1)使指示剂变色(2)酸 + 金属单质═ 盐 + 氢气(3)酸 + 碱性氧化物═ 盐 +水氧化铁和稀盐酸反应:
氧化铁和稀硫酸反应:
氧化铜和稀盐酸反应:
氧化铜和稀硫酸反应:
氧化镁和稀硫酸反应:
氧化钙和稀盐酸反应:
氧化钙和硝酸反应:
(4)酸 + 碱═ 盐 + 水盐酸和烧碱起反应:
盐酸和氢氧化钾反应:
盐酸和氢氧化铜反应:
盐酸和氢氧化钙反应:
盐酸和氢氧化铁反应:
氢氧化铝药物治疗胃酸过多:
硫酸和烧碱反应:
硫酸和氢氧化钾反应:
硫酸和氢氧化铜反应:
硫酸和氢氧化铁反应:
硫酸和氢氧化钡反应:
硝酸和烧碱反应:
硝酸和氢氧化钡反应:
(5)酸 + 盐═ 新酸 + 新盐稀盐酸与大理石反应:
稀盐酸与碳酸钠反应: 稀盐酸与碳酸镁反应: 盐酸和硝酸银溶液反应:
盐酸与小苏打溶液反应:
盐酸与碳酸氢钠溶液反应:
硫酸和碳酸钠反应:
硫酸和氯化钡溶液反应:
八、碱的化学性质碱的通性:①使指示剂变色②碱 + 酸性氧化物═盐 + 水③碱 + 酸═ 盐 + 水④碱 + 盐═新碱 + 新盐(1)使指示剂变色(2)碱 + 酸性氧化物═ 盐 +水苛性钠暴露在空气中变质:
火碱吸收二氧化硫气体:
烧碱吸收三氧化硫气体:
熟石灰放在空气中变质:
消石灰吸收二氧化硫:
(3)碱 + 酸═ 盐 + 水(4)碱 + 盐═ 新碱 + 新盐氢氧化钠与硫酸铜:
氢氧化钠与氯化铁:
氢氧化钠与氯化镁:
氢氧化钾与氯化铜:
氢氧化钙与碳酸钠:
*铵盐:铵盐+碱△ 盐+ NH3↑+ H2O氯化铵与氢氧化钠共热:氯化铵与氢氧化钙共热:硫酸铵与氢氧化钾共热:九、盐的化学性质盐的通性:① 金属+盐═ 新盐+新金属②盐+酸═ 新盐+新酸③ 盐+碱═ 新盐+新碱④盐+ 盐═ 两种新盐(1)盐+金属═新盐 + 新金属(2)盐+酸═ 新盐+新酸(3)盐+碱═ 新盐+新碱(4)盐+盐═ 两种新盐氯化钠溶液和硝酸银溶液:
硫酸钠和氯化钡溶液反应:
氯化钙与碳酸钠溶液反应:
硝酸钡与碳酸钾溶液反应:
硝酸银与碳酸钾溶液反应:
八、酸性氧化物的性质:酸性氧化化物通性:①酸性氧化物水═ 相对应的酸②酸性氧化物碱性氧化物═ 盐③酸性氧化物碱═ 盐水注意:
不溶于水(1)酸性氧化物 + 水═ 相对应的酸二氧化碳与水反应:
二氧化硫与水反应:
三氧化硫与水反应:
三氧化二氮与水反应:
五氧化二氮与水反应:
五氧化二磷与水反应:
(2)酸性氧化物+碱═ 盐+水(3)酸性氧化物+碱性氧化物═ 盐氧化钙与二氧化碳反应:
氧化钙与二氧化硫反应:
氧化钠与二氧化碳反应:
六、碱性氧化物的性质碱性氧化化物通性:①碱性氧化物 + 水═ 相对应的碱②碱性氧化物 + 酸性氧化物═ 盐③碱性氧化物 + 酸═ 盐 + 水(1)碱性氧化物+水═ 相对应的碱氧化钠与水反应:
生石灰与水反应:
氧化钡与水反应:
特别注意:CuO 黑色、Cu2O 红色、FeO 黑色、 Fe2O3 红棕色、Fe3O4 黑色、MgO灰白色、Al2O3白色,这些氧化物均不溶于水,所以这些氧化物不与水反应。
(2)碱性氧化物 + 酸性氧化物═ 盐(见酸性氧化物)(3)碱性氧化物+酸═ 盐+水(见酸的化学性质)。
