备战中考化学 科普阅读题综合试题附答案解析
中考化学 科普阅读题 综合题及答案解析

一、中考初中化学科普阅读题 1.阅读下面科普短文。
钠是一种活泼金属,其原子的结构示意图为。
钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。
钠还能与水反应,生成氢氧化钠和氢气。
目前,世界上多数采用电解熔融氯化钠的方法来制得金属钠。
氯化钠的熔点为801℃,将氯化钠和氯化钙按质量比2:3混合共熔,可得到熔融温度约为580℃的共熔物,降低了电解所需的温度。
电解时,正极放出氯气,负极产生的金属钠和金属钙同时浮在共熔物,从管道溢出。
把熔融的金属混合物冷却到105~110℃,金属钙结晶析出,通过过滤可以分离出金属钠。
金属钠的应用非常广泛,可以用于制造过氧化钠(Na 2O 2)等化合物。
还能用于生产更加昂贵的金属钾,以钠和氯化钾为原料,在高温条件下,生成钾和氯化钠,生成的钾能以蒸汽的形式分离出来。
依据文章内容,回答下列问题:(1)在钠的原子结构中,与钠元素化学性质密切相关的是__________。
(2)钠具有的物理性质有__________。
(3)金属钠通常保存在石蜡油中,目的是隔绝__________。
(4)钠能与水反应,化学方程式为__________。
(5)写出用钠制取钾的化学方程式__________。
【答案】最外层电子数 银白色固体(有金属光泽、质地软) 隔绝水和氧气222Na+2H O=2NaOH+H ↑ Na+KClNaCl+K 高温【解析】 【分析】 【详解】(1)最外层电子数决定元素化学性质,故在钠的原子结构中,与钠元素化学性质密切相关的是最外层电子数(2)钠的物理性质有:有金属光泽,银白色;(3)金属钠通常保存在石蜡油中,目的是隔绝水和氧气;(4)根据题目信息可知,钠与水反应,生成氢氧化钠和氢气,反应的化学方程式为222Na+2H O=2NaOH+H ↑。
(5)钠与氯化钾在高温条件下生成氯化钠和钾,反应的化学方程式为Na+KClNaCl+K 高温。
考点:元素化学性质,物质性质,灭火原理。
中考化学综合题专练∶科普阅读题附答案
一、中考初中化学科普阅读题1.阅读下面科普短文。
花青素是广泛存在于植物中的水溶性天然色素。
自然界中现已知的花青素有20多种,植物中的花青素主要包括飞燕草、矢车菊、矮牵牛、天竺葵、芍药、锦葵色素等6种。
水果、蔬菜、花卉中的主要呈色物质大部分与花青素有关。
花青素类物质的颜色会随着植物液泡中pH的不同而变化。
花青素具有抗氧化性,能够与多种对人体有害的自由基反应,保护人体免受自由基损伤。
例如,蓝莓中的花青素是迄今发现的最高效的抗氧化剂, 它的抗氧化性比维生素E高出50倍, 比维生素C高出20倍。
由于花青素的营养和药理作用, 其保健功效已经得到广泛认可。
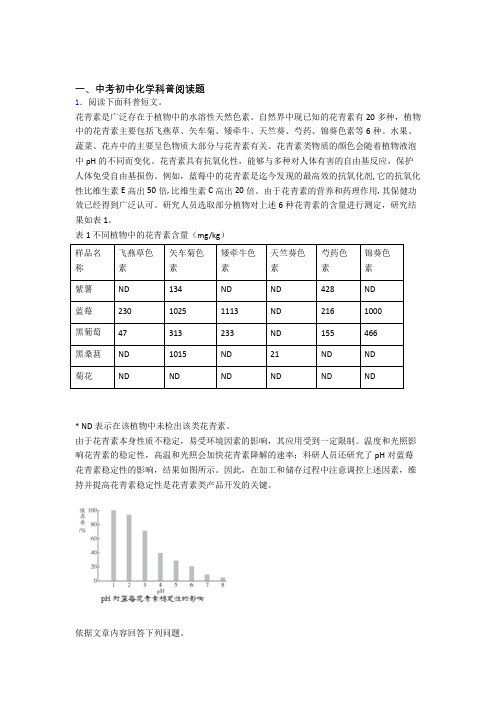
研究人员选取部分植物对上述6种花青素的含量进行测定,研究结果如表1。
表1 不同植物中的花青素含量(mg/kg)样品名称飞燕草色素矢车菊色素矮牵牛色素天竺葵色素芍药色素锦葵色素紫薯ND134ND ND428ND蓝莓23010251113ND2161000黑葡萄47313233ND155466黑桑葚ND1015ND21ND ND菊花ND ND ND ND ND ND* ND表示在该植物中未检出该类花青素。
由于花青素本身性质不稳定,易受环境因素的影响,其应用受到一定限制。
温度和光照影响花青素的稳定性,高温和光照会加快花青素降解的速率;科研人员还研究了pH对蓝莓花青素稳定性的影响,结果如图所示。
因此,在加工和储存过程中注意调控上述因素,维持并提高花青素稳定性是花青素类产品开发的关键。
依据文章内容回答下列问题。
(1)矢车菊色素(C15H11O6)中碳、氢、氧原子的个数比为:_________。
(2)文中提到花青素的化学性质有(写出一条即可)_________。
(3)根据表1,若要补充花青素,首选的食物是_________。
(4)由图1得出的结论为_________。
(5)下列说法正确的是(填字母序号)_________。
A 花青素有可能用于制作酸碱指示剂B 菊花不适合提取花青素C 富含花青素的食品尽量避光、避免高温保存D 只有富含花青素的食物才具有抗氧化性【答案】15:11:6 与自由基反应(或颜色随pH值不同而改变、抗氧化性、受热易分解等)蓝莓在pH1~8范围内,随着pH增大,花青素稳定性变差(或保存率变低) ABC 【解析】【分析】化学性质是通过化学变化表现出来的,物理性质是不通过化学变化就有的性质。
中考化学 科普阅读题 综合题附详细答案

一、中考初中化学科普阅读题1.阅读下面科普短文。
肼(N2H4)又称联氨,有类似于氨的刺鼻气味,贮存时用氮气保护并密封,用途广泛。
肼燃烧放热量大且燃烧产物对环境无污染,常用作火箭燃料,点燃时与助燃物质液态N2O4发生反应,生成N2和H2O。
高压锅炉水处理时用于脱除氧气以防止锅炉的腐蚀,也可以把锅炉内表面锈蚀后的氧化铁还原为结构紧密的四氧化三铁保护层,减缓锅炉锈蚀。
用于烟草、土豆、玉米的贮藏,用于食用盐酸的制造等。
熔点1.4℃,沸点113.5℃;有强烈的吸水性,形成水合肼(N2H4·H2O),可以用固体烧碱进行脱水;能吸收空气中的二氧化碳;易溶于水;与液氧接触能自燃;长期暴露在空气中或短时间受热时易发生分解。
对眼睛有刺激作用,能引起延迟性发炎,对皮肤和粘膜也有强烈的腐蚀作用。
依据短文内容,回答下列问题:(1)肼的下列性质中,属于化学性质的是_____(填字母序号,下同)。
A.与氧化铁作用 B.易溶于水C.易分解 D.有刺鼻的气味(2)肼在常温下为______(填“固态”“液态”或“气态”)。
(3)肼作为火箭燃料燃烧时反应的化学方程式为_____。
(4)肼有强烈的吸水性,能吸收空气中的CO2,下列物质中的_____也具有这些性质。
A.NaCl B.Ca(OH)2C.NaOH D.NaHCO3(5)肼需要密封保存的原因是______。
【答案】AC 液态 2N2H4+N2O4点燃3N2↑+4H2O C 有强烈的吸水性;能吸收空气中的二氧化碳;长期暴露在空气中易分解【解析】【详解】(1)肼的下列性质中,属于化学性质的是与氧化铁作用和易分解;(2)熔点1.4℃所以肼在常温下为液态;(3)肼作为火箭燃料燃烧时反应的化学方程式为2N2H4+N2O4点燃3N2↑+4H2O;(4)氢氧化钠具有吸水性和吸收二氧化碳的性质,故选C;(5)肼需要密封保存的原因是:有强烈的吸水性;能吸收空气中的二氧化碳;长期暴露在空气中易分解。
中考化学 科普阅读题综合试题含答案解析

一、中考初中化学科普阅读题1.阅读下面科普短文。
我们的胃液呈酸性,是因为胃腺壁细胞能分泌出盐酸。
胃酸在人体的消化吸收中发挥着重要作用,比如为胃蛋白酶提供适宜的酸性环境,分解食物中的结缔组织和肌纤维使其易于被消化吸收。
你知道吗?深受人们喜欢的早餐食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥和减缓食品变质的作用),还可以作为人体补铁剂。
要把铁粉变为人体需要的、能吸收的营养元素,就离不开胃酸的帮助。
健康人胃液的pH在0.9~1.5,胃液的pH不仅影响人的消化吸收功能,还对伴随食物进入胃内的各类病菌的繁殖有影响。
某医院对99位胃溃疡和十二指肠溃疡等患者胃液的pH及胃液中的病菌进行了检测,结果如下表:胃酸过多会对胃黏膜具有侵蚀作用,并使人感觉反酸或烧心。
治疗胃酸过多的药主要有两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸反应,常见的抗酸药有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。
胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。
患者如长期使用抗酸药,很可能刺激胃酸分泌过多。
因此,应遵医嘱合理使用抗酸类和抑酸类药物。
依据文章内容,回答下列问题。
(1)用化学方程式表示燕麦中的铁粉遇胃酸发生的反应:_____。
(2)铁粉可以减缓食物变质,是因为铁可以和_____反应。
(3)胃溃疡患者不宜服用的抗酸药是______。
(4)关于文中提到的几种抗酸药,下列说法正确的是______(填字母序号)。
A.均属于盐类或碱类B.在使用抗酸药时不是用量越多越好C.适量使用碳酸钙可治疗胃酸过多,同时还可为人体补钙(5)下列关于胃液与人体健康关系的说法中,合理的是_____(填字母序号)。
A.胃酸能帮助人体消化吸收食物,所以胃液pH越小越利于人体健康B.胃酸过多会对胃黏膜具有侵蚀作用,所以胃液pH越大越利于人体健康C.胃液pH越大越有利于病菌生存【答案】Fe+2HCl=FeCl2+H2↑氧气碳酸氢钠和碳酸钙 BC C【解析】【分析】【详解】(1)胃液注意成分是盐酸,与铁粉反应的化学方程式为Fe+2HCl= FeCl2+H2↑(2)食物变质是食物与氧气反应,铁生锈反应掉氧气,食物就不易变质。
中考化学 科普阅读题综合试题及详细答案

一、中考初中化学科普阅读题1.氯化钠是重要的调味品。
如图分别表示生成氯化钠的不同化学反应,请根据图示回答相关问题:①图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,元素的化学性质与________(填字母序号)密切相关。
A 最外层电子数B 质子数C 电子层数②图2描述了氢氧化钠溶液与盐酸反应的微观实质,图中A 、B 、C 三处中B 处应填入的化学符号是________。
③图3所示物质NaClO 2中氯元素的化合价是______,该反应的化学方程式是_________。
【答案】A H + +3 222Cl 2NaClO =2ClO 2NaCl ++【解析】【分析】【详解】元素的化学性质与元素原子最外层电子数密切相关;故填:A②氢氧化钠和盐酸反应的实质是氢离子和氢氧根离子结合生成了水分子,B 处是盐酸电离出来的氢离子;故填:H +③在NaClO 2中,钠元素是+1价,氧元素是-2价,设氯元素的化合价是x ,则有(+1)+x +(-2)×2=0,x =+3;据图可以看出,该反应是 Cl 2和NaClO 2反应生成了ClO 2和NaCl ,故填:+3,222Cl 2NaClO =2ClO 2NaCl ++。
2.阅读下列科普短文.南海——我们的“聚宝盆”南海是中国四大海域中最大、最深、自然资源最为丰富的海区。
近30年来,菲律宾、越南等五国已经与西方200多家石油公司合作,在南海海域合作钻探了约1380口钻井,年石油产量达5000万吨。
相当于大庆油田最辉煌时的年开采量。
材料1油气资源:南海中南部油气地质资源量占53%,可采资源量占66%,若被他国掠夺,中国海域将失去约2/3的可采油气资源。
西沙群岛、中沙群岛的水下有上千米的新生代沉积物,是大有希望的海底石油和天然气产地。
材料2矿产资源:南海蕴藏5万亿吨以上的锰、约3100亿吨镁、170亿吨锡和铜、29亿吨镍及锰、8亿吨钴、5亿吨银、800万吨金、60亿吨铀等,比陆地矿产资源丰富得多。
中考化学 科普阅读题综合试题含答案解析

一、中考初中化学科普阅读题1.阅读下面科普短文。
我们的胃液呈酸性,是因为胃腺壁细胞能分泌出盐酸。
胃酸在人体的消化吸收中发挥着重要作用,比如为胃蛋白酶提供适宜的酸性环境,分解食物中的结缔组织和肌纤维使其易于被消化吸收。
你知道吗?深受人们喜欢的早餐食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥和减缓食品变质的作用),还可以作为人体补铁剂。
要把铁粉变为人体需要的、能吸收的营养元素,就离不开胃酸的帮助。
健康人胃液的pH在0.9~1.5,胃液的pH不仅影响人的消化吸收功能,还对伴随食物进入胃内的各类病菌的繁殖有影响。
某医院对99位胃溃疡和十二指肠溃疡等患者胃液的pH及胃液中的病菌进行了检测,结果如下表:胃酸过多会对胃黏膜具有侵蚀作用,并使人感觉反酸或烧心。
治疗胃酸过多的药主要有两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸反应,常见的抗酸药有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。
胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。
患者如长期使用抗酸药,很可能刺激胃酸分泌过多。
因此,应遵医嘱合理使用抗酸类和抑酸类药物。
依据文章内容,回答下列问题。
(1)用化学方程式表示燕麦中的铁粉遇胃酸发生的反应:_____。
(2)铁粉可以减缓食物变质,是因为铁可以和_____反应。
(3)胃溃疡患者不宜服用的抗酸药是______。
(4)关于文中提到的几种抗酸药,下列说法正确的是______(填字母序号)。
A.均属于盐类或碱类B.在使用抗酸药时不是用量越多越好C.适量使用碳酸钙可治疗胃酸过多,同时还可为人体补钙(5)下列关于胃液与人体健康关系的说法中,合理的是_____(填字母序号)。
A.胃酸能帮助人体消化吸收食物,所以胃液pH越小越利于人体健康B.胃酸过多会对胃黏膜具有侵蚀作用,所以胃液pH越大越利于人体健康C.胃液pH越大越有利于病菌生存【答案】Fe+2HCl=FeCl2+H2↑氧气碳酸氢钠和碳酸钙 BC C【解析】【分析】【详解】(1)胃液注意成分是盐酸,与铁粉反应的化学方程式为Fe+2HCl= FeCl2+H2↑(2)食物变质是食物与氧气反应,铁生锈反应掉氧气,食物就不易变质。
备战中考化学 科普阅读题 综合题含答案解析

一、中考初中化学科普阅读题1.阅读下面科普短文。
(资料1)融雪剂按组成分为有机融雪剂和无机融雪剂。
有机融雪剂的主要成分为醋酸钾,一般用于机场等重要场所。
无机融雪剂以氯化钠、氯化钙等为主要成分,其融雪原理与相同条件下,不同浓度的食盐水的凝固点有关(见下表)。
(资料2)钛(Ti )是一种银白色的金属。
它具有良好的耐高温、耐低温、抗酸碱以及高强度、低密度的特点,广泛用于航空工业;它无毒且具有优良的生物相容性,是非常理想的医用金属材料,可用来制造人造骨等。
金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧。
在稀有气体和高温条件下,用四氯化钛和镁发生置换反应可制备金属钛。
依据资料,回答下列问题:(1)若飞机场使用融雪剂,应选择融雪剂的类别是___________。
(2)从无机融雪剂的融雪原理得出:100g 溶剂中,溶质质量和凝固点的关系是_______________。
(3)钛金属广泛应用于航空工业的原因是____________________(答出2条即可)。
(4)金属钛着火时___________(填“能”或“不能”)用二氧化碳灭火。
(5)四氯化钛制备金属钛的化学方程式是__________________________________。
【答案】有机融雪剂 溶质的质量越大,溶液的凝固点越低 高强度、低密度 不能 TiCl 4+2Mg=稀有气体高温2MgCl 2+Ti【解析】(1)有题意可知,若飞机场使用融雪剂,应选择融雪剂的类型是有机融雪剂;(2)由无机融雪剂组成与凝固点的关系,从无机融雪剂的融雪原理得出:100g 溶剂中,溶质质量和凝固点的关系是溶质的质量越大,溶液的凝固点越低;(3)钛金属广泛应用于航空工业的原因是高强度、低密度等;(4)由于金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧,所以,金属钛着火时不能用二氧化碳灭火;(5)四氯化钛制备金属钛的化学方程式是:TiCl 4+2Mg =稀有气体高温2MgCl 2+Ti 。
2024年中考化学综合测试—科普阅读题

2024年中考化学综合测试—科普阅读题1.认真阅读下列材料,回答有关问题。
工业上如何大量制取氧气空气中含氧气的体积约为21%,这是制取氧气的廉价、易得的原料。
怎样才能把氧气从空气中分离出来呢?我们知道,任何液态物质都有一定的沸点。
科学家们正是利用了物质的这一性质,在低温条件下加压,使空气转变为液态,然后升温。
由于液态氮的沸点是-196℃,比液态氧的沸点(-183℃)低,因此氮气首先从液态空气中分离出来,剩下的主要就是液态氧了。
为了便于贮存、运输和使用,通常把氧气加压到1.5×104kPa,并贮存在蓝色的钢瓶中。
近年来,膜分离技术得到迅速发展。
利用这种技术,在一定压力下,让空气通过具有富集氧气功能的薄膜,可得到含氧量较高的富氧空气。
利用这种膜进行多级分离,可以得到含90%以上氧气的富氧空气。
聚合物膜是膜分离技术中应用最广泛的一种膜材料。
聚合物膜具有良好的透气性能和机械强度,可根据不同的气体分子大小和形状进行调整。
在氧气分离中,聚合物膜可以选择性地通过较小分子的氧气,而阻隔较大分子的氮气和其他杂质气体。
通过调整膜材料的结构和组成,可以获得不同的氧气分离效果。
(1)在低温条件下加压,使空气转变为液态,然后升温,继而分离出氮气剩下液态氧。
这是利用了氧气和氮气的(填“物理性质”或“化学性质”)不同而进行分离。
(2)聚合物膜分离空气富氧的技术中,空气中分子的种类(填“改变”或“不变”)。
(3)聚合物膜的孔径(填“>”或“=”或“<”)氧分子的直径。
2.氨燃料发动机2023年11月30日,我国首台中速大功率氨(NH3)燃料发动机点火成功,发动机单缸功率可达208kW,氨能最大占比可达85%,相比于传统的柴油发动机,可降低碳排放80%。
氨燃料发动机是指用氨作为主要燃料的发动机,氨气是一种无色的具有强烈气味的气体,容易液化存储,液氨在发动机中与氧气燃烧生成氮气和水,对环境保护非常有利。
氨气的制取途径很多(如图所示),通过使用来源于风能和太阳能的电能制备氨,以及利用空气中的氮气和由电解水得到的氢气制备氨,是氨氢这种“无碳”燃料未来的发展方向。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、中考初中化学科普阅读题1.央视网消息:世界首条试验段光伏高速公路一山东济南南绕城高速,已于2018年3月28日正式通车。
这项交通行业与新能源产业深度融合的创新科技,引发脸书( Face Book)推特( Twitter)等境外社交平台上众多海外网友的关注,光伏电池的半导体材料高纯硅,可以利用石英砂(主要成分是SiO2)制得。
试回答:①在SiO2中,硅元素的化合价为_____。
②在高温下,SiO2和碳可以发生化学反应生成硅和一氧化碳,请写出该反应的化学方程式_____。
【答案】+4 SiO2+2C 高温Si+2CO↑【解析】【详解】①在SiO2中,氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,硅元素的化合价为+4。
故填:+4。
②在高温下,SiO2和碳可以发生化学反应生成硅和一氧化碳,该反应的化学方程式为:SiO2+2C 高温Si+2CO↑。
故填:SiO2+2C 高温Si+2CO↑。
2.阅读下面科普短文。
除夕的夜晚,烟花在空中绽放,细丽无比。
烟花又称花炮、烟火、焰火,主要用于典礼或表演中。
烟花和爆竹的组成类似,其中都包含黑火药。
黑火药由硝酸钾、木炭和硫粉混合而成,一定条件下引燃会发生剧烈反应,瞬间产生大量由二氧化碳氮气等组成的混合气,同时释放大量热。
由于气体体积急剧膨胀,压力猛烈增大,于是发生爆炸。
在军事上,黑火药是弹药的重要组成部分,可用作枪弹炮弹的发射药等。
制作烟花的过程中还加入一些发光剂和发色剂,它们使烟花呈现五彩缤纷的颜色。
发光剂是金属镁或金属铝的粉末。
发色剂是一些金属化合物,不同金属元素的化合物在火焰上灼烧时,发出不同颜色的光芒。
例如,氯化钠和硫酸钠等物质在火焰上灼烧时会发出黄色光芒,含钙化合物会发出砖红色光芒;含铜化合物会发出绿色光芒。
因此,人们常通过燃放烟花来烘托节日气氛。
但由于黑火药燃烧会产生有害气体,也带来一些环境问题。
依据文章内容,回答以下问题:(1)黑火药是一种_________(填“混合物”或“纯净物”)。
(2)黑火药爆炸时,除二氧化碳、氮气以外的其它产物中一定含________元素(填元素符号)。
(3)镁粉在空气中燃烧的主要反应的化学方程式为__________________。
(4)灼烧时发出绿色光芒的化合物可能是_________(任写一种物质的化学式即可)。
(5)为减少燃放烟花爆竹造成的大气污染,可采取的措施有__________________。
【答案】混合物 K和S 2Mg+O2点燃2MgO 硫酸铜尽量少放或不放烟花爆竹、燃放后及时清扫洒水、使用环保型烟花等【解析】【详解】(1)黑火药由硝酸钾、木炭和硫粉混合而成是一种混合物;(2)根据质量守恒定律可以知道黑火药爆炸时,除二氧化碳、氮气以外的其它产物中一定含K和S;(3)镁粉在空气中燃烧生成一种白色的固体物质氧化镁,2Mg+O2点燃2MgO;(4)含铜化合物会发出绿色光芒所以可能是硫酸铜等;(5)为减少燃放烟花爆竹造成的大气污染,可采取的措施有尽量少放或不放烟花爆竹、燃放后及时清扫洒水、使用环保型烟花。
3.“中华文化标志城”的筹建工作全面展开,为建好中华文化标志城,保护我市优美的环境,促进经济可持续发展,我市建立了固体废弃物处理场,其中填埋场采用改良型厌氧卫生填埋方式,垃圾按单元分层作业,其流程为计量﹣﹣倾倒﹣﹣推平﹣﹣压实﹣﹣消杀﹣﹣覆土﹣﹣封场﹣﹣绿化;对垃圾填埋后产生的气体经导排系统收集后用于供热或发电;对垃圾渗透漏液经调节池集中收集后通过日处理达1500吨的污水处理厂,进行化学处理,达到国家二级排放标准后排放.(1)垃圾送到固体废弃物处理场前先进行分类处理,分为可回收垃圾和不可回收垃圾,在可回收垃圾中,易拉罐与旧铁锅归为一类,回收废旧金属的好处是什么?_____.(2)回收废旧塑料垃圾可减少“白色污染”,要解决“白色污染”问题,还应从哪些方面入手?(至少答两点)_____、_____.(3)污水进行生物和化学处理时,你认为采取的化学方法处理污水的措施有哪些?(至少答两点)_____、_____.(4)垃圾填埋后会产生沼气,沼气燃烧可用于供热或发电,其完全燃烧的化学方程式为:_____,这对解决农村燃料问题有哪些好处?_____.【答案】节约金属资源用布袋代替塑料袋、用可降解塑料、重复使用塑料制品中和法氧化法 CH4+2O2点燃CO2+2H2O 废物利用,变废为宝,节约资源【解析】【分析】三大合成材料:合成纤维、合成橡胶、塑料;甲烷和氧气点燃生成水和二氧化碳。
【详解】(1)垃圾并非废物,而是放错地方的宝贝,垃圾分类处理,可以将有用的部分回收利用,发挥其作用,如金属类回收后再利用,可节约金属资源,还能节约能源。
(2)塑料是高分子材料,降解慢,大量使用并丢弃就会造成白色污染,防治的办法有许多,如用布袋代替、研制可降解的塑料等。
(3)许多污水呈酸性或碱性,因此可用中和法来净化,有些有害物质如果经氧气或臭氧来氧化后,就能变成无害物质,因此氧化法也是常用的化学净水法。
(4)垃圾填埋后,在微生物的作用下发酵可产生沼气,其主要成分是甲烷,燃烧后生成水和二氧化碳,化学方程式为4222CH +2O CO +2H O 点燃。
4.阅读下面科普短文.洁厕剂的主要成分一般是酸、表面活性剂、香精、缓蚀剂等,其中酸是最重要的原料.其中主要应用的酸为无机酸,有机酸则很少使用.无机酸盐中多采用盐酸、磷酸、甲酸、氨基磺酸及其它低分子有机酸.而多数洁厕灵以盐酸为其主要原料.盐酸主要成分为HCl ,相对分子质量36.46.盐酸为不同浓度的氯化氢水溶液,呈透明无色,有刺激性气味和强腐蚀性.易溶于水、乙醇、乙醚和油等.盐酸能与硝酸银溶液反应,生成不溶于稀硝酸(HNO 3)的氯化银.氯化银难溶于水,产生白色的凝乳状沉淀. 洁厕剂不能与其他洗涤用品同时使用,尤其不能与84消毒液混用.因为洁厕灵是酸性洗涤剂,主要成分是盐酸(HCl );84消毒液是碱性洗涤剂,主要成分是次氯酸钠(NaClO );二者结合会产生有毒的氯气,损害身体健康.使用洁厕灵时应尽量避免接触皮肤.洁厕灵不宜用于非瓷表面,如水泥地面、大理石及铝制品,也不能与其他碱性洗涤用品(如厨房清洁剂、肥皂等)同时使用,否则将失效. 依据文章内容,回答下列问题:(1)氯化氢水溶液的物理性质_____.(2)为什么洁厕灵与84消毒液的用途不同?_____.(3)写出盐酸与硝酸银溶液反应生成稀硝酸和氯化银的化学方程式_____.(4)84消毒液是碱性洗涤剂,请再举出一种试剂显碱性_____.(5)根据洁厕灵的特点,推测将洁厕剂洒到了皮肤上应该采取什么措施_____.【答案】透明无色,有刺激性气味,易溶于水、乙醇、乙醚和油; 因为它们的主要成分的性质不同,性质决定用途; HCl+AgNO 3═HNO 3+AgCl ↓ NaOH 溶液或Na 2CO 3溶液等合理即可 用大量水冲洗,并涂上适量肥皂水【解析】【详解】(1)氯化氢水溶液的物理性质:透明无色,有刺激性气味,易溶于水、乙醇、乙醚和油; (2)因为洁厕灵是酸性洗涤剂,主要成分是盐酸(HCl );84消毒液是碱性洗涤剂,主要成分是次氯酸钠(NaClO),它们的主要成分的性质不同,故用途不同;(3)盐酸与硝酸银反应生成稀硝酸和氯化银,化学方程式为:HCl+AgNO3═HNO3+AgCl↓;(4)NaOH溶液呈碱性;(5)洁厕灵呈酸性,洒到了皮肤上应该用大量水冲洗,并涂上适量肥皂水.故答案为(1)透明无色,有刺激性气味,易溶于水、乙醇、乙醚和油;(2)因为它们的主要成分的性质不同.性质决定用途;(3)HCl+AgNO3═HNO3+AgCl↓;(4)NaOH溶液或Na2CO3溶液等合理即可;(5)用大量水冲洗,并涂上适量肥皂水.5.阅读下面科普短文。
绿色植物的光合作用沐浴在阳光下的绿色植物在悄悄地进行着一个重要的化学变化——光合作用。
它是绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存能量的有机物(淀粉),并且释放氧气的过程。
绿色植物的光合作用需要什么条件呢?(实验1)实验装置如右图所示。
一段时间后,取玻璃瓶内罩住的叶片及未罩住的一个叶片,分别经过脱色等处理,加入碘溶液。
观察到前者无变化,后者变蓝。
(实验2)操作步骤:①取淡蓝色的BTB溶液倒入试管A中。
②另取BTB溶液放入大烧杯中,向溶液中吹气,溶液颜色变黄。
③将大烧杯中的BTB溶液倒入B、C、D试管中,在C、D试管中各放入一棵植物。
④用橡皮塞将A、B、C、D 4个试管塞紧,并用锡纸将试管D包裹。
⑤将4个试管置于光照下,观察BTB溶液的变色情况。
实验现象:一段时间后,观察到A试管中溶液颜色仍为淡蓝色,B试管中溶液颜色仍为黄色,C试管中溶液颜色变为淡蓝色,D试管中溶液颜色仍为黄色。
小资料:1.淀粉遇碘会变为蓝色。
6.阅读下列科普文章钾是碱金属元素,原子序数为19。
在常态下,钾具有银白色光泽,质地十分柔软,可以用小刀切割。
钾的熔点很低,只有摄氏63度,就是说,只要温度升高到摄氏63度,金属钾就变成水银般的液体了。
钾的比重很小,它比水还轻。
钾在地壳中的含量为259%,占第七位。
在海水中,除了氯、钠、镁、硫、钙之外,钾的含量占第六位。
钾的化学性质十分活泼,刚刚切开的金属钾极容易被氧化形成氧化钾。
钾与水反应剧烈,当把一块钾放入水里时,你就会看到它不断地浮起落下,周身还冒出火焰。
一会儿再看,水中的钾就消失了。
原来,它跟水发生反应生成了氢氧化钾,氢氧化钾溶解在水中,所以就看不到了。
钾同酸的水溶液反应更加猛烈,几乎能达到爆炸的程度。
由于钾的性质太过活泼,所以通常人们就将钾放进煤油里来保存。
回答下列问题:(1)钾原子核内质子数为________。
(2)金属钾通常保存在__________;金属的物理性质有__________(至少答四点)。
(3)氢氧化钾水溶液的pH为______7。
(填大于、小于或等于)(4)金属钾与水反应的化学方程式为_________________________。
【答案】(1)19(2)煤油;银白色、质软、熔点低、密度小(3)大于(4)2K+2H2O=2KOH+H2↑【解析】试题分析:(1)钠原子核内质子数为19;(2)根据题目信息知,金属钾通常保存在煤油里,金属的物理性质有:银白色,质软,熔点低,密度小;(3)氢氧化钾水溶液呈碱性,pH大于7;(4)金属钾与水反应,生成氢氧化钾和氢气。
考点:物质的性质,溶液酸碱度。
7.化学与生活是紧密相联的。
阅读下列科普短文,然后回答问题:酒精是一种无色透明、易挥发,易燃烧,不导电的液体。
有酒的气味和刺激的辛辣滋味,微甘。
学名是乙醇,化学式为C2H6O。
凝固点-117.3℃。
沸点78.2℃。
