高中化学原电池和电解池全面总结超全版
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
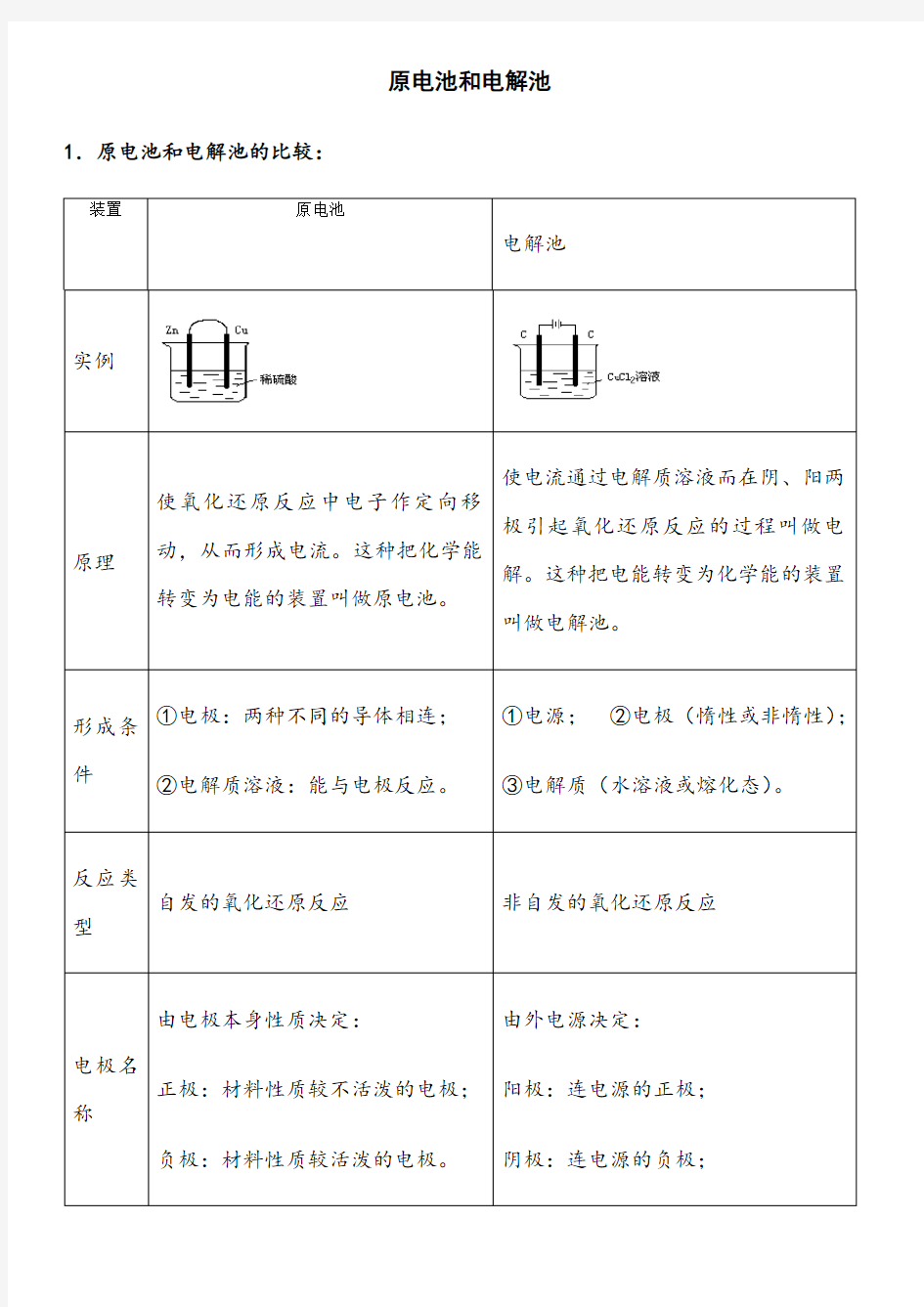
原电池和电解池1.原电池和电解池的比较:
装置原电池
电解池实例
原理使氧化还原反应中电子作定向移
动,从而形成电流。这种把化学能
转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两
极引起氧化还原反应的过程叫做电
解。这种把电能转变为化学能的装置
叫做电解池。
形成条件①电极:两种不同的导体相连;
②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);
③电解质(水溶液或熔化态)。
反应类
型
自发的氧化还原反应非自发的氧化还原反应
电极名称由电极本身性质决定:
正极:材料性质较不活泼的电极;
负极:材料性质较活泼的电极。
由外电源决定:
阳极:连电源的正极;
阴极:连电源的负极;
2.化学腐蚀和电化腐蚀的区别
3.吸氧腐蚀和析氢腐蚀的区别
4.电解、电离和电镀的区别
5.电镀铜、精炼铜比较
6.电解方程式的实例(用惰性电极电解):
↑+Cl2↑+2NaOH增强
CuSO4
4OH--4e-=2H2O+O2
↑Cu2+ +2e-= Cu
2CuSO4+2H2O=2Cu+
O2↑+2H2SO4
OHˉ放电,酸
性增强
考点解说
1.电化腐蚀:发生原电池反应,有电流产生
(1)吸氧腐蚀
负极:Fe-2e-==Fe2+
正极:O2+4e-+2H2O==4OH-
总式:2Fe+O2+2H2O==2Fe(OH)2
4Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O (2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-
负极:Fe -2e-==Fe2+
正极:2H+ + 2e-==H2↑
总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑
Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。2.金属的防护
⑴改变金属的内部组织结构。合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。如:不锈钢。⑵在金属表面覆盖保护层。常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法
①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极
3。常见实用电池的种类和特点
⑴干电池(属于一次电池)
①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+
正极:2NH4++2e-=2NH3+H2
NH3和H2被Zn2+、MnO2吸收: MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+
⑵铅蓄电池(属于二次电池、可充电电池)
①结构:铅板、填满PbO2的铅板、稀H2SO4。
②A.放电反应负极: Pb-2e-+ SO42- = PbSO4
正极: PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2O
B.充电反应阴极:PbSO4 +2e-= Pb+ SO42-
阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-
总式:Pb + PbO 2 + 2H2SO4放电
===
充电2PbSO4 + 2H2O
注意:放电和充电是完全相反的过程,放电作原电池,充电作电解池。电极名称看电子得失,电极反应式的书写要求与离子方程式一样,且加起来应与总反应式相同。
⑶锂电池
①结构:锂、石墨、固态碘作电解质。
②电极反应负极: 2Li-2e- = 2Li+
正极: I2 +2e- = 2I-总式:2Li + I2 = 2LiI
⑷A.氢氧燃料电池
①结构:石墨、石墨、KOH溶液。
②电极反应负极: H2- 2e-+ 2OH- = 2H2O
正极: O2 + 4e- + 2H2O = 4OH-总式:2H2+O2=2H2O
(反应过程中没有火焰,不是放出光和热,而是产生电流)注意:还原剂在负极上反应,氧化剂在正极上反应。书写电极反应式时必须考虑介质参加反应(先常规后深入)。若相互反应的物质是溶液,则需要盐桥(内装KCl的琼脂,形成闭合回路)。
B.铝、空气燃料电池以铝—空气—海水电池为能源的新型海水标志灯已研制成功。这种灯以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而源源不断产生电流。只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。
电极反应:铝是负极 4Al-12e-== 4Al3+;
石墨是正极 3O2+6H2O+12e-==12OH-
4.电解反应中反应物的判断——放电顺序
⑴阴极A.阴极材料(金属或石墨)总是受到保护。
B.阳离子得电子顺序—金属活动顺序表的反表:
K+ ⑵阳极A.阳极材料是惰性电极(C、Pt、Au、Ti等)时: 阴离子失电子:S2- > I- > Br- > Cl- > OH- > NO3- 等含氧酸根离子>F- B.阳极是活泼电极时:电极本身被氧化,溶液中的离子不放电。 5.电解反应方程式的书写步骤:①分析电解质溶液中存在的离子;②分析离子的放电顺序;③确定电极、写出电极反应式;④写出电解方程式。如: 解NaCl溶液:2NaCl+2H2O 电解 ====H2↑+Cl2↑+2NaOH,溶质、溶剂均发生电解反应,PH增大 ====2Cu + O2↑+ 2H2SO4溶质、溶剂均发生电解 ⑵电解CuSO4溶液:2CuSO4 + 2H2O电解 反应, PH减小。 ==== Cu+Cl2↑ ⑶电解CuCl2溶液:CuCl2电解 ==== H2↑+Cl2↑溶剂不变,实际上是电解溶质,PH增大。 电解盐酸: 2HCl 电解
