米酒的检验技术及规范操作
中华人民共和国米酒标准

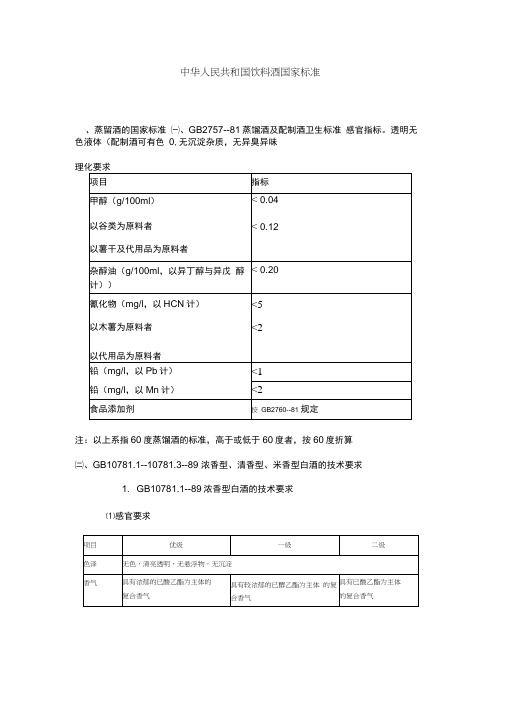
中华人民共和国饮料酒国家标准一、蒸留酒的国家标准㈠、GB2757--81蒸馏酒及配制酒卫生标准感官指标。
透明无色液体(配制酒可有色0,无沉淀杂质,无异臭异味。
注:以上系指60度蒸馏酒的标准,高于或低于60度者,按60度折算。
㈡、GB10781.1--10781.3--89浓香型、清香型、米香型白酒的技术要求1.GB10781.1--89浓香型白酒的技术要求⑴感官要求⑵理化要求注:①酒精度允许公差为±1.0度。
②酒精度40.0-9.0度,固形物可为0.50g/L。
③优级、一级、二级酒均不得加入非自身发酵产生的物质。
2.GB10781.2-89清香型白酒的技术要求⑴感官要求⑵理化要求注:①酒精度允许公差为±1.0度。
②酒精度40.0--9.0度,固形物可为0.50g/L。
③优级、一级、二级酒均不得加入非自身发酵产生的物质。
3.GB10781.3--89米香型白酒的技术要求⑴感官要求⑵理化要求注:①酒精度允许公差为±1.0度。
②酒精度40.0-49.0度,固形物可为0.50g/L。
③优级、一级、二级酒均不得加入非自身发酵产生的物质。
二、发酵酒的国家标准㈠、GB2758-81发酵酒的感官指标、理化指标、卫生标准1.感官指标:澄清液体,无沉淀及杂质,无异臭及异味。
2.理化指标:N椂谆窍醢罚é--g/L,啤酒中)3.细菌指标㈡、GB4927--91啤酒的技术要求1.感官要求⑴浓、黑色啤酒的技术要求⑵淡色啤酒的技术要求2.理化要求3.保质期瓶装、听装熟啤酒保质期不少于120d(优、一级),60d(二级),瓶装鲜啤酒保质期不少于7d。
罐装、桶装鲜啤酒保质期不少于3d。
4.卫生要求卫生指标按GB2758执行。
㈢、GB/T13662--92黄酒的技术要求1.感官要求2.理化要求(略)3.卫生指标⑴细菌总数:应符合GB2758的规定。
⑵大肠菌群:应符合GB2758的规定。
⑶二氧化硫:应符合GB2758的规定。
10 米酒的制备和酒精度测定

发酵:用保鲜膜松散地将杯口罩住。在28℃条件下发酵 48h后,观察发酵的状态。当窝内甜液达饭堆2/3高度时 ,用吸管进行搅拌。并在其中一杯以根霉孢子液拌饭的 杯子中加入酿酒酵母。继续培养24h即可 品尝:将酿制好的米酒加热煮沸后或直接品尝,对产品 进行感官评定。同时对比接种了酵母的产品和未接种酵 母的产品口感有何不同
自制酒药
根霉孢子液
根霉孢子液 接种酵母
安琪酒药
酒精度测定:发酵完成后,每4组同学收集50mL甜酒液 ,加入等体积的水混合后,在薄膜旋转蒸发器上进行酒 精蒸馏。用酒精密度计准确读出所蒸馏出的酒精度数, 评价发酵法生产酒精的特点。
乳酸菌单菌种子培养基制备(每组1瓶) 仔细清洗一只50mL小三角瓶,盛入约20mL新鲜牛奶,加 入1g白砂糖。塞上塞子后包扎于灭菌锅中高温115℃灭菌 20min。备用
米酒的制备和酒 精度测定
2011-05 -
实验目的 了解传统方法生产米酒的过程 学习米酒生产过程中的各项操作 及注意事项 比较不同接种方法对米酒质量的 影响 准备物品为下一次实验提前准备
实验原理
♦ 以糯米(或大米)经甜酒药发酵制成的甜酒酿,是我国
的传统发酵食品。我国酿酒工业中的小曲酒和黄酒生产 中的淋饭酒在某种程度上就是由甜酒酿发展而来的。 甜酒酿是将糯米经过蒸煮糊化,利用酒药中的根霉和 米曲霉等微生物将原料中糊化后的的淀粉糖化,将蛋白 质水解成氨基酸,然后酒药中的酵母菌利用糖化产物生 长繁殖,并通过酵解途径将糖转化成酒精,从而赋予甜 酒酿特有的香气、风味和丰富的营养。随着发酵时间延 长,甜酒酿中的糖分逐渐转化成酒精,因而糖度下降, 酒度提高,故适时结束发酵是保持甜酒酿口味的关键。
实验结果
原料出酒率计算 发酵期间每天观尝体会。
糯米酒的制作及其品质鉴定

糯米酒的制作及其品质鉴定摘要:利用酒药发酵的原理酿造糯米酒,并对糯米酒的品质进行鉴定,通过比较不同酒药添加量对糯米酒品质的影响,试验结果表明,加酒药量为0.6%的甜酒酿味道最香醇,总体品质最好。
关键词:糯米酒制作药酒添加量品质鉴定引言自古以来中国就有用糯米酿造米酒的传统,糯米酒富含葡萄糖及多钟氨基酸、维生素、有机酸、多糖等成分,营养丰富,滋味甘美,是一种集低度、嗜好、营养保健于一体,符合现代消费时尚,深受广大消费者喜爱的饮料酒[1]。
糯米酒中的多钟营养物质或是辅助机体消化吸收食物中的各种营养,或是参与机体免疫机能的活化,或防止外来有害菌在人体内的繁殖[2]。
以糯米(或大米)经酒药发酵制成的甜酒酿,是我国的传统发酵食品。
我国黄酒生产中的淋饭酒在某种程度上就是由甜酒酿发展而来的。
甜酒酿是将糯米经过蒸煮糊化,利用酒药中的根霉和米曲霉等微生物将原料中糊化后的的淀粉糖化,将蛋白质水解成氨基酸,然后酒药中的酵母菌利用糖化产物生长繁殖,并通过酵解途径将糖转化成酒精,从而赋予甜酒酿特有的香气、风味和丰富的营养。
随着发酵时间延长,甜酒酿中的糖分逐渐转化成酒精,因而糖度下降,酒度提高,故适时结束发酵是保持甜酒酿口味的关键。
1实验材料与方法1.1材料糯米、酒曲(药)。
1.2实验器材手提高压灭菌锅、不锈钢丝碗、滤布、烧杯、不锈钢锅、恒温箱。
1.3实验步骤1.3.1 洗米蒸饭将糯米淘洗干净,用水浸泡至米无硬心,捞起放于置有滤布的钢丝碗内,于高压锅内蒸熟(约0.01Mpa,10min)。
1.3.2 淋水降温用凉开水淋洗蒸熟的糯米饭,使其降温,并倒置于盘内。
1.3.3 落缸搭窝将酒曲粉按表1用量均匀拌入各处理的饭内,并留少许洒入烧杯内;然后将饭松散放入烧杯内,搭成凹形圆窝,其上洒少许酒曲粉,上盖培养皿。
表1 酒药添加量对甜酒酿品质的影响处理号 1 2 3加曲量(%) 0.30 0.60 0.901.3.4发酵将上述各处理于 30℃发酵2d,待有酒香味时适当搅拌,继续发酵至4d左右待来酿满窝,味甜蜜时即发酵结束。
米酒、啤酒的检验技术及规范性操作

• 将产气的发酵管分别转种在伊红美蓝琼脂平板上,置36 ℃±1 ℃温箱内, 培养18 h~ 24 h,然后取出,观察菌落形态,并做革兰氏染色和证实试验。
伊红美蓝琼脂:伊红Y和美蓝抑制绝大部分革兰氏阳 性菌的生长。伊红Y为酸性染料,美蓝为碱性染料, 琼脂是凝固剂。大肠菌群发酵乳糖产酸时,细菌带正 电荷,所以染上伊红(红色),再与美蓝结合形成紫黑 色菌落,大部分有金属光泽。
要求 100 6 不得检出
米酒检验标准
菌落总数 GB 4789.2-2010
金黄色葡萄球菌 GB 4789.10-2010
大肠菌群 GB/T 4789.3-2003
DB42/T 27-2009 孝感米酒
志贺氏菌 GB 4789.5-
2012
沙门氏菌 GB 4789.4-2010
溶血性链球菌 GB 4789.11-2014
N =∑C /(n1+ 0.1n2)d ………………………………(1) •式中: •N——样品中菌落数; •∑C——平板(含适宜范围菌落数的平板)菌落数之和; •n1——第一稀释度(低稀释倍数)平板个数; •n2——第二稀释度(高稀释倍数)平板个数; •d——稀释因子(第一稀释度)。
菌落总数
• 4.2 菌落总数的报告
• 4.2.1 菌落数小于 100 CFU 时,按“四舍五入”原则修约,以整数报 告。
• 4.2.2 菌落数大于或等于 100 CFU 时,第 3 位数字采用“四舍五入” 原则修约后,取前 2 位数字,后面用 0 代替位数;也可用 10 的指 数形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
根据对样品污染状况的 估计,按上述操作,依 次制成十倍递增系列稀 释样品匀液。每递增稀 释1 次,换用 1 支 1 mL 无菌吸管或吸头。 从制备样品匀液至样品 接种完毕,全过程不得 超过 15 min。
中华人民共和国米酒标准
中华人民共和国饮料酒国家标准、蒸留酒的国家标准㈠、GB2757--81蒸馏酒及配制酒卫生标准感官指标。
透明无色液体(配制酒可有色0,无沉淀杂质,无异臭异味理化要求注:以上系指60度蒸馏酒的标准,高于或低于60度者,按60度折算㈡、GB10781.1--10781.3--89 浓香型、清香型、米香型白酒的技术要求1. GB10781.1--89浓香型白酒的技术要求⑴感官要求⑵理化要求注:①酒精度允许公差为土1.0度。
②酒精度40.0-9.0度,固形物可为0.50g/L。
③优级、一级、二级酒均不得加入非自身发酵产生的物质2. GB10781.2-89清香型白酒的技术要求⑴感官要求⑵理化要求②酒精度40.0--9.0 度,固形物可为0.50g/L。
③优级、一级、二级酒均不得加入非自身发酵产生的物质3. GB10781.3--89米香型白酒的技术要求⑴感官要求⑵理化要求注:①酒精度允许公差为土1.0度。
②酒精度40.0-49.0度,固形物可为0.50g/L。
③优级、一级、二级酒均不得加入非自身发酵产生的物质二、发酵酒的国家标准㈠、GB2758-81发酵酒的感官指标、理化指标、卫生标准1. 感官指标:澄清液体,无沉淀及杂质,无异臭及异味2. 理化指标:3. 细菌指标㈡、GB4927--91啤酒的技术要求1. 感官要求⑴浓、黑色啤酒的技术要求⑵淡色啤酒的技术要求2. 理化要求3. 保质期瓶装、听装熟啤酒保质期不少于120d (优、一级),60d (二级),瓶装鲜啤酒保质期不少于7d。
罐装、桶装鲜啤酒保质期不少于3d。
4. 卫生要求卫生指标按GB2758执行。
㈢、GB/T13662--92黄酒的技术要求1. 感官要求2. 理化要求(略)3. 卫生指标⑴细菌总数:应符合GB2758的规定。
⑵大肠困群:应符合GB2758的规定。
⑶二氧化硫:应符合GB2758的规定。
⑷黄曲霉素B1:应符合GB2758勺规定㈣、GB/T15037-94葡萄酒的技术要求1. 感官要求2. 理化要求3. 注:酒精度在表的范围内,允许差为土1.0% (V/V), 20G4. 卫生要求铅、细菌指标按GB2758执行。
米酒试验报告

米酒试验报告【试验目的】:掌握米酒酿造的试验原理掌握米酒酿造的基本工艺掌握酿造过程中出现的问题及预防措施【试验原材料】:糯米、黑米、酒曲(主要成分根霉)、安琪酵母、保温杯3个、干净的玻璃棒(可以用三只筷子代替)、保鲜膜、饭铲一个(或用饭勺子代替)【试验原理】:糊化的高淀粉质原材料,加入米曲(进行糖化),加入酵母(进行发酵)。
可以根据所选工艺进行边糖化边发酵,也可以先糖化后发酵。
经过前发酵、主发酵、后发酵而的到具有独特口味的米酒【试验步骤】:●选料大粒、软质、心白率高,胚乳结构疏松,蛋白质及脂肪含量少,淀粉含量高,浸米吸水快而少、体积膨胀小,酿造容易的精白米。
糯米总淀粉76.98%,支链淀粉76.42%,直链淀粉0.56%,支/直比136.46,蛋白质5.8%黑米:①除了含有淀粉,蛋白质等含量与普通的大米相近外,还特别的富含人体必须的赖氨酸及钙、镁、锌、铁等微量元素。
以黑米为原料酿成的酒,营养特别的丰富并具有增强人新陈代谢的作用。
②黑米特殊的致密结构,决定了它在蒸煮过程中,要追加20%的沸水,以避免出现夹生现象,减少出糟率,提高出酒率。
本试验酿造的黑米酒酒质醇和,酒体协调,有黑米特有的香气及米酒特有的醇香,味甜醇厚,呈鲜亮玫瑰红色,突出了低度的特点,品质较好。
●洗米浸米洗米:除去附着在米上的米糠和尘土,至淋出的水无白浊为度,实际操作中是与浸米同时进行的浸米:使米中的淀粉分子吸水膨胀,淀粉颗粒间疏松,便于蒸煮糊化要求使米颗粒保持完整而米酥为度。
●蒸煮使白米的淀粉受热吸水糊化,使淀粉的结晶结结构破坏利于糖化发酵菌的作用;同时也杀菌;发挥掉原料中的怪味,使酒风味纯净。
要求蒸透无白心,疏松不糊,透而不烂,均匀一致●米饭冷却冷至适合发酵微生物繁殖的温度要求:迅速而均匀,不产生热块。
若时间长,微生物侵染,使饭变馊而酸败,淀粉老化回生造成淀粉的损失(一般冷至30℃)●落缸(将冷好的米放进保温瓶中)在此试验中共做了三个对照试验:1、将5两糯米和2两黑米放入保温瓶中压实,加入1g酒曲并加入适量的凉开水,使酒曲充分的溶解。
最新米酒实验报告

最新米酒实验报告
在本次实验中,我们对最新一批米酒进行了详细的分析和评估。
实验
的主要目的是探究米酒在不同发酵条件下的口感、酒精含量以及微生
物活性的变化。
首先,我们选取了三种不同品种的大米作为原料,分别是短粒米、长
粒米和香米。
每种米分别在三种不同的发酵温度(25°C、30°C和
35°C)下进行发酵,以观察温度对米酒品质的影响。
发酵过程中,我
们使用了两种不同的酵母菌株,一种是传统的米酒酵母,另一种是实
验室培育的改良酵母。
实验结果显示,香米在所有测试中均表现出最佳的风味和口感,其米
酒呈现出更加醇厚的甜味和较低的酒精含量。
在发酵温度方面,30°C
被认为是最佳的温度,因为它能够平衡酒精的产生和风味物质的保留。
此外,使用改良酵母菌株的米酒在酒精含量上有所提高,但对风味的
影响并不显著。
在微生物活性方面,我们通过高通量测序技术对发酵过程中的微生物
群落进行了分析。
结果表明,传统酵母菌株在发酵过程中能够更好地
促进乳酸菌的生长,这有助于提升米酒的风味复杂性。
而改良酵母菌
株虽然提高了酒精产量,但在微生物多样性方面表现不佳。
综上所述,香米在中等发酵温度下使用传统酵母菌株能够产生最佳的
米酒品质。
未来的研究可以进一步探索不同发酵时间对米酒品质的影响,以及如何通过调整发酵条件来生产特定风味的米酒。
此外,对微
生物群落的深入研究也将有助于我们更好地理解和控制米酒的发酵过程。
学生实验自酿米酒实验报告

学生实验自酿米酒实验报告一、实验目的本实验旨在通过自酿米酒的实践,让学生了解酿造米酒的基本原理和过程,培养学生动手能力以及科学实验的观察和记录能力。
二、实验所需材料和设备1. 糯米2. 酒曲3. 白糖4. 自来水5. 温度计6. 毛巾7. 塑料桶8. 玻璃瓶三、实验步骤步骤一:准备工作1. 将糯米进行清洗,放入塑料桶中浸泡6小时,然后捞出沥干水分。
2. 将捞出的糯米放入蒸锅中蒸熟,取出晾凉备用。
步骤二:酿取糯米酒1. 将晾凉的糯米均匀地铺在桶底,不要盖满桶。
2. 将酒曲均匀地撒在糯米上。
3. 微量地加入白糖,根据个人口味进行调整。
4. 将自来水加入桶中,浸泡糯米,水位略高于糯米面即可。
5. 用毛巾将桶口盖严,以保持恒定的温度。
步骤三:发酵处理1. 将桶放置在温暖、通风的地方。
2. 每天用温度计测量并记录发酵桶内的温度。
3. 用干净的木棍轻轻搅拌发酵桶内的糯米,以促进充分的发酵。
每次搅拌后需要重新将桶口盖严。
4. 酿酒过程需要持续7-10天,根据温度和气味变化判断酒液是否已经发酵完成。
步骤四:瓶装存储1. 确认酒液已经发酵完成后,用过滤纱布或滤网过滤出清澈的酒液。
2. 将过滤后的酒液均匀地倒入玻璃瓶中,尽量避免残余的沉淀。
3. 用塑料瓶盖或塞子密封瓶口,以防止外界空气进入。
4. 将瓶装的米酒放在阴凉通风处存放,存放时间越长,味道越好。
四、实验记录与结果实验开始后第一天的温度测量结果为25,第二天为28,第三天为30,之后保持在28-30的温度范围内。
在实验过程中,注意到桶内温度过高时,及时取措施进行降温,避免发酵过程中产生有害细菌。
经过10天的酿酒过程,酒液呈现黄色,散发出香甜的酒香。
经过过滤后,获得澄清的酒液。
品尝后发现,米酒酒精含量适中,甜味浓郁,酒香久留。
五、实验分析与总结通过本次实验,我们成功地自酿了米酒,了解了酿造米酒的基本原理和过程。
在实验过程中,我们发现温度对酿酒过程有很大的影响,过高或过低的温度都会影响酒液的发酵。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
米酒检验标准
菌落总数 GB 4789.2-2010
金黄色葡萄球菌 GB 4789.10-2010
大肠菌群 GB 4789.3-2010
NY/T 1885-2010 绿色食品 米酒
志贺氏菌 GB 4789.5-2012
沙门氏菌 GB 4789.4-2010
溶血性链球菌 GB 4789.11-2014
• 4.2.1 菌落数小于 100 CFU 时,按“四舍五入”原则修约,以整数 报告。
要求 100
6
不得检出
米酒检验标准
菌落总数 GB 4789.2-2010
金黄色葡萄球菌 GB 4789.10-2010
大肠菌群 GB/T 4789.3-2003
DB42/T 27-2009 孝感米酒
志贺氏菌 GB 4789.5-2012
沙门氏菌 GB 4789.4-2010
溶血性链球菌 GB 4789.11-2014
米酒检验标准
• NY/T 1885-2010 绿色食品 米酒
• 适用于各类绿色食品米酒
表2 卫生指标
项目 菌落总数b,cfu/g 大肠菌群b,MPN/g
致病菌(沙门氏菌、志贺氏菌、金黄色葡萄 球菌、溶血性链球菌) 商业无菌
a 仅适用于罐头包装产品。 b 仅适用于非罐头包装产品。
指标 ≤50 <3
不得检出
米酒检验标准
• 四十九类食品产品生产许可证审查细
则汇编
• 附件34:其他酒生产许可证审查细则(2006版)
• 检验项目:
• 发证检验、监督检验、出厂检验分别按下表列出的相应检验项目 表4 产品质量检验项目表
进行。出厂检验项目栏中注有“*”标记的,企业应当每年检验2次。
序号 项目名称
发证 监督
出厂
备注
米酒的检验技术及规范操作
内容
1
背景
2
检验依据
3
检验项目
4
记录及报告
背景
• 孝感市食品药品检验检测中心米酒检验概况
表1 2015年度米酒微生物检验汇总表
总批数 合格数 不合格数 不合格项 合格率
78
78
0
/
100%
米酒检验标准
1 NY/T 1885-2010 绿色食品 米酒 2 DB42/T 27-2009 孝感米酒 3 四十九类食品产品生产许可证审查细则汇编
米酒检验标准
• DB42/T 27-2009 孝感米酒
• 适用于孝感市孝南区生产的以孝感籼糯为主要原料,经特种酒曲 发酵,可添加白砂糖、木耳、桂花、红枣等辅料,加工制成的固 形物小于48%的孝感米酒饮品。
表3 微生物指标
项目
细菌总数/(cfu/g)
≤
大肠菌群/(MPN/100g)
≤
致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球 菌、溶血性链球菌)
取样并制备平板
选择 2 个~3 个适宜稀释度的样品匀液(液体样品可包括原液),在进行 10 倍递增稀释时,吸取 1 mL 样品匀液于无菌平皿内,每个稀释度做两个平皿。同时,分别吸取 1 mL 空白稀释液加入两个无菌 平皿内作空白对照。 及时将 15 mL~20 mL 冷却至 46 ℃ 的平板计数琼脂培养基(可放置于 46℃ ±1 ℃ 恒温水浴箱中保 温)倾注平皿,并转动平皿使其混合均匀。
N =∑C /(n1+ 0.1n2)d ………………………………(1) •式中: •N——样品中菌落数; •∑C——平板(含适宜范围菌落数的平板)菌落数之和; •n1——第一稀释度(低稀释倍数)平板个数; •n2——第二稀释度(高稀释倍数)平板个数; •d——稀释因子(第一稀释度)。
菌落总数
• 4.2 菌落总数的报告
其中一个平板有较大片 状菌落生长时,则不宜 采用,而应以无片状菌 落生长的平板作为该稀 释度的菌落数;若片状 菌落不到平板的一半, 而其余一半中菌落分布 又很均匀,即可计算半 个平板后乘以2,代表一 个平板菌落数。
当平板上出现菌落间 无明显界线的链状生 长时,则将每条单链 作为一个菌落计数。
➢ 可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应 的菌落数量。
➢ 菌落计数以菌落形成单位(colony-forming units,CFU)表示。
菌落总数
4、结果与报告
4.1 菌落总数的计算方法 4.1.1 若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平 板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每 g( mL)样 品中菌落总数结果。 4.1.2 若有两个连续稀释度的平板菌落数在适宜计数范围内时,按公式(1) 计算
9 肠道致病菌
√
√
*
仅对发酵酒
检验项目
菌落总数 大肠菌群 沙门氏菌 志贺氏菌 金黄色葡萄球菌 溶血性链球菌
菌落总数
• 检验标准:
• GB 4789.2-2010 食品安全国家标准 食品 微生物学检验 菌落总数测定
• 菌落总数:
• 食品检样经过处理,在一定条件下(如 培养基、培养温度和培养时间等)培养 后,所得每g检样中形成的微生物菌落总 数。
落总数
菌落总数
1、样品的稀释
制备1:10样品匀液
称取 25 g 样品置盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌均 质杯内,8000 r/min~10000 r/min 均质 1 min~2 min,或放入 盛有 225 mL 稀释液的无菌均质袋中,用拍击式均质器拍打 1 min~2 min,制成 1:10 的样品匀液。
菌落总数
2、培养
2.1 待琼脂凝固后,将平板翻转,36 ℃±1 ℃培养 48 h±2 h。 2.2 如果样品中可能含有在琼脂培养基表面弥漫 生长的菌落时,可在凝固后的琼脂表面覆盖一薄 层琼脂培养基(约 4 mL),凝固后翻转平板,按 2.1 条件进行培养。
菌落总数
3、菌落计数
1
2
3
选取菌落数在 30 CFU~300 CFU 之间、 无蔓延菌落生长的平板 计数菌落总数。低于 30 CFU 的平板记录具体菌 落数,大于 300 CFU 的 可记录为多不可计。每 个稀释度的菌落数应采 用两个平板的平均数。
制备1:100样品匀液
用 1 mL 无菌吸管或微量移液器吸取 1:10 样品匀液 1 mL,沿管壁缓慢 注于盛有 9 mL 稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀 释液面),振摇试管或换用 1 支无菌吸管反复吹打使其混合均匀,制成 1:100 的样品匀液。
制备10倍样品匀液
按 上一步 操作程序,制备 10 倍系列稀释样品匀液。每递增稀释一次, 换用 1 次 1 mL 无菌吸管或吸头。
