循环伏安法定量测定氯化血红素 (1)
电分析化学_循环伏安法

18
3对氧化还原峰,表明它在电极上有三个氧化-还
原过程,而且其产物是稳定的。
第三章
循环伏安法的应用 4、电极过程偶联化 学反应产物的鉴别 例如,对-氨基苯 酚的电极反应过程,
循环伏安法
19
可得如右图所示的循
环伏安图。
电分析化学
循环伏安法的应用 开始由较负的电位(图中起始点S)沿箭头方 向作阳极扫描,得到一个阳极峰1,而后作反向阴 极扫描,出现两个阴极峰2和3,再作阳极扫描时 出现两个阳极峰4和5(图中虚线表示)。其中峰5
之一。 ⊿Ep的理论值为58/n(毫伏)。这是可逆体系
的循环伏安曲线所具有的特征值。
电分析化学
基本原理 对于可逆电极过程,阴极和阳极峰的峰电流公式 相同,如下: ip=2.69×105n3/2AD1/2v1/2c ipa/ ipc=1 (5) (6)
12
由上式可知ip与v1/2呈直线关系。ipa与ipc的比值
上的反应所得到的结果。
电分析化学
基本原理 循环伏安图中可得到的几个重要参数是:阳 极峰电流(ipa),阴极电流峰电流(ipc),阳极峰 电位(Epa)和阴极峰电位(Epc)。测量确定ip的 方法是:沿基线做切线外推至峰下,从峰顶做垂
6
线切至切线,其间高度即为(ip)。Ep可直接从横
轴与峰顶对应处而读取。
又很快与溶液中共存的氧化剂Z反应,重新被氧化为 Ox,而Ox又在电极上还原为Re,形成催化循环。一 般溶液中Z过量,反应中Z的浓度可视为不变。这时 的循环伏安曲线将根据催化反应的速率常数而呈现不 同的形状(见图6)。
第三章
循环伏安法的应用 4、耦合平行(催 化)化学反应的电极 过程 当电极过程中伴
循环伏安法
循环伏安法介绍全解

2021/3/14
26
对于不可逆电极电程来 说,反向电压扫描时不出现阳 极波, 仍正比于 ,v 变大 时Epc 明显变负。根据 Ep与v 的关系,还可以计算准可逆和 不可逆电极反应的速率常数。 不可逆过程的循环伏安法曲线 如图4.17 C所示。
2021/3/14
4
二、电解池的伏安行为
当外加电压达到镉离子的电解 还原电压时,电解池内会发生如 下的氧化还原反应。
阴极还原反应:
Cd2+ + 2e Cd
阳极氧化反应:
2OH- -2e H2O + 1/2 O2
U外 ∝ i
U外- Ud= iR
U外代表外加电压、R代表电路 阻抗、 2021/3/14 Ud代表分解电压
Ep E1/2/1.10R n9FT
(2)
式中,E1/2为极谱的半波电位,半波电位值很接近标准电极电位E°。 式(2)中的正号(+)适用于阳极反应峰(Epa),负号适用于阴极峰(Epc)。
2021/3/14
13
Fig.3 典型可逆体系的循环伏安图。
2021/3/14
14
Fig.4典型准可逆体系和不可逆体系的循环伏安图环伏安法除了作为定量分析方 法外,更主要的是作为电化学研究的 方法,可用于研究电极反应的性质、 机理及电极过程动力学参数等。
2021/3/14
21
⊙电极过程可逆性的判断----对
于可逆电极过程来说,循环伏安 法阴极支和阳极支的峰电位Epa 和Epc分别为
(Cd2+)
5
循环伏安法原理
在一个典型的循环伏安实验中,工作电极一般为浸在溶液中的固定电极。 为了尽可能降低欧姆电阻,最好采用三电极系统。在三电极系统中,电流 通过工作电极和对电极。工作电极电位是以一个分开的参比电极(如饱 和甘汞电极,SCE)为基准的相对电位。在循环伏安测试实验中,工作电 极的电位以10 mV/s 到 200 mV/s 的扫描速度随时间线性变化(Fig.1a), 在此同时记录在不同电位下的电流(Fig.1b)。.
循环伏安法
❖ 循环伏安法不仅可鉴定
电化学反应产物,还可鉴 定电化学—化学偶联反应 过程的产物。
❖ 例如,对—氨基苯酚的 电极反应过程,其循环伏
安图如图。开始由较负的 电位(图中起始点)沿箭头 方向作阳极扫描,得到一 个阳极峰1,而后作反向 阴极扫描,出现两个阴极 峰2和3,再作阳极扫描时 出现两个阳极峰4和5(图 中虚线表示)。其中峰5与 峰1的位置相同。
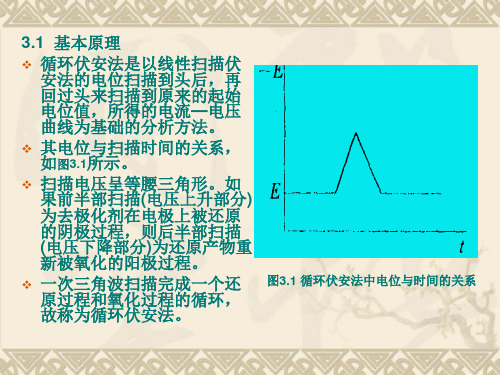
图3.1 循环伏安法中电位与时间的关系
❖ 其电流—电压曲线如图
图3.2 循环伏安图
❖ 阳、阴极峰电流之比值(设
)
❖ 严格地说,只有当电极反应产物可溶于溶液时, 上式的比值才为1。如电极产物形成汞齐,则由于 悬汞电极的体积很小,汞中还原形的浓度比溶液 中氧化形的浓度大得多,因而阳极峰电流比阴极 峰电流大。
极反应为
❖ 扫速越慢,阳极峰电流比阴极峰电流降低得更快,峰电流之 比ip,a/ip,c与v的关系如前图, ip,a/ip,c随v增加而增加,最后趋 于 发1生。水这化是反由应于电极还原产物Co(en)32+不稳定,在电极附近
❖ Co(en)32+可在阳极上氧化,而水化产物Co(en)2(OH)22+则不 能,因此,扫速越快,水化反应越来不及进行,生成的水化 物越少, ip,a/ip,c值越接近于1。反之,v越小,水化反应作用 越大,电流比值越小。
❖ 三种不同R1和R 2基的烯类比合物的反应是二聚化 反应的另一例子。其反应通式为
❖ 不同取代基的反应物的伏安图,如下图所示。
烯类化含物循环伏安图
c为
的循环伏安图,无阳极峰,表明二聚化反应很快,
循环伏安法介绍

E E RT ln cO (0, t) nF cR (0, t)
(1)
• 可逆反应的线性扫描图谱的峰电位服从下面方程:
Ep
E1/2
/ 1.109
RT nF
(2)
式中,E1/2为极谱的半波电位,半波电位值很接近标准电极电位E°。 式(2)中的正号(+)适用于阳极反应峰(Epa),负号适用于阴极峰(Epc)。
: 半峰电位与半波电位的关系为
E p/2
E1/2 1.09
RT nF
• Ep 和 Ep/2的差别为
(4)
Ep Ep/2
2.2RT nF
56.5 mV n
(5)
峰电流的计算
可逆反应的线性扫描的峰电流ip可有以下Randles-Sevcik方程给出:
ip kn3伏安法
滴定伏安法
溶出伏安法 循环伏安法
控制电位极谱法
控制电流极谱法
电流滴定伏安法 永停滴定伏安法 阳极溶出伏安法 阴极溶出伏安法 计时电位溶出伏安法
直流极谱法 方波极谱法 脉冲极谱法 单扫描示波极谱法 交流示波极谱法 计时电流极谱法
2019/9/8
伏安分析法的基本原理:
以待测物质溶液、工作电极、参比电极构成一个电解池, 通过测定电解过程中电压-电流参量的变化来进行定量、 定性分析的电化学分析方法称为伏安法。
对于不可逆电极电程来说, 反向电压扫描时不出现阳极波, 仍正比于 ,v 变大时Epc 明显变负。根据 Ep与v的关系, 还可以计算准可逆和不可逆电 极反应的速率常数。不可逆过 程的循环伏安法曲线如图4.17 C所示。
•
5.电极过程可逆性判断
电极反应机理研究
首先阳极扫描,对-胺基苯酚被氧化产 生了峰1的阳极波。
(完整版)循环伏安法

(1) 从起点S开始图,8-电19位往正方 向进行阳极扫描,得到阳极峰1。
(3) 再进行一次阳极扫描, 则又出现两个阳极峰4和5, 且峰5的电位值与峰1相同。
对-亚氨基苯 O
OH 苯醌在较负的 O
OH
醌又还原成 对-氨基苯酚
解释: + 2H++ 2e-
? c为不可逆,因为它只有一个还原峰,反方向扫描时虽 然有连续的电流衰减但是没有得到氧化峰, ipc与电压 扫描速度√ v成正比。当电压扫描速度明显增加时, φpc明显变负 。
(二)电极反应机理的研究
? 循环伏安法可用于电化学 -化学 偶联过程的研究,即在电极反应过 程中还伴随着化学反应的产生。
(2) 然后反向向阴极扫描,
一、循环伏安法
?
以快速线性扫描的形式施加三角波电压 ,一
次三角波扫描完成一个还原过程和氧化过程的循环,
然后根据 i—φ曲线进行分析的方法称为循环伏安
法。
二、工作原理
(一) 基本装置
?同普通极谱法。
1. 三角波电压
将线性扫描电压施加到电极上,
从起始电压Ui开始沿某一方向扫描到 终止电压Us后,再以同样的速度反方
向扫至起始电压,加压线路成等腰 三角形,完成一次循环。根据实际 需要,可以进行连续循环扫描。
图8-17
(二)工作原理
? 1. 当三角波电压增加时,(即电位从正向负 扫描时)溶液中氧化态电活性物质会在电极上 得到电子发生还原反应,产生还原峰。 O + ne- ? R
? 2. 当逆向扫描时,在电极表面生成的还原性 物质R又发生氧化反应,产生氧化峰。 R ? O + ne-
实验二-循环伏安法测定电极反应参数

循环伏安法测定电极反应参数一、目的要求1.学习循环伏安法测定电极反应参数的基本原理及方法。
2.熟悉伏安仪使用技巧。
二、实验原理循环伏安法(CV)是最重要的电分析化学研究方法之一。
在电化学、无机化学、有机化学、生物化学等研究领域得到了广泛应用。
由于其设备价廉、操作简便、图谱解析直观,因而一般是电分析化学的首选方法。
CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
这种方法也常称为三角波线性电位扫描方法。
图1中表明了施加电压的变化方式:起扫电位为+0.8V,反向/起扫电位为-0.2V,终点又回扫到+0.8V,扫描速度可从斜率反映出来,其值为50mV/s。
虚线表示的是第二次循环。
一台现代伏安仪具有多种功能,可方便地进行一次或多次循环,任意变换扫描电压范围和扫描速度。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。
典型的循环伏安图如图2所示。
该图是在1.0mol/L的KNO3电解质溶液中,6×10-3mol/L 的K3Fe(CN)6在Pt工作电极上反应得到的结果。
图 2 6×10–3 mol/L在1 mol/L的KNO3溶液中的循环伏安图扫描速度:50 mV/s 铂电极面积:2.54 mm2从图可见,起始电位E i为+0.8V(a点),电位比较正的目的是为了避免电极接通后Fe(CN)63–发生电解。
然后沿负的电位扫描(如箭头所指方向),当电位至Fe(CN)63–可还原时,即析出电位,将产生阴极电流(b点)。
其电极反应为:Fe(III)(CN)63– + e–——►Fe(II)(CN)64–随着电位的变负,阴极电流迅速增加(b g d),直至电极表面的Fe(CN)63-浓度趋近零,电流在d点达到最高峰。
然后迅速衰减(d g g),这是因为电极表面附近溶液中的Fe(CN)63-几乎全部因电解转变为Fe(CN)64-而耗尽,即所谓的贫乏效应。
循环伏安法原理

循环伏安法原理
循环伏安法(Cyclic voltammetry,CV)是一种常用于电化学
研究的实验技术,用于研究电化学反应动力学、电极表面的电化学性质以及电极材料的电化学特性。
该方法的原理基于对电极上施加一系列线性变化的电位,通过测量所施加电位下的电流响应来获取样品的电化学信息。
CV
实验通常在三电极电极池中进行,包含工作电极、参比电极和计量电极。
首先,通过施加一个起始电位,使得工作电极与参比电极之间建立起一个起始电位差。
然后,通过改变电位来引发电化学反应,这导致在电极表面上发生氧化和还原反应。
这些反应会引起从工作电极到计量电极的电流流动。
随后的实验过程中,电位逐渐改变,使得电化学反应在每个电位值上进行。
电位的变化速率称为扫描速率,可用于控制反应速率。
在每个电位上,会测量到一个对应的电流响应,并绘制成循环伏安曲线。
通过分析循环伏安曲线,可以获取有关电化学反应的许多信息,例如反应的峰电位(峰电位代表了氧化还原反应的电位值)、峰电流(峰电流与反应速率有关)、氧化还原峰之间的电位差(反映反应的可逆性质)、氧化还原峰的峰形等。
此外,CV
还可以用于确定电极表面的有效面积、测量电极表面上的电荷转移速率等参数。
总之,循环伏安法通过改变电位来引发电化学反应,并通过测量电流响应来获取电化学信息。
它是一种简单有效的电化学检测方法,被广泛应用于材料科学、化学分析、电池研究等领域。
实验10循环伏安法测定电极反应参数

实验10 循环伏安法测定电极反应参数一、实验目的(1)了解循环伏安法的基本原理、特点和应用。
(2)掌握循环伏安法的实验技术和有关参数的测定方法。
二、实验原理(1)循环伏安法是电化学分析中重要的一种分析方法。
在电化学分析中,凡是以测量电解过程的电流-电位(电压)曲线为目的,都称为伏安分析法。
按施加激励信号的方式、波形及种类的不同,伏安法又分为多种技术,其中线性扫描伏安法,是在工作电极和对电极上施加一随时间线性变化的直流电压(图1),并记录相应的电流-电势曲线(图2)。
线性电位扫描法分小幅度运用和大幅度运用两类。
小幅度运用一般用于测定双电层电容和反应电阻。
大幅度运用的电位扫描范围宽,可在感兴趣的整个范围进行,所以使用的范围较广,如测定电极参数,判断电极过程的可逆性/控制步骤/反应机理,研究电极的吸(脱)附现象等。
图1 图2循环伏安法就是将线性扫描电位扫到某电位E m后,再回扫至原来的起始电位值E i,电位与时间的关系如图3所示。
电压扫描速度可从每秒毫伏到伏量级。
所用的指示电极有悬汞电极、铂电极或玻璃碳电极等。
主要用于研究电极反应的性质、机理和电极过程动力学参数等。
图3 图4当溶液中存在氧化态物质O 时,它在电极上可逆地还原生成还原态物质R ,O + ne → R当电位方向逆转时,在电极表面生成的R 则被可逆地氧化为O,R → O + ne一个三角波扫描,可以完成还原与氧化两个过程,记录出如图4所示的循环伏安曲线。
在循环伏安法中,阳极峰电流i P a 、阴极峰电流i P c 、阳极峰电位E pa 、阴极峰电位E P c 是最重要的参数,对可逆电极过程来说, 峰电位不随扫描速度变化,且 5763E E E mV n∆=pa pc -= (1) 即阳极峰电势(E pa )与阴极峰电势(E pc )之差为57/n 至63/n mV 之间,确切的值与扫描过阴极峰电势之后多少毫伏再回扫有关。
一般在过阴极峰电势之后有足够的毫伏数再回扫,△E P 值为58/n mV 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
循环伏安法定量测定氯化血红素
一、实验目的
1.1. 掌握电化学工作站的基本使用方法。
1.2. 加深理解循环伏安法的测定原理。
1.3. 学习运用循环伏安法进行实际样品的分析测定。
二、实验原理
2.1.电化学检测系统是电化学分析的基础,主要包括电化学工作站、电极和电解池。
其中,电化学工作站是施加工作电压和采集电化学输出信号的电子设备,而电极是与电解质或电解质溶液接触的电子导体或半导体。
电化学分析常采用三电极体系,即工作电极(W)、参比电极(R)和对电极(A)。
工作电极是电极反应发生的场所,是最直接的分析检测器件;参比电极是一个已知电势的接近于理想不极化的电极,是测量工作电极电位的对比标准;对电极则与工作电极组成回路,使工作电极上电流畅通。
对电极一般采用面积较大的惰性材料制成,以降低对电极上的电流密度,使其在测量过程中基本不会被极化。
图1 电化学检测系统:(A)电化学工作站和三电极体系;(B)电解池。
2.2. 循环伏安法是电化学分析中最常用的实验技术,也是电化学表征的主要方法。
循环伏安法以快速线型扫描的形式在电极上施加等腰三角形脉冲电压:电压从某设定起始电位E i开始,沿某一方向变化,当扫描至某设定终点电位E f后,再反向扫描回归至起始电位E i;若E i > E f,则在正向扫描过程中电极电位越来越
负,当电位足够负时具有氧化还原活性的分子在电极表面发生还原,产生还原峰;而在逆向扫描过程中,还原产物又会重新在电极表面氧化,产生氧化峰。
在一定的电解质溶液组成和实验条件下,氧化还原峰电流与氧化还原组分的浓度成正比,可利用其进行定量分析。
同时,根据所得到的循环伏安图中氧化峰和还原峰的对称性中还可以判断出电活性物质在电极表面反应的可逆程度;根据峰电流值与扫描速度的关系可以确认电活性物质在电极表面的电化学过程类型(扩散控制或吸附控制)。
2.3. 氯化血红素(hemin,其分子式如图2所示)是铁卟啉一类配合物的总称,是高等动物血液、肌肉中的红色色素,在体内起运载和贮存O2的作用,在呼吸链中发挥电子传递的功能。
近年来氯化血红素作为一种生物铁被广泛应用在食品、医药以及生化制剂等多方面。
例如,氯化血红素作为缺铁性贫血的天然补品及药物原料, 能被人体很好的吸收且无毒副作用,因而具有良好的药用前景。
由于氯化血红素在一定的条件下能够在电极表面发生氧化还原反应,因而可以使用循环伏安扫描的方法对氯化血红素进行定量测定。
氯化血红素在电极表面的氧化还原机理如下:
Hemin-Fe(III) + H+ + e¯⇌Hemin-H-Fe(II)
图2 氯化血红素分子式
三、仪器与试剂
3.1. 仪器
(1)CHI电化学工作站
(2)超声波清洗器
(3)三电极体系:热解石墨电极(工作电极)、饱和甘汞电极(参比电极)、铂电极(对电极)
(4)容量瓶、量筒、烧杯等
3.2. 试剂
(1)氯化血红素
(2)氢氧化钠
(3)磷酸氢二钾
(4)磷酸二氢钾
(5)粒度为1.0微米的氧化铝粉末
(6)无水乙醇
四、实验步骤
4.1. 电极预处理
一个全新的电极,电极的表面是粗糙的,不光滑的,并且还有许多杂质附着在上面。
而电化学实验的灵敏度极高,任何杂质的存在都会影响实验结果,所以在实验前必须对电极表面进行处理。
热解石墨电极按如下顺序进行预处理:
(1)依次在3000#和5000#金相砂纸上打磨;
(2)在丝绸上用粒度为1.0微米的氧化铝粉末抛光成镜面;
(3)反复冲洗后置于乙醇、纯水中分别超声3分钟。
预处理完成后,将电极置于铁氰化钾溶液中进行循环伏安扫描,以确认电极打磨效果。
具体实验参数为:扫描范围0.05 ~ 0.4 V;扫描速率100 mV/s,扫描段数2,灵敏度1e-4。
若扫描得到的循环伏安图谱中峰间距小于0.13 V,则证明电极已打磨干净。
4.2. 氯化血红素的定量测定
(1)取6 mL 0.1 mol·L-1的磷酸盐(PBS)缓冲液置于小烧杯中作为电化学测定的电解质溶液(注意:每次电化学测定前应向电解质溶液中通10分钟以上高纯氮气,以除去氧气;在实验过程中需将氮气管保留在电解液上部5 cm处,维持氮气气氛)。
(2)依次准确移取0.1 mL的氯化血红素标准品到电解质溶液中;每移取一次溶液后,搅拌溶液使混合均匀,随后使用CHI电化学工作站进行循环伏安扫描。
具体实验参数为:扫描范围-1.0 ~ 0.2 V;扫描速率100 mV/s,扫描段数2,
灵敏度1e-4。
每次扫描结束得出相应的循环伏安曲线后,以合适文件名保存测试结果,并列表记录各浓度下的还原峰电流和峰电位。
表1 标准氯化血红素溶液的氧化峰电流
4.3. 循环伏安扫描速度和稳定性研究
(1)在步骤4.2实验结束后的溶液中,改变扫描速度(建议依次取40, 80, 100, 120,160, 200 mV/s),进行循环伏安测定。
以合适文件名保存测试结果,列表记录各扫速下的还原峰电流和峰电位。
(2)在步骤 4.3(1)实验结束后的溶液中,改变扫描半圈数(建议取30半圈),进行循环伏安测定。
以合适文件名保存测试结果。
五、实验数据处理
鼓励采用计算机处理数据。
建议使用Excel或Origin软件绘图。
5.1. 以所得到的某个典型循环伏安图为例,指出在什么电位区间内发生还原反应,什么电位区间发生氧化反应,写出有关半反应方程式,并标注氧化峰和还原峰。
5.2. 以氯化血红素定量测定实验中得到的循环伏安图还原峰电流值为纵坐标,氯化血红素浓度为横坐标,作图求出线性回归方程和线性相关系数。
5.3. 以扫描速度研究中得到的循环伏安图还原峰电流值为纵坐标,扫速或其平方根为横坐标,作图求出线性回归方程和线性相关系数,探讨氯化血红素在电极表面的电化学过程类型。
六、问题与讨论
1. 实验中氯化血红素在电极表面发生的氧化还原反应是否可逆?依据是什么?
2. 每次电化学测定前为何要向电解质溶液中通高纯氮气?若未进行该步骤,循环伏安测定结果会有什么变化?
3. 本实验对于氯化血红素定量测定可能误差来源主要有哪些?
附录: 电化学工作站的使用和设置
4.2.1.打开计算机,在指定文件夹“CV实验”中,建立两级子文件夹。
建议以日期、姓
名或学号来命名,如“D:\CV实验\20060323\爱因斯坦\”。
4.2.2.打开CHI电化学工作站。
4.2.3.打开CHI软件,鼠标点击运行Setup中的Hardware Test(如图2),检查仪器状态
是否正常。
约1分钟内弹出硬件测试结果。
仪器正常时,所有的数值均接近于零但不全等于零,并显示OK。
如显示failed,说明仪器有问题。
4.2.4.运行Setup/Techniques,选择Cyclic Voltammetry。
运行Setup/Parameters,弹出
Cyclic Voltammetry Parameters窗口,参考如下窗口输入有关参数(图3):
图2. CHI电化学工作站硬件测试.
图3. CV参数输入.。
