2015电化学习题答案
2015年浙江高考化学电化学部分专项复习有答案

2015年浙江高考化学电化学部分专项复习 有答案【10-1专练】(2013年绍兴市高三教学质量调测)航天器中常使用可充电电池,构造示意图如右图(氢化物电极为储氢金属,可看做H2直接参加反应)。
白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电。
下列说法正确的是( )A .在使用过程中此电池要不断补充水B .放电时NiOOH 在电极上发生氧化反应C .充电时阴极区电解质溶液pH 升高D .充电时阴极反应为Ni(OH)2-e -+OH -= NiOOH+H 2O【10-2专练】(新梦想-新教育-新阵地-联谊学校联考)加碘食盐中含有碘酸钾(KIO 3),现以电解法制备碘酸钾,实验装置如图所示。
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I 2+6KOH=5KI+KIO 3+3H 2O ,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。
下列说法正确的是( )A .a 极区的KI 将转化为KIO 3B .电解过程中OH -从a 极区通过离子交换膜c 进入b 极区C .b 极的电极反应式为:2H 2O-4e -= O 2↑+4H+ D .理论上电解生成1molKIO 3,转移的电子数为5N A【10-3专练】(2013年浙江理综样卷)设计如下装置探究HCl 溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd 的金属活动性大于Cu )。
恒温下,在垂直的玻璃细管内,先放CdCl 2溶液及显色剂,然后小心放入HCl 溶液,在aa’处形成清晰的界面。
通电后,可观察到清晰界面缓缓向上移动。
下列说法不正确的是( )A .通电时,H +、Cd 2+向Pt 电极迁移,Cl -向Cd 电极迁移B .装置中总反应的化学方程式为:Cd + 2HCl 通电CdCl 2 + H 2↑C .一定时间内,如果通过HCl 溶液某一界面的总电量为5.0 C ,测得H +所迁移的电量为4.1 C ,说明该HCl 溶液中H +的迁移速率约是Cl -的4.6倍D .若电源正负极反接,则下端产生大量Cl 2,使界面不再清晰,实验失败【10-4专练】(浙江建人高复2012学年高三年级第五次月考)瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。
2015电化学专题(答案)

2015电化学专题 (2015新课标2)二氧化氯(ClO 2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:(1)工业上可用KC1O 3与Na 2SO 3在H 2SO 4存在下制得ClO 2,该反应氧化剂与还原剂物质的量之比为(2)实验室用NH 4Cl 、盐酸、NaClO 2(亚氯酸钠)为原料,通过以下过程制备ClO 2:【答案】(3)①2ClO 2+10I -+8H +=2Cl -+5I 2+4H 2O ②吸收残余的二氧化氯气体(避免碘的逸出)③淀粉溶液;溶液由蓝色变为无色,且半分钟内溶液颜色不再改变 ④0.02700 (4)d解:(1)KClO 3在H 2SO 4存在下与Na 2SO 3反应制得ClO 2,可知SO 32-被氧化成SO 42-,由电子、电荷守恒可知该离子反应为2ClO 3-+SO 32-+2H +═2ClO 2+SO 42-+H 2O ,氧化剂为KClO 3,还原剂为Na 2SO 3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,故答案为:2:1;(2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl 3,电解方程式为NH 4Cl+2HCl=NCl 3+3H 2↑,故答案为:NH 4Cl+2HCl=NCl 3+3H 2↑;②在NCl 3溶液中加入NaClO 2,可生成ClO 2、NH 3和X ,溶液X 中大量存在的阴离子有Cl -、OH -,故答案为:Cl -、OH -;③a .ClO 2易溶于水,不能利用饱和食盐水吸收氨气,故错误;b .碱石灰不能吸收氨气,故错误;c .浓硫酸可以吸收氨气,且不影响ClO 2,故正确;d .ClO 2易溶于水,不能利用水吸收氨,故错误;故答案为:c ;(3)①由题目信息可知,ClO 2通入锥形瓶与酸性碘化钾溶液反应,氧化I -为I 2,自身被还原为Cl -,同时生成水,反应离子方程式为2ClO 2+10I -+8H +═2Cl -+5I 2+4H 2O ,故答案为:2ClO 2+10I -+8H +═2Cl -+5I 2+4H 2O ;②玻璃液封装置的作用是吸收残留的ClO 2气体(避免碘的逸出),故答案为:吸收残留的ClO 2气体(避免碘③V 中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,故答案为:淀粉溶液;溶液由蓝色变为无色,且半分钟内不变色;④含有Na 2S 2O 3物质的量为0.02 L×0.1mol/L=0.002 mol ,则:根据关系式:2ClO 2~5I 2~10Na 2S 2O 3,2 10n (ClO 2) 0.002mol所以n (ClO 2)=0.0004mol ,所以m (ClO 2)=0.004 mol×67.5g/mol=0.02700g ,故答案为:0.02700;(4)若要除去超标的亚氯酸盐,ac 均不能还原亚氯酸盐,b 中KI 具有还原性但氧化产物不适合饮用水使用,只有d 中Fe 2+将ClO 2-还原成Cl -,Fe 2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d ,故答案为:d .(2014新课标2)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( C )A .a 为电池的正极B .电池充电反应为LiMn 2O 4=Li 1-x Mn 2O 4+xLiC .放电时,a 极锂的化合价发生变化D .放电时,溶液中Li +从b 向a 迁移【解析】根据题给装置图判断,电极b 是原电池的负极,电极反应式为Li-e - =Li +,电极a 是原电池的正极,电极反应为LiMn 2O 4 +xLi +xe - =Li 1-x Mn 2O 4。
电化学原理试题及答案

电化学原理试题及答案一、选择题(每题2分,共20分)1. 下列关于电化学的说法,错误的是()A. 电化学反应中有电子的转移B. 电化学反应分为氧化反应和还原反应C. 电化学反应不需要外界提供能量D. 电化学反应中,电极上发生的是氧化还原反应答案:C2. 下列哪个不是电解质()A. NaClB. H2SO4C. C6H12O6(葡萄糖)D. KOH答案:C3. 下列关于原电池的说法,错误的是()A. 原电池是一种将化学能转化为电能的装置B. 原电池的两极分别是阳极和阴极C. 原电池中,阳极发生氧化反应,阴极发生还原反应D. 原电池工作时,电子从阳极流向阴极答案:B4. 下列关于电解池的说法,错误的是()A. 电解池是一种将电能转化为化学能的装置B. 电解池的两极分别是阴极和阳极C. 电解池中,阴极发生还原反应,阳极发生氧化反应D. 电解池工作时,电子从阴极流向阳极答案:D5. 下列关于电极电位的说法,错误的是()A. 电极电位是电极与溶液之间电位差的绝对值B. 标准电极电位是指电极在标准状态下的电极电位C. 电池的电动势等于正极电极电位减去负极电极电位D. 电极电位的大小反映了电极得失电子的能力答案:A二、填空题(每题3分,共30分)6. 在原电池中,负极发生______反应,正极发生______反应。
答案:氧化、还原7. 电解质溶液导电的主要载体是______和______。
答案:阳离子、阴离子8. 在电解过程中,阴极附近溶液的______浓度逐渐增大,阳极附近溶液的______浓度逐渐增大。
答案:阳离子、阴离子9. 电池的电动势等于______电极电位减去______电极电位。
答案:正极、负极10. 下列反应在酸性溶液中,氧化剂是______,还原剂是______。
MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O答案:MnO4-、Fe2+11. 在下列反应中,氧化产物是______,还原产物是______。
2015-2021高考电化学真题(原电池、电解池、燃料电池)
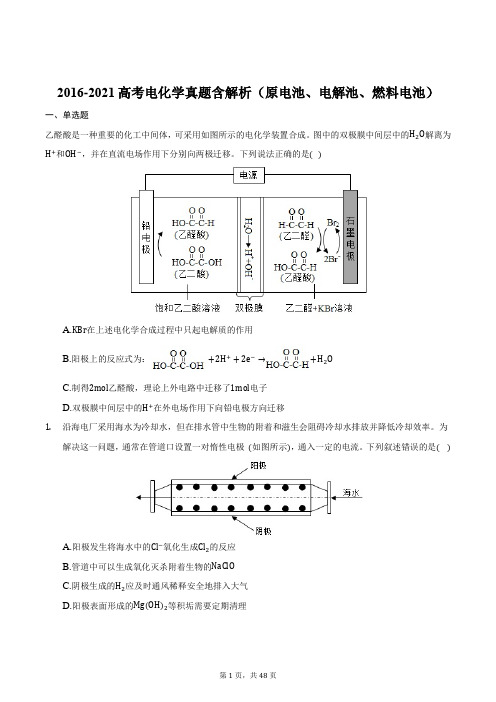
2016-2021高考电化学真题含解析(原电池、电解池、燃料电池)一、单选题乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。
图中的双极膜中间层中的H2O解离为H+和OH−,并在直流电场作用下分别向两极迁移。
下列说法正确的是( )A.KBr在上述电化学合成过程中只起电解质的作用B.阳极上的反应式为:+2H++2e−→+H2OC.制得2mol乙醛酸,理论上外电路中迁移了1mol电子D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移1.沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。
为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是( )A.阳极发生将海水中的Cl−氧化生成Cl2的反应B.管道中可以生成氧化灭杀附着生物的NaClOC.阴极生成的H2应及时通风稀释安全地排入大气D.阳极表面形成的Mg(OH)2等积垢需要定期清理2.如图所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )A.a是电源的负极B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色C.随着电解的进行,CuCl2溶液浓度变大D.当0.01molFe2O3完全溶解时,至少产生气体336mL(折合成标准状况下)3.某全固态薄膜理离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。
下列说法不正确的是()A.充电时,集流体A与外接电源的负极相连B.放电时,外电路通过amol电子时,LiPON薄膜电解质损失C.放电时,电极B为正极,反应可表示为Li1−x CoO2+xLi++xe−=LiCoO2D.电池总反应可表示为Li x Si+Li1−x CoO2Si+LiCoO24.镍镉电池是二次电池,其工作原理示意图如图(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。
2015高考化学考试试题分类汇编-电化学基础

高考化学试题分类汇编电化学基础1.(北京高考8)结合下图判断,下列叙述正确的是A.Ⅰ和Ⅱ中正极均被保护B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+C. Ⅰ和Ⅱ中正极均被消耗D. Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀2.(福建高考11)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。
该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。
关于该电池的下列说法不正确...的是A.水既是氧化剂又是溶剂B.放电时正极上有氢气生成C.放电时OH-向正极移动D.总反应为:2Li+2H2O=== 2LiOH+H2↑3.(广东高考12)某小组为研究电化学原理,设计如图2装置。
下列叙述不正确...的是A、a和b不连接时,铁片上会有金属铜析出B、a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= CuC、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色D、a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动4.(山东高考15)以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系C.电镀时保持电流恒定,升高温度不改变电解反应速率D.镀锌层破损后对铁制品失去保护作用5.(新课标全国)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确...的是A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为FeB. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2C. 电池充电过程中,阴极附近溶液的pH降低D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O6.(海南)一种充电电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-当为电池充电时,与外电源正极连接的电极上发生的反应是A. H2O的还原B. NiO(OH)的还原C. H2的氧化D. NiO(OH) 2的氧化7(海南)根据下图,下列判断中正确的是A.烧杯a中的溶液pH升高B.烧杯b中发生氧化反应C.烧杯a中发生的反应为2H++2e-=H2D.烧杯b中发生的反应为2Cl--2e-=Cl28.(全国I卷10)用石墨做电极电解CuSO4溶液。
高考化学电化学基本原理—三年高考(2015-2017)化学真题分项版解析(解析版)

1.【2017新课标1卷】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。
下列有关表述不正确的是A.通入保护电流使钢管桩表面腐蚀电流接近于零B.通电后外电路电子被强制从高硅铸铁流向钢管桩C.高硅铸铁的作用是作为损耗阳极材料和传递电流D.通入的保护电流应该根据环境条件变化进行调整【答案】C【名师点睛】该题难度较大,明确电化学原理是以及金属的防腐蚀原理是解答的关键,钢管桩表面腐蚀电流的理解是难点,注意题干信息的挖掘,即高硅铸铁为惰性辅助阳极,性质不活泼,不会被损耗。
2.【2017新课标2卷】用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为混合溶液。
下列叙述错误的是A.待加工铝质工件为阳极B.可选用不锈钢网作为阴极C.阴极的电极反应式为:D.硫酸根离子在电解过程中向阳极移动【答案】C【解析】A、根据原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,故A 说法正确;B、不锈钢网接触面积大,能增加电解效率,故B说法正确;C、阴极应为阳离子得电子,根据离子放电顺序应是H+放电,即2H++2e−=H2↑,故C说法错误;D、根据电解原理,电解时,阴离子移向阳极,故D说法正确。
【名师点睛】本题考查电解原理的应用,如本题得到致密的氧化铝,说明铝作阳极,因此电极方程式应是2Al−6e−+3H2O=Al2O3+6H+,这就要求学生不能照搬课本知识,注意题干信息的挖掘,本题难度不大。
3.【2017新课标3卷】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+x S8=8Li2S x(2≤x≤8)。
下列说法错误的是A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提高电极a的导电性D.电池充电时间越长,电池中Li2S2的量越多【答案】D【名师点睛】考查二次电池的使用,涉及原电池工作原理,原电池工作时负极发生氧化反应,正极发生还原反应,而电池充电时,原来的负极连接电源的负极为电解池的阴极,发生还原反应,而原来的正极连接电源的正极为电解池的阳极发生氧化反应,解题是通过结合反应原理,根据元素化合价的变化,判断放电时正负极发生的反应,再结合电解质书写电极反应方程式。
2015版高考化学近三年真题-模拟考点分类汇编:专题十一-电化学

专题十一电化学高考试题考点一原电池原理及其应用1.(2013年新课标全国理综Ⅱ,11,6分)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误的是( )A.电池反应中有NaCl生成B.电池的总反应是金属钠还原三价铝离子C.正极反应为:NiCl 2+2e-Ni+2Cl-D.钠离子通过钠离子导体在两电极间移动解析:由该电池的正、负极材料可知,电池反应式为NiCl 2+2Na Ni+2NaCl,因此A正确,B错误;正极为NiCl2,电极反应式为NiCl 2+2e-Ni+2Cl-,C正确;电池工作时,Na+通过钠离子导体由负极移向正极,D正确。
答案:B2. (2013年安徽理综,10,6分)热激活电池可用作火箭、导弹的工作电源。
一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl—KCl混合物受热熔融后,电池即可瞬间输出电能。
该电池总反应为:PbSO 4+2LiCl+Ca CaCl2+Li2SO4+Pb。
下列有关说法正确的是( )A.正极反应式:Ca+2Cl-- 2e-CaCl 2B.放电过程中,Li+向负极移动C.每转移0.1 mol电子,理论上生成20.7 gPbD.常温时,在正负极间接上电流表或检流计,指针不偏转解析:正极上应是PbSO4发生还原反应,生成Pb,A项错误;放电过程中Li+向正极移动,B项错误;由电池总反应式可知,每转移0.1 mol电子,理论上生成0.05 mol Pb,质量为10.35 g,C项错误;常温下,电解质不是熔融态,离子不能自由移动,不能导电,因此连接电流表或检流计,指针不偏转,D项正确。
答案:D3.(2013年江苏化学,1,2分)燃料电池能有效提高能源利用率,具有广泛的应用前景。
下列物质均可用作燃料电池的燃料,其中最环保的是( )A.甲醇B.天然气C.液化石油气D.氢气解析:氢气作为燃料,反应产物只生成水,对环境无任何污染及影响,故D项最环保。
电化学(2012-2015)带答案.(DOC)

1.(2015新课标Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是 A.正极反应中有CO 2生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为C 6H 12O 6+6O 2=6CO 2+6H 2O 1A2.(2015四川)用右图所示装置除去含CN -、Cl -废水中的CN -时,控制溶液pH 为9~10,阳极产生的ClO -将CN-氧化为两种无污染的气体,下列说法不正确...的是 A .用石墨作阳极,铁作阴极B .阳极的电极反应式为:Cl -+ 2OH --2e -= ClO -+ H 2OC .阴极的电极反应式为:2H 2O + 2e -= H 2↑ + 2OH -D .除去CN -的反应:2CN -+ 5ClO -+ 2H + = N 2↑ + 2CO 2↑ + 5Cl -+ H 2O2D3.(2015天津)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c (SO 42-)减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 3C4.(2015福建)某模拟“人工树叶”电化学实验装置如右图所示,该装置能将H 2O 和CO 2转化为O 2和燃料(C 3H 8O )。
下列说法正确的是 A .该装置将化学能转化为光能和电能 B .该装置工作时,H +从b 极区向a 极区迁移 C .每生成1 mol O 2,有44 g CO 2被还原D .a 电极的反应为:3C O 2 + 16H +-18e -= C 3H 8O+4H 2O 4B5.(2015浙江)在固态金属氧化物电解池中,高温共电解H 2O —CO 2 混合气体制备H 2和CO 是一种新的能源利用方式, 基本原理如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7、当把金属铅插入下列四组溶液中,有可能置 换出金属锡的是: ( )
( A)Sn2+ 1.0,Pb2+ 0.1 ( A)Sn2+ 0.1,Pb2+ 1.0
(B)Sn2+ 1.0,Pb2+ 1.0
(
A) Sn
2+
0.5,Pb2+
0.5
11
8、盐桥的作用是:( ) (A)将液接电势完全消除 (B)将不可逆电池变成可逆电池 (C)使液接电势降低到可以忽略不计 (D)相当于用一根导线将两个电解质溶液沟通
(2) 计算Hg2Cl2(s)的 f Gm , 已知 f Gm [Cl – (aq)] = - 131.26 kJ·m
(3) 计算Hg2Cl2(s)的Ksp,已知 f Gm [Hg22+(aq)] = 152.0 kJ·mol-1。
13
10、 已知反应Ag(s)+0.5Hg2Cl2(s)→AgCl(s)+Hg(l), 在298 K时,有如下数据:
5、298 K时,某电池E = 1.00 V,
E (T ) p
4.0 104
V K1
此电池可逆提供1F电量时的热效应为: ( )
(A) - 96 500 J
(B) 96 500 J
(C) - 84 997 J
(D) 11 503 J
10
6、 金属与溶液间电势差的大小和符号主要取决于 : ( ) (A) 金属的表面性质 (B) 溶液中金属离子的浓度 (C) 金属与溶液的接触面积 (D) 金属的本性和溶液中原有的金属离子浓度
(H+,H2)- (PbCl2,Pb)-RT/2F×ln[a(H2)/a2 (H+) a2(Cl-
设计电池: Pb(s)│Pb2+(a=1)‖Cl-(a=1)│PbCl2(s)│Pb(s) 电池反应为: PbCl2(s) ─→Pb2+ + 2Cl-
E = (PbCl2,Pb) - (Pb2+,Pb) = RT/zF×lnKsp
物质
Ag(s)
fHm$/ kJ·mol-1 0
Sm$/J·K-1·mol-1 42.55
Hg2Cl2(s) -264.93 195.8
AgCl(s) -127.03 96.2
Hg(l) 77.4
(1) (2)
将反应设计成电池并写出电极反应;
计算298 K时的电动势E和温度系数 (
E T
)
p
(3) 计算可逆热效应QR与恒压反应热Qp二者之差值。
7
14、 291K ,CaF2饱和溶液的电导率 k 纯水之电导率k = 1.5×10-4 S·m-1。设
= 38.6×10-4 S·m-1,
291 K 下m (NaCl),
m (NaF), m ( 12 CaCl2), 分别为 108.9×10-4,90.2×10-4 和
116.7×10-4 S·m2·mol-1,试判断: 2×10-4 mol·dm-3的 NaF
7、 超电势测量采用的是三电极体系, 即研究电极、辅助电极和
参比电极, 其中辅助电极的作用是_________________, 参比电极的作用是________________。(了解)
8、以石墨为阳极,电解 0.01 mol·kg-1 NaCl 溶液,在阳极上
首先析出: ( )
(A) Cl2 (B) O2 (C) Cl2与 O2混合气体 (D) 无气体析出
已知 298 K 时 ,PbCl2(s) 在水中饱和溶液的浓度为 0.039 mol·kg-1,
(Pb2+,Pb) = -0.126 V。 设活度系数均等于 1。
[答]
E=
)]
电池反应:Pb(s) + 2H+(a+= 0.1) + 2Cl-(a-= 0.1) → PbCl2(s) + H2(a(H2) = 0.1)
电化学—电解质溶液
1、法拉第电解定律限用于:( ) (A)液态电解质 (B)无机液态或固态电解质 (C)所有液态或固态电解质 (D)所有液态、固态导电物质
2、按物质导电方式的不同而提出的第二类导体, 下述对它特点的描述,哪一点是不正确的?( ) (A)其电阻随温度的升高而增大 (B)其电阻随温度的升高而减小 (C)其导电的原因是离子的存在 (D)当电流通过时在电极上有化学反应发生
= -0.1071 V
(PbCl2,Pb)= E + (Pb2+,Pb) = -0.2331 V
则: E = 0.1445 V
19
电化学—不可逆电极过程
1、 电池 Pb(s)│H2SO4(m)│PbO2(s),
作为原电池时,负极是
,正极是
;
作为电解池时,阳极是
,阴极是
。
2、计算 298 K 时,已知: (Br2/Br-) = 1.065 V,电解池 Pt│HBr (0.05mol·kg-1, = 0.860)│Pt 的可逆分解电压。
14
11、已知下列电池的电动势在298 K时分别为E1=0.9370 V,E2=0.9266 V。
⑴ Fe(s)|FeO(s)|Ba(OH)2 (0.05 mol·kg-1)|HgO(s)|Hg(l)
⑵试求PtF,HeO2((ps$))的|Ba(Of GHm)2
(0.05 mol·kg-1)|HgO(s)|Hg(l)
(1) 写出电池反应 (2) 计算 298 K 时上述电池可逆输出 2F 电量时,电池反应的
rGm、rSm、rHm、rUm、rFm 以及该电池的热效应; (3) 若将该电池短路,上述各值为多少? (4) 若该电池以 0.8 V 工作电压放电,上述各值又为多少?
18
16、 计算 298 K 时下述电池的电动势 E . Pb(s)│PbCl2(s)│HCl(0.1 mol·kg-1)│H2(0.1p )(Pt)
3
7、电解质溶液中离子迁移数 (ti) 与离子淌度 (Ui) 成正比。 当温度与溶液浓度一定时,离子淌度是一定的,则 25℃ 时,0.1 mol·dm-3 NaOH 中 Na+的迁移数 t1 与 0.1mol·dm-3 NaCl 溶液中 Na+ 的迁移数 t2, 两者之间的关系为 ( ) (A)相等 (B) t1> t2 (C) t1< t2 (D) 大小无法比较
fHm$(Ag2O,s)= - 30.57 kJ·mol-1。试求:
(1) 电池的电动势, 已知Kw=1.0×10-14; (2) 电池反应的rGm$,rHm$,rSm$,Qr和
(
Байду номын сангаас T
)
p
(3) 若电池在短路下放电,程度与可逆反应相同时,求热效应为多少。
17
15、 电池 Zn│ZnCl2(0.05 mol·kg-1)│AgCl(s)│Ag(s) 的电动势 与温度的关系为: E / V = 1.015 - 4.92×10-4(T/K - 298)
9
4、往电池Pt,H2(101.325 kPa)|HCl(1 mol·kg-1)|| CuSO4(0.01 mol·kg-1)|Cu 的右边分别加入下面四种 溶液,其中能使电动势增大的是: ( )
(A) 0.1 mol·kg-1 CuSO4 (B) 0.1 mol·kg-1 Na2SO4 (C)0.01 mol·kg-1 Na2S (D)0.1 mol·kg-1 NH3·H2O
已知 f Gm (AgCl)= - 1.2703×105 J·mol-1,Ag(s),AgCl(s)和
Cl2(g)的规定熵值 分别为:42.70,96.11和243.87 J·K-1·mol-1。
16
13、298K时有电池:Pt,H2(p$)|KOH(a=1),Ag2O(s)|Ag(s),
已知E$(Ag2O|Ag)=0.344 V, fHm$(H2O,l)= - 286.0 kJ·mol-1,
20
3、 电解HNO3, H2SO4, NaOH, NH3·H2O, 其理论 分解电压均为1.23 V。其原因是 _________________。
4、从理论上分析电解时的分解电压, E分解=__________________________, 而且随电流强度I的增加而_____________。
C
14、 在恒温、恒压下,金属 Cd 与盐酸的反应为放热
反应,其反应热效应绝对值为 Q1,若在相同 T,p 条件下, 将上述反应组成可逆电池,亦为放热,热效应绝对值为
Q2,若两者始终态相同,则 Q1与 Q2 的大小关系是 ___ ______ 。
Q1> Q2
12
9、 298 K时,下述电池的电动势E$= 0.268V: Pt,H2(g)|HCl(aq)|Hg2Cl2(s)|Hg(l) (1) 写出电极反应和电池反应;
6
13、在 298 K 时,浓度为 0.0 1mol·dm-3的 HAc 溶液在 某电导池中测得电阻为 2220 。已知该电导池常数为 Kcell=36.7 m-1,试求该条件下 HAc 的离解度和离解平衡 常数Ka。已知H+ 和Ac – 在无限稀释时的离子摩尔电导率 分别为349.82×10-4 S·m2·mol-1和40.9×10-4 S·m2·mol-1)。
1
3、描述电极上通过的电量与已发生电极反应的物质
的量之间的关系的是:( )
(A) 欧姆定律
(B)离子独立运动定律
(C) 法拉第定律 (D)能斯特定律
4、试完成下列原电池与电解池电极名称比较
项目
原电池
电解池
能量转换
阳极
阴极
正极
负极
电极名称
相互关系
2
