碱金属元素课件
合集下载
碱金属元素PPT下载10 人教版

❖
5.所有进入现场使用的成品、半成品 、设备 、材料 、器具 ,均主 动向监 理工程 师提交 产品合 格证或 质保书 ,应按 规定使 用前需 进行物 理化学 试验检 测的材 料,主 动递交 检测结 果报告 ,使所 使用的 材料、 设备不 给工程 造成浪 费。
❖
谢谢观看
❖
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
❖
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
2、与H2O的反应
锂(Li) ※Li是最轻的金属
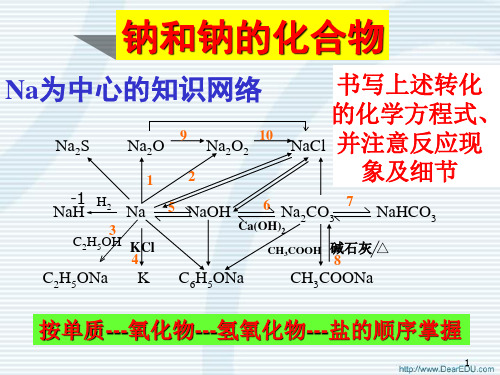
钠(Na)
钾(k)
铷(Rb)
铯(Cs)
第三节 碱金属元素
元素 名称
元素 符号
核电 荷数
颜色和 状态
密度 g/cm3
熔点 ℃
沸点 ℃
锂 Li
3 银白色 0.534 180.5 1347
柔软
钠
Na
11
随 着
银白色
00..9977 密97.81
882.9
❖
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
❖
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
碱金属元素PPT下载8 通用

金 属
C中要装碱石灰。(2)通过装置B的质量增加n g,计算出
Cu(OH)2的质量为49n/9 g。所以沉淀中CuCO3的质量分数 为(m-49n/9)/m×100%=[1-49n/(9m)]×100%。
首页
上一页
下一页
末页
化学
【答案】 Ⅰ.Na2CO3+CuSO4+H2O===Cu(OH)2+ Na2SO4+CO2↑
有:H2、O2、N2、F2、Cl2。 由④知H中含有钠元素,且D为淡黄色固体,由反应:
A(气态化合物)+D―→H(含Na+的化合物)+C(气态单质)
第 二
推知:A为CO2,D为Na2O2,H为Na2CO3,C为O2。
章
由B(固态单质)+C(O2)―→A(CO2)推知B为碳,进而
碱 推知E为CO。
金
属
钠元素黄色、钾元素紫色[透过蓝色的钴玻璃观察,
以排除黄色光(常混有钠的杂质)的干扰],焰色反应属物理
变化。与元素存在状态(单质、化合物)、物质的聚集状态
(气、液、固)等无关,只有少数金属元素有焰色反应。
第 二
(4)应用:碱金属元素及其化合物的综合推断中的突破
章 点。
碱 金 属
首页
上一页
下一页
末页
化学
Ⅱ.(1)A→C→B (2)无水硫酸铜 (3)装置B中澄清石
灰水变浑浊
Ⅲ.(1)吸收空气中的水蒸气和CO2 将装置中原有的
第 二
含 水 蒸 气 和 CO2 的 空 气 赶 出
将装置中滞留的水蒸气和
章 CO2赶出
碱
(2)[1-49n/(9m)]×100%
金
属
首页
上一页
下一页
末页
碱金属元素PPT课件

2020年10月2日
11
三 物理性质
元素 元素 核电 颜色和状态 名称 符号 荷数
锂 Li 3 银白色,柔软
密度 熔点℃ 沸点℃
g/cm
3
0.534 180.5 1347
钠 Na 11 银白色,柔软 0.97 97.81 882.9
钾 K 19 银白色,柔软 0.86 63.65 774
铷 Rb 37 银白色,柔软 1.532 38.89 688
2020年10月2日
7
回忆: 钠与溶液反应的顺序?
先酸 后水 再盐 钾与溶液反应的顺序与钠是相似的 也是 先酸 后水 再盐
2020年10月2日
8
二 碱金属的化学性质
1.与非金属反应
碱金属的化学性质十分活泼,在空气中燃烧生成不同的产物
点燃
4Li + O2 = 2Li2O
注意:锂与其它碱金属不同,与氧气反应只生成氧化锂。
2020年10月2日
4
思考:
元素的性质和什么有关
和元素原子的最外层电子的数目有密切关系。 推论一:看书37页。
2020年10月2日
5
推论二:
核电荷数增加
原子的电子层数增加
原子半径增大
原子核对最外层电子的引力减弱
还原性增强
失去电子是什么性质? 最外层电子容易失去
2020年10月2日
6
请大家仔细观察实验现象!
钠(Na)
+19 2 8 8 1
+37 2 8 18 8 1
钾(K)
铷(Rb)
+55 2 8 18 18 8 1 铯(Cs)
请大家比较他们的异同?
相同点: 最外层都只有一个电子。
八年级物理《碱金属》ppt课件

与酸反应实验
分别取少量碱金属单质,加入盛有稀酸的试管中,观察并 记录反应现象。
火焰颜色实验
用铂丝蘸取少量碱金属化合物,在无色火焰上灼烧,观察 并记录火焰颜色。
3. 安全注意事项
由于碱金属元素性质活泼,与水或酸反应时可能产生剧烈 现象,因此实验过程中需佩戴防护眼镜和手套,确保操作 安全。
数据记录与结果分析
配合物及其性质
配合物的形成
碱金属离子可以与某些阴离子或分子形成配合物。例如,钠离子可以与氯离子 形成氯化钠配合物(Na[Cl])。
配合物的性质
配合物通常具有与简单离子不同的物理和化学性质。例如,配合物的颜色、溶 解度和稳定性等可能与相应的简单离子有所不同。此外,配合物在化学反应中 可能表现出特殊的反应活性。
盐类化合物
碳酸盐
碱金属的碳酸盐易溶于水,且 稳定性随金属活泼性增强而降 低。例如,碳酸钠(Na2CO3) 和碳酸钾(K2CO3)是常见的 碱金属碳酸盐。
硫酸盐
碱金属的硫酸盐多数易溶于水, 且具有较高的稳定性。例如, 硫酸钠(Na2SO4)和硫酸钾 (K2SO4)在农业和工业上有 广泛应用。
硝酸盐
碱金属的硝酸盐易溶于水,且 多数具有氧化性。例如,硝酸 钾(KNO3)是一种常用的氧化 剂。
由于碱金属单质都是强还原剂,很容易与空气中的氧 气等反应,故一般应密封保存;
在运输过程中要防止撞击和摩擦,避免与易燃易爆物 品混装。
03
碱金属化合物性质
氧化物和氢氧化物
氧化物
碱金属氧化物具有碱性,能与酸反应生成盐和水。例如,钾的氧化 物(K2O)可以与水反应生成氢氧化钾。
氢氧化物
碱金属的氢氧化物都是强碱,易溶于水并放出大量热。例如,氢氧 化钠(NaOH)和氢氧化钾(KOH)是实验室和工业上常用的强碱。
碱金属元素-课件

轻微的爆炸,遇水立即燃烧,遇水立即燃烧,
生成H2
爆炸
爆炸
递变性 反应由剧烈到更剧烈,生成的氧化物由简单到复杂
结论
金属性逐渐增强
化学性质
碱金属原子最外层电子数都为1, 容易失去电子被氧化,具有较 强的还原性。并且,从Li到Cs, 随着核电荷数的逐渐增多,电 子层数逐渐增多,原子半径逐 渐增大,核对外层电子的引力 逐渐减弱,失电子的能力逐渐 增强,金属性逐渐增强。
逐渐增大(钾反常) 逐渐降低
根据碱金属的原子结 构可得以下推论
化碱
学 金 元素性质与与原子最外层电子数目
有密切关系。碱金属元素最外层有
性 属 一个电子,因而具有相似的化学性
质,即强还原性。
质 的 从Li到Cs,随核电荷数的增
加,电子层数增多,原子半
径的增大,它们的原子失去
最外层电子的能力逐渐增强,
•
13、知人者智,自知者明。胜人者有 力,自 胜者强 。2021/3/52021/3/52021/3/52021/3/53/5/2021
•
14、意志坚五2021/3/52021/3/52021/3/5
•
15、最具挑战性的挑战莫过于提升自 我。。2021年3月2021/3/52021/3/52021/3/53/5/2021
•
16、业余生活要有意义,不要越轨。2021/3/52021/3/5Marc h 5, 2021
•
17、一个人即使已登上顶峰,也仍要 自强不 息。2021/3/52021/3/52021/3/52021/3/5
谢谢观赏
You made my day!
我们,还在路上……
锂和钠的性质相似,下列说
法中能较好地解释这一实验
碱金属完整版ppt课件
干燥氢气,防止水分损失.
偏大. 12
思考: 若把钠投入到硫酸铜溶液中,可观察 到有蓝色沉淀生成。 那么钠为什么不能大量置换硫酸铜溶 液中的铜,却产生蓝色沉淀?由此推 测,钠和硫酸铜溶液发生了哪些反应?
13
3、钠与盐溶液反应
把小块金属钠分别投入饱和NaCl溶液、NH4Cl 溶液、CuSO4溶液的烧杯里的现象和反应
• 当过氧化钠遇到还原性物质如:I-、Fe2+、SO2、 SO32-等物质时,表现出氧化性,其还原产物是水 (或碱);当过氧化钠遇到强氧化性的物质如酸 性条件下的高锰酸钾,则过氧化钠体现出还原性, 其氧化产物为氧气。
21
1、过氧化钠的强氧化性
(1) Na2O2与SO3反应: Na2O2+SO3=Na2SO4 (2) Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+, 同时生成Fe(OH)3沉淀 (3) Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液 变浑浊。 (4)Na2O2投入Na2SO3溶液中,可将SO32-氧化成SO42(5) Na2O2投入品红溶液中,因其有氧化性,所以有漂 白性,可使品红溶液褪色.
30
Na2O2和NaHCO3两固体混合物于密闭容器中 加热后残留固体的成分判断
当两种固体加热时,NaHCO3先分解,所产生的H2O和 CO2均能被Na2O2吸收,在此可以看成Na2O2先吸收CO2 生成Na2CO3,而后再吸收H2O生成NaOH。同时注意分 解时的温度,若在100℃以上,H2O是以气态形式存在, 但不管是什么温度,产生的气体中总有O2存在。
SiO2 + 2NaOH === Na2SiO3 + H2O 盛装NaOH的试剂瓶不能用玻璃塞。
36
碱金属元素课件(汇报课)ppt实用资料
2.碱金属和水的反应:
2Li+2H2O==2LiOH+H2
(十分缓慢,因为生成的LiOH微 溶于水,反应慢,且Li不熔化)
【实验2-10】
都易失电子表现强还原性
小结: 碱金属元素的结构和性质
2K + 2H O 2) 与H2O反应越来越剧烈
最外层上都只有一个电子
2
=== 2KOH + 2H2
与O2, S, Cl2等非金属反应越来越剧烈
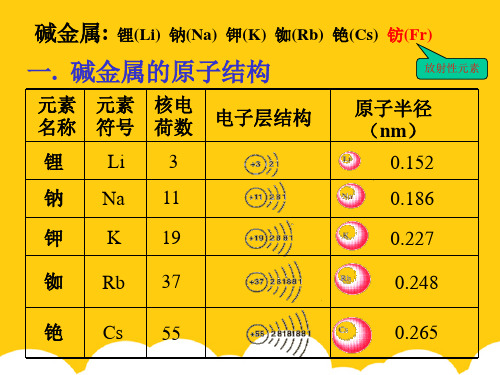
碱金属: 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)
一. 碱金属的原子结构
放射性元素
元素 名称
锂
元素 符号
Li
核电 荷数
3
电子层结构
原子半径 (nm)
0.152
钠 Na 11
0.186
钾 K 19
0.227
铷 Rb 37
0.248
铯 Cs 55
0.265
总结:
碱金属的原子结构 Li Na K碱金属与非金属的反应
点燃
2Li+O2===2Li2O(不如钠剧烈,只生成Li2O)
Na+O2
常温 Na2O
点燃 或加热
Na2O2
【实验2-9】
K、Rb、Cs比Na更剧烈,且Rb、Cs遇空气可自燃, 且可生成R2O、R2O2甚至RO2(超氧化物)等更复杂的化 合物。
小结:从Li到Cs,和O2反应越来越剧烈,还 原性越强,金属性越强。
硬度小,都较柔软,有延展性
银白色有金属光泽(铯略带金色) 碱金属元素的物理性质
失2×e-
2R + 2H2O ===2ROH + H2
小结:从Li到Cs,和H2O反应越来越剧烈, 还原性越强,金属性越强。
碱金属元素课件1.ppt

定
化学性质预测
相似性:易 失去1个电子,表现出 还原 性,类似学过的金属 钠 递变性:金属性 逐渐增强
实验探究
实验时应注意:
实验探究一:
1、获取信息:认真观察,记录实验现象
2、加工信息:联系已有的知识,分析现象,得出结论
3、拓展信息:综合运用所学的知识,巩固和深化知识
[实验1] 碱金属与O2的反应( K与O2反应)
加工信息:2Na+2H2O==2NaOH+H2↑ 2K+2H2O==2KOH+H2↑
拓展信息:12.M碱+金2H属2与O=水=2反M应O可H+以H表2↑示(M为为: 碱金属)
2.从Li到Cs,碱金属与水反应越来越剧烈,
金属性逐渐增强
科学方法小结:
事实分析 (分析原子结构)
进行推论 (预测化学性质)
15、最终你相信什么就能成为什么。因为世界上最可怕的二个词,一个叫执着,一个叫认真,认真的人改变自己,执着的人改变命运。只要在路上,就没有到不了的地方。 16、你若坚持,定会发光,时间是所向披靡的武器,它能集腋成裘,也能聚沙成塔,将人生的不可能都变成可能。 17、人生,就要活得漂亮,走得铿锵。自己不奋斗,终归是摆设。无论你是谁,宁可做拼搏的失败者
推测
相递 似变 :: 似金 金属 属性 钠递
增
探究
实 验
等
二.碱金属的焰色反应 钠元素: 黄色 钾元素:紫色(透过篮色钴玻璃,以便滤掉黄光 的干扰)
随堂练习
1.下列物质与水反应最剧烈的是( D ) A. Li B. Na C. K D. Rb
2.K和Na有相似的化学性质,下列说法中能较好的 解释这个事实的( C )
结论 (推论是正确的)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
核对最外 层电子的 引力
失电子 能力
还原性
金属性
元素金属性: 单质还原性: 阳离子氧化性: 氢氧化物碱性:
Li 》 Na
》
K
》
Rb
》
Cs
Li 《
Li OH
Na 《
+
K《
+
Rb 《 》
》
Cs
Li + 》 Na
》 NaOH
》 K
》
Rb + 》 Cs+
RbOH 》 CsOH
KOH
三、碱金属的化学性质
相似性:碱金属元素最外层都有一个电子,它们的化学性质相似。
1、与O2反应生成相应的氧化物
2、与Cl2反应生成相应的氯化物 3、与H2O反应生成氢气和相应的碱
4、与非氧化性酸反应生成氢气相应的盐
1、碱金属与O2的反应
2Li+O2===2Li2O(不如钠剧烈,只生成Li2O)
常温 Na2O Na2O2 点燃
Na+O2
点燃 或加热
请解释原因 K、Rb、Cs比Na更剧烈,且Rb 、Cs遇空气可自燃,且可生成
第一节 元素周期表
第二课时 元素的性质与原子结构
决定 结构==========性质
碱 金 属
锂(Li)
钠(Na)
钾(K) 铷(Rb) 铯(Cs)
放射性元素
钫(Fr)
最轻的金属
密度小
通常用石蜡密封
通常用煤油保存
通常用煤油保存
某 种 矿 物 中 含 有 金 属 钫 它 具 有 放 射 性
因为目前没有技术获得纯净的钫,但从性质及多种因素分析应该是
2K+2HCl====2KCl+H2
小结: 碱金属元素的结构和性质
结 构
相似性
最外层一个电子
都易失电子,表现强还原性,呈+1价 核对最外 层电子的 引力
递变性
性 质
物理 性质
核电荷数
电子层数
原子半径
失电 子能 力
还原性 金 属 性
表现出相似性和递变性
化学 性质
方法 规律
1)
2)
与O2, S, Cl2等非金属反应越来越剧烈
1) 密度呈减小趋势(K 反常) 2) 熔、沸点逐渐降低
二、碱金属元素的原子结构
锂
两个电子层 最外层有1个电子
钠
三个电子层 最外层有1个电子
钾
四个电子层 最外层有1个电子
铷
五个电子层 最外层有1个电子
铯
六个电子层 最外层有1个电子
钫
七个电子层 最外层有1个电子
碱金属的原子结构
元素名 元素符 核电荷 称 号 数 电子层结构 原子半径(nm)
R2O、R2O2甚至RO2(超氧化物)等更复杂的化合物。
小结:从Li到Cs,还原性逐渐增强,和O2反应越来越剧烈。
2、与S、Cl2的反应
2R + Cl2=== 2RCl
2R + S === R2S
3、碱金属和H2O的反应
2Li+2H2O==2LiOH+H2
(十分缓慢,因为生成的LiOH微溶于水,反应 慢,且Li不熔化)
2K + 2H2O
=== 2KOH + 2H2
(比钠更剧烈)
(反应特点:浮,熔,游,响,红) 铷和铯跟水反应能燃烧,甚至爆炸. 2R + 2H2O ===2ROH + H2
小结:从Li到Cs,还原性逐渐增强,和H2O反应越来越剧烈
4、与非氧化性酸反应生成氢气相应的盐
2Na+2HCl====2NaCl+H2
红色
一、碱金属元素的物理性质
元素 名称 锂 钠 钾 铷 铯 元素符 核电荷 号 数 颜色和状态 密度 g/cm
3
熔点 O C 180.5 97.81 63.65 38.89 28.40
沸点 O C 1347 882.9 774 688 678.4
Li Na K Rb Cs
3 11 19
银白色, 银白色, 银白色, 银白色,
柔软 柔软 柔软 柔软
0.534 0.97 0.86 1.532 1.879
37
55
略带金色光泽,
柔软
总结:
碱金属的主要物理性质
Li
Na
K
Rb
Cs
1) 银白色有金属光泽(铯略带金色) 2) 硬度小,都较柔软,有延展性
1.相似性:
3) 密度小 4) 熔点低(均小于200℃) 5) 导电、导热
2.递变性:
钾在空气中缓慢氧化主要生成氧化钾K2O 方程式:4K+O2=2K2O 钾在氧气中点燃 2K+O2==K2O2(过氧化钾,氧气不太多) K+O2==KO2(超氧化钾,氧气很充足)
点燃 点燃
要求:
•掌握碱金属物理化学性质相似性和递变 性,并能根据原子结构解释其原因
•元素金属性的判断方法
作业
•课本P11-----99(作业本)晚自习之
与H2O反应越来越剧烈
金属性 逐渐增强
规律:
结构
决定 反映
性质
科学方法:(实验验证法) 推导
结构
①
性质
验证
②
实验
金属活动性强弱
金属原子最外层电子数 金属原子半径
最外层电子数越少 原子半径越大 金属性越强
金属性强弱判断方法
•1、单质与水或酸反应的剧烈程度 •2、最高价氧化物对应的水化物-氢氧化物的碱性 •3、金属活动性顺序 •4、阳离子的氧化性强弱
前交
•完成学习指导79-84页习题, 晚自习讲卷子和习题
0.152 0.186
锂 钠 钾 铷 铯
Li
Na K Rb
3 11
19 37 55
0.227
0.248
Cs
0.265
总结:
Li 1.相似性:
碱金属的原子结构
Na K Rb Cs
1) 都易失电子表现强还原性 化学性质相似 2) 化合物中均为+1价 最外层上都只有一 个电子
2.递变性:
核电荷数 电子层数 原子半径
