高三二轮复习专题4金属及其化合物课件
高三化学总复习——金属及其化合物
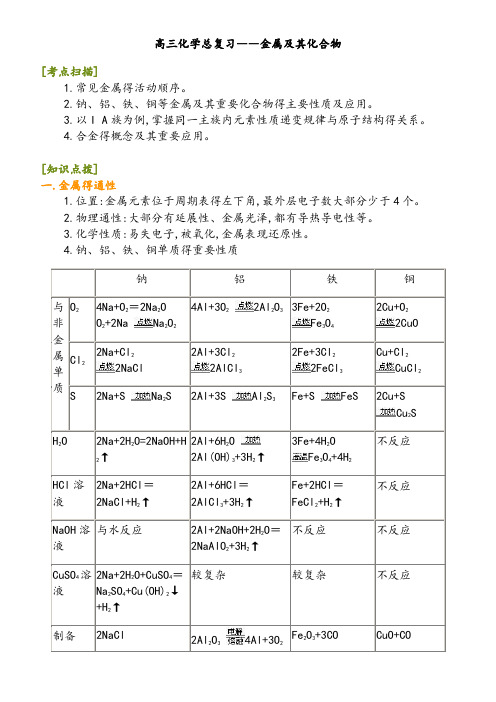
高三化学总复习――金属及其化合物[考点扫描]1.常见金属得活动顺序。
2.钠、铝、铁、铜等金属及其重要化合物得主要性质及应用。
3.以I A族为例,掌握同一主族内元素性质递变规律与原子结构得关系。
4.合金得概念及其重要应用。
[知识点拨]一.金属得通性1.位置:金属元素位于周期表得左下角,最外层电子数大部分少于4个。
2.物理通性:大部分有延展性、金属光泽,都有导热导电性等。
3.化学性质:易失电子,被氧化,金属表现还原性。
4.钠、铝、铁、铜单质得重要性质钠铝铁铜与非金属单质O24Na+O2=2Na2OO2+2Na Na2O24Al+3O22Al2O33Fe+2O2Fe3O42Cu+O22CuO Cl22Na+Cl22NaCl2Al+3Cl22AlCl32Fe+3Cl22FeCl3Cu+Cl2CuCl2 S 2Na+S Na2S 2Al+3S Al2S3Fe+S FeS 2Cu+SCu2SH2O 2Na+2H2O=2NaOH+H2↑2Al+6H2O2Al(OH)3+3H2↑3Fe+4H2OFe3O4+4H2不反应HCl溶液2Na+2HCl=2NaCl+H2↑2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑不反应NaOH溶液与水反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑不反应不反应CuSO4溶液2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑较复杂较复杂不反应制备2NaCl 2Al2O34Al+3O2Fe2O3+3CO CuO+CO2Na+Cl2↑↑2Fe+3CO2Cu+CO2二.钠及其化合物1.钠⑴钠得物理性质状态颜色硬度密度熔点导电、导热性固体银白色较小(比水大)较小(比水小)较低(用酒精灯加热,很快熔化)就是电与热得良导体⑵钠得化学性质①钠与非金属单质得反应A:与氧气:4Na+O2=2Na2O(变暗);O2+2Na Na2O2(燃烧生成淡黄色固体) B:与氯气:2Na+Cl22NaCl;C:与S:2Na+S Na2S②钠与水得反应(水中先滴入酚酞)2Na+2H2O=2NaOH+H2↑现象概述现象描述原因浮浮在水面钠得密度比水小游四处游动钠与水反应产生气体熔融化成银白色小球钠得熔点较低,且该反应放出大量热响发出咝咝得响声钠与水反应剧烈红溶液由无色变为红色生成了碱性物质③钠与酸得反应:2Na+2H+=2Na++H2↑④钠与盐溶液得反应:2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑;6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑⑤Na可与某些有机物反应:2CH3COOH+2Na→2CH3COONa+H2↑;2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;2C6H5OH+2Na→2C6H5ONa+H2↑;⑶钠得保存通常钠保存在煤油中,原因就是①钠极易与空气中得O2、水蒸气反应;②钠不与煤油反应;③钠得密度比煤油大,沉于底部。
新高考化学第二轮专题复习四常见金属及其化合物教师版

常见金属元素(如Na 、Mg 、Al 、Fe 、Cu 等)和非金属元素(如Cl 、N 、S 、Si )。
(1)了解常见金属的活动顺序。
(2)了解常见元素及其重要化合物的主要性质及其应用。
(3)了解合金的概念及其重要应用。
(4)以上各部分知识的综合应用。
Ⅰ.客观题(1)考查元素及其化合物的重要性质和应用。
(2)以元素及其化合物为载体考查离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等。
Ⅰ.主观题(1)以“铁三角”“铝三角”的转化关系为载体,考查分析图像能力和计算能力。
(2)以化工流程的形式,考查金属矿物的冶炼和工业废液的提纯。
一、常见金属及化合物的主要性质1.钠及其化合物(1)等物质的量的金属钠被氧化成Na 2O 和Na 2O 2时转移的电子数相同。
(2)钠与盐的溶液反应:钠不能置换出溶液中的金属,钠直接与水反应,反应后的碱再与溶液中的其他物质反应。
(3)向Na 2CO 3溶液中逐滴滴入盐酸,反应是分步进行的。
反应的离子方程式依次为:CO 2-3+H +===HCO -3、HCO -3+H +===H 2O+CO 2↑。
2.镁、铝及其化合物(1)镁在空气中燃烧主要发生反应:2Mg+O 2=====点燃22MgO ,此外还发生反应:3Mg+N 2=====点燃2Mg 3N 2、2Mg+CO 2====△2MgO+C 。
(2)铝与NaOH 溶液、非氧化性强酸反应生成H 2。
常温下,浓硝酸、浓硫酸使铝发生钝化。
命题趋势考点清单专题 四 ××常见金属及其化合物(3)Al2O3、Al(OH)3仅能溶于强酸和强碱溶液中(如在氨水和碳酸中不溶)。
(4)Al3+、AlO-2只能分别存在于酸性、碱性溶液中。
Al3+与下列离子不能大量共存:OH-、CO2-3、HCO-3、SO2-3、S2-、ClO-、AlO-2,其中OH-是因为直接反应,其余均是因为发生了剧烈的双水解反应。
AlO-2与下列离子不能大量共存:H+、HCO-3、Al3+、Fe2+、Fe3+,其中H+和HCO-3是因为与AlO-2直接反应(AlO-2+HCO-3 +H2O===Al(OH)3↓+CO2-3),其余也是因为发生了剧烈的双水解反应。
高三专题复习铁及其化合物.ppt

4.稍强的还原剂:Mg、Zn、Al、H2 、CO ……
Fe
21
3 4
+2价Fe
5
+3价Fe
6
◔请分别在1~6的位置填上相应的试剂,并 完成反应方程式。
5.强氧化剂:Cl2、Br2、O2、H2O2、O3、 HNO3 、H+/KMnO4……
Fe
21
3 4
+2价Fe
5
+3价Fe
6
◔请分别在1~6的位置填上相应的试剂,并 完成反应方程式。
铁是 26 号元素,在周期表中位于 第四 .
周期,第 Ⅷ 族,属于 过渡 金属元素,其
原子结构示意图是
。
纯净的铁为 银白 色金属,铁粉是 黑 色 粉末,在冶金工业上铁被称为 黑色 金属; 铁能被磁化;纯铁的耐腐蚀性 强 。
◔水合Fe2+是 淡绿 色的,水合Fe3+是棕黄色 的。
1
+3价Fe
Fe(OH)3
Fe
3 Fe3O4 4
5
2
+2价Fe
Fe(OH)2
注明上述转化的条件,完成1~5反应方程式。
铁矿
FeO 黑铁矿
Fe3O4 磁铁矿
Fe2O3 赤铁矿
Fe2O3∙3H2O 褐铁矿
颜色 黑色粉末 黑色晶体 红棕色粉末 红褐粉末
溶解性 难溶
难溶
难溶
难溶
与强酸反应 反应 缓慢反应 反应
反应
其他 不稳定 磁性
2.稍强的还原剂:Mg、Zn、Al、CO、H2 ……
Fe
21
3 4
+2价Fe
5
+3价Fe
6
高考化学二轮复习专题突破:金属及其化合物化学课件PPT

[二轮备考讲义] 第一部分 第10讲 第15页
名师伴你行 ·高考二轮复习 ·化学
(4)Al2O3 和 稀 硫 酸 的 反 应 : ____________________
基
础 ____________________________________________________
记
试
忆
(5)Al(OH)3 和 NaOH 溶液的反应:___________________
提
能
专
训
题 源 追 跟
[二轮备考讲义] 第一部分 第10讲 第8页
名师伴你行 ·高考二轮复习 ·化学
基
(10)NaHCO3 溶 液 与 过 量 澄 清 石 灰 水 混 合 :
础
记 _______________________________________________________
忆
试 做
名师伴你行 ·高考二轮复习 ·化学
基
础
记
试
忆
做
真
题
热 点 盘
第10讲 金属及其化合物
点
提
能
专
训
题 源 追 跟
[二轮备考讲义] 第一部分 第10讲 第3页
名师伴你行 ·高考二轮复习 ·化学
基
础
记
试
忆
做
真
题
基础记忆 思维对接
热
点 盘
实现一二轮无缝对接
点
提
能
专
训
题 源 追 跟
[二轮备考讲义] 第一部分 第10讲 第4页
[二轮备考讲义] 第一部分 第10讲 第16页
名师伴你行 ·高考二轮复习 ·化学
高考化学二轮复习金属元素及其化合物课件

目录
Content
01 考法1 碱金属元素及其化合物 02 考法2 镁、铝及其化合物的性质与应用 03 考法3 铁、铜及其化合物的性质与应用
PART 01
考法1 碱金属元素及其化 合物
钠及其化合物
钠是“极其活泼”金属的代表,学习钠的性质可类比知道第ⅠA族、第ⅡA族活 泼金属的一般性质。
1.知识网络构建
新教材新高考
2023届高考化学二轮复习 讲重难
专题四 金属元素及其化合物
考情预测
考情预测
核心素养
金属元素及其化合物是高考的重点考查内容,对钠、镁及其化合
物的主要性质单独考查的题目很少,一般与其他专题内容同时考查,考
查题型多是与其有关的工艺流程题或实验题。铁、铜及其化合物的性
质是高考热点之一,铁盐(Fe3+)、亚铁盐(Fe2+)的性质是考查的重点。 估计在2023年高考中,仍会结合社会热点综合物质性质,以转
Fe2+、Fe3+的检验
标题内容
单击此处添加文字阐述,添加简短 问题说明文字
铜及其化合物
铜是“氢后”且是“变价”金属的代表,它是典型的有色金属,也是典型的重金属。
标题内容
单击此处添加文字阐述,添加简短 问题说明文字
铜的性质
铜在潮湿的空气中生锈
铜锈俗称铜绿,其主要成分为碱式碳酸铜:2Cu+O2+H2O+CO2==Cu2(OH)2CO3。 用于制油漆颜料、烟火、杀虫剂、其他铜盐和固体荧光粉激活剂等,也用于种子 处理及作杀菌剂等。也用作颜料。
盐溶液液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),
以防空气与生成的Fe(OH)2接触产生反应。
标题内容
单击此处添加文字阐述,添加简短 问题说明文字
高考化二轮复习铝及其化合物的性质价类二维图在铝的重要化合物中的应用PPT课件

[名师课堂教学]高考化二轮复习铝 及其化 合物的 性质价 类二维 图在铝 的重要 化合物 中的应 用PPT课 件(完 整版PP T)
[名师课堂教学]高考化二轮复习铝 及其化 合物的 性质价 类二维 图在铝 的重要 化合物 中的应 用PPT课 件(完 整版PP T)
化学性质:归纳:氧化铝主来自的化学性2[02名0届 师高 课考 堂化 教学二 ]轮 高复 考习 化-二轮铝复及习其铝化及合其物化的合性物质的 性价质类价二维类图二在维铝图的在重铝要的化重合要物化中合的物应中用的(应共1用7张 PPTPP课T )件(完 整版PP T) 2[02名0届 师高 课考 堂化 教学二 ]轮 高复 考习 化-二轮铝复及习其铝化及合其物化的合性物质的 性价质类价二维类图二在维铝图的在重铝要的化重合要物化中合的物应中用的(应共1用7张 PPTPP课T )件(完 整版PP T)
2[02名0届 师高 课考 堂化 教学二 ]轮 高复 考习 化-二轮铝复及习其铝化及合其物化的合性物质的 性价质类价二维类图二在维铝图的在重铝要的化重合要物化中合的物应中用的(应共1用7张 PPTPP课T )件(完 整版PP T)
4、氧化还原反应在生产、生活中具有广泛 的用途。下列做法中涉及铝元素的还原性的 是( ) A.明矾净化水 B.用氢氧化铝治疗胃酸过多 C.用铝制容器存放浓硫酸 D.电解熔融氧化铝制单质铝
质: 两性氧化物
。 冶炼铝的原料
[名师课堂教学]高考化二轮复习铝 及其化 合物的 性质价 类二维 图在铝 的重要 化合物 中的应 用PPT课 件(完 整版PP T)
[名师课堂教学]高考化二轮复习铝 及其化 合物的 性质价 类二维 图在铝 的重要 化合物 中的应 用PPT课 件(完 整版PP T)
2023届高三化学高考备考二轮复习:元素及其化合物性质及其应用课件

K5=K1·K2/(K32·K4)= 107> 105
(4)向NaClO溶液中通入少量或过量CO2的离子方程式。 。
(5)向NaClO溶液中通入过量SO2的离子方程式。
ClO- + H2O + SO2 ═ SO42- + 2H+ + Cl-
。
(6)向FeBr2溶液中通入等物质的量Cl2的离子方程式。
2Fe2++2Br-+2Cl2===2Fe3++B①r②2+HH2CC4OOC33- l-
。 HCO3- +H+
CO32- +H+
③HClO
ClO- +H+
(7)S将OS2+O2C和l2C+l22混H合2O,==漂=4白H+性+减S弱O24的⑤-④ ⑤+原CH=a2①2CC因COO+33l(+(-②用sC) a-2离+③+2子CC×OlO2方32-。--=(④aC程qa)C+式OC3a表↓2++(2a示Hq)C)lO。
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH 。
(3)向NaOH、Na2CO3、NaHCO3溶液中逐滴滴入少量盐酸,写出发生反应的离子方 程式。
O_H__-_+__H_+_=_=_=__H_2_O_;__C_O__23_-_+__H_+_=_=_=_H__C_O_- 3_;__H_C_O__-3_+__H_+_=_=_=__H_2_O_+__C_O__2_↑____ 。
Fe(OH)2制备常用方法:
方法一:有机覆盖层法将吸有NaOH溶液的胶头滴管 插到液面以下,并在液面上覆盖一层苯或煤油(不能 用CCl4),以防止空气与Fe(OH)2接触发生反应,如图 1所示。
高考二轮复习之金属及其化合物(公开课)

氢氧化物稳定 性 冶炼方法 冶炼 方法
受热后分解
热还原法
热分解法
电解熔融态化合物
【2、合金的概念及其重要应用】 、合金的概念及其重要应用】
1、概念 、
由两种或两种以上的金属( 金属跟非金属)熔合而成 由两种或两种以上的金属(或金属跟非金属)熔合而成 金属 非金属 的具有金属特性的物质
2、特点 、
(1)合金的熔点比其他成分金属都要低 )合金的熔点比其他成分金属都要低 (2)合金有比成分金属更好的硬度、强度和机械加工性能。 )合金有比成分金属更好的硬度、强度和机械加工性能。
四.金属晶体熔点变化规律
1、金属晶体熔点变化较大, 、金属晶体熔点变化较大,
与金属晶体紧密堆积方式、 与金属晶体紧密堆积方式、金属阳离子与自由电子之间的金 属键的强弱有密切关系. 属键的强弱有密切关系.
2、一般情况下,金属晶体熔点由金属键强弱决定: 、一般情况下,金属晶体熔点由金属键强弱决定:
金属阳离子半径越小,所带电荷越多,自由电子越多, 金属阳离子半径越小,所带电荷越多,自由电子越多, 金属键越强,熔点就相应越高,硬度也越大 金属键越强,熔点就相应越高,硬度也越大,但金属性越弱。 金属性越弱 如:K﹤Na﹤Mg﹤ Al Li Na﹥K ﹥ Rb﹥ Cs ﹥ 熔点最低的金属: 熔点最低的金属:汞(常温时成液态) 常温时成液态) 熔点很高的金属: 熔点很高的金属:钨(3410℃) ℃ 铁的熔点: 铁的熔点:1535 ℃
【1、金属元素的活动性顺序及其性质】 、金属元素的活动性顺序及其性质】
顺序 比较 原子的失电子 能力 阳离子的得 阳离子的得电 子能力
K Ca Na
Mg Al
Zn Fe Sn Pb
H
Cu Hg Ag Pt Au
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流 程如下:
下列叙述正确的是( D )。 A.试剂X可以是氢氧化钠溶液,也可以是盐酸 B.反应①过滤后所得沉淀为氢氧化铁 C.图中所示转化反应都不是氧化还原反应 D.反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
(3)钠与盐的溶液反应:金属钠不能置换出溶液中的金属,钠直接与水反应,
反应后的碱再与溶液中的其他物质反应。
(4)Na2O2与CO2或H2O反应时,生成1 mol O2,转移电子的物质的量为2 mol。
(5)Na2O2跟CO2和水蒸气组成的混合气体反应时,应先考虑Na2O2跟CO2的反应。
因为若先发生反应:2Na2O2+2H2O===4NaOH+O2↑,必定还发生反应:2NaOH+
(3)步骤③中反应的离子方程式是 ____F_e_3_+_+_______________________________
_______________________________。
洗涤
冷却
(4)步骤④中一系列处理的操作步骤:过滤、________ 、灼烧、 _____、称
量。
0.07a
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。 【知识构建】
【变式训练】 1.1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L-1,向混合溶液中滴加0.1 mol·L-1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是( B )。
A.氯化铝、氯化镁、氢氧化钠 B.偏铝酸钠、氢氧化钡、硫酸 C.氯化铝、氯化铁、氢氧化钠 D.偏铝酸钠、氯化钡、硫酸
考点三、铁及其化合物
【例题】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲 测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加氯水(或
__双__氧__水__、稀硝酸等合理氧化剂)
溶液由浅绿色变为红色
Fe O2
盐酸 Fe2O3
Fe3+
稀盐酸或稀硫酸
Cl2 Fe Fe2+
OH— H+ Fe(OH)3
O2 H2O OH— Fe(OH)2
(6)FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,灼 烧后得到红棕色Fe2O3固体;而Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性的酸, 将得不到Fe(OH)3固体,最后得到的固体仍为Fe2(SO4)3。 (7)注意亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加 入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,也可能 含有Fe2+。
A.实验过程中甲中和乙中的现象始终保持一致 B.甲中沉淀一定比乙中的少 C.甲中沉淀可能比乙中的多 D.乙中沉淀可能比甲中的多
【知识构建】
Al O2
OH— Al2O3适量OH—Al(OH)3
AlO2—
OH— H+
Al3+
氨水
【解析】Al(OH)3能溶于NaOH溶液,而不溶于氨水,NaOH溶液和氨水均为一元 碱的水溶液,根据加入的碱溶液的量及实验现象进行分析,可能出现以下两种 情况:①若加入的碱溶液均不足量或均恰好完全反应生成Al(OH)3,则甲、乙中 的现象一致,生成的沉淀的量相等;②若加入的碱溶液均过量,过量的NaOH会 使生成的Al(OH)3沉淀部分溶解,而加入氨水的烧杯中生成的Al(OH)3不会溶解 。综上分析,只有D项符合题意。
量增加a g
2.有8 g Na2O2、Na2O、Na2CO3、NaOH的混合物与200 g质量分数为3.65%的盐
酸恰好反应,蒸干溶液,最终得固体质量为(C )
A.8 g
B.15.5 g
C.11.7 g
D.无法计算
考点二、铝及其化合物
【例题】甲和乙两烧杯中各装有100 mL 0.2 mol·L-1AlCl3溶液,向两烧杯中 分别加入相同体积、相同浓度的NaOH溶液和氨水,两烧杯中都有沉淀生成。下 列判断正确的是(______________,将该F过e2程+全的部现氧象化为为__F_e_3_+__________________。
(2)步骤②加入过量H2O2的目的是 ____F_e_3_+_+_3_O_H_-_=_=_=_=_F_e_(_O_H_)_3_↓__[_或__________。
2× 56× a 2× 56 3× 16
(4)步骤④的目的是将产生的红褐色悬浊液分离,最终得到固体Fe2O3,所以步骤④
【知识构建】
1.金属钠及其主要化合物的关系图
H2O Na O2 Na2O O2 Na2O2 H2O NaOH CO2 Na2CO3 CO2 NaHCO3
O2
CO2
2.金属钠及其化合物
(1)等物质的量的金属钠被氧化成Na2O和Na2O2时转移的电子数相同。
(2)钠与酸反应时,先与酸反应,酸不足时再与水反应。
专题4 金属及其化合物
考情分析预测
1.了解金属(如Na、Al、Fe、Cu等)在周期表中的位置及其性质递变的规律。 2.了解常见金属元素及其重要化合物的主要性质及应用。 3.了解合金的概念及其重要应用。 4.以上各部分知识的综合应用。
高频考点透析
考点一、金属钠及其化合物
【例题】在Na2O2与CO2的反应中,下列说法正确的是( C )。 A.该反应中Na2O2是氧化剂,CO2是还原剂 B.1 mol Na2O2参加反应,有2 mol e-转移 C.Na2O2晶体中阴、阳离子个数比为1∶2 D.CO2分子中含有极性键和非极性键
CO2===Na2CO3+H2O。
【变式训练】
1.下列对于过氧化钠的叙述中,正确的是( D )。 A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色 B.1 mol Na2O2与H2O完全反应,转移2 mol电子 C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质 为Na2CO3 D.a g CO和H2的混合气体充分燃烧的产物与足量Na2O2充分反应后,固体质
