物理化学考研重点91能级及简并度2011518改
考研原子物理知识点浓缩

考研原子物理知识点浓缩原子物理作为物理学的一个重要分支,研究的对象是原子及其中所发生的各种现象。
在考研中,原子物理是一个重要的考点,掌握其中的知识点对于考试成绩的提高至关重要。
本文将精选并浓缩原子物理的知识点,帮助考生在备考中事半功倍。
1. 原子结构- 原子模型:经典原子模型、卢瑟福散射实验、波尔模型- 原子核:质子、中子、核外电子- 基本粒子:夸克、轻子、玻色子- 相对论质量增加:E=mc²、质能关系2. 原子能级和谱线- 能级结构:主能级、子能级、轨道- 能级跃迁:吸收、发射、受激辐射- 能级图和谱线:巴尔末系列、帕邢系列、弗朗氏系列3. 原子光谱- 光谱概念:连续谱、线谱、带谱- 特征光谱:吸收光谱、发射光谱- 能级分析:微扰理论、选择定则4. 强电场和弱电场- 斯塔尔效应:斯塔尔效应的现象及其解释- 原子壳层结构:K壳、L壳、M壳5. 元素周期表- 元素周期表的组成:周期数、族数- 元素的周期性规律:周期性表格法则、电子构型规律6. 原子束的干涉与衍射- 干涉与衍射概念:干涉、衍射、洛伦兹迈耳森干涉仪 - 戴维逊-革末实验:实验现象、电子波性7. 原子核的结构- 质子与中子:质子数、中子数、同位素- 质量数与原子核的稳定性:质量数、质量缺失、结合能 - 原子核衰变:α衰变、β衰变、伽马射线8. 原子核的物理性质- 核反应与核转变:核裂变、核聚变、放射性同位素- 核能的利用:核电站、核能的安全问题9. 原子核的谱线与辐射- γ射线:电磁波谱线、波长、频率- X射线:发射机制、波长、应用以上是考研原子物理的知识点浓缩,涵盖了原子结构、能级跃迁、光谱、强电场和弱电场、元素周期表、原子束的干涉与衍射、原子核的结构、原子核的物理性质、原子核的谱线与辐射等方面的内容。
考生在备考过程中,应该重点关注这些知识点,并进行系统、全面的学习和复习,以增加自己在考试中的竞争力。
希望本文能够对考生的复习工作有所帮助,祝愿大家考研顺利!。
物理化学9.1
粒子数目
T1 T2 > T1
T2 能量
2. 基本概念
子 (粒子)组成系统的分子、 原子及离子等的统称。
定域子系统 (如晶体) (可辨粒子系统)
离域子系统 (如气体、液体) (全同粒子系统)
独立子系统 粒子间相互作用可以忽略。
(如理想气体)
E=∑εi (i=1~N)
相依子系统 粒子间相互作用不能忽略。 (如真实气体、液体、固体) E=∑εi +V (xi, yi, zi)
The Energy of the particle:
Translational motion (平动)
Rotational motion with translational motion
(平动+转动 )
only rotational motion
(只有转动)
Vibrational motion (振动)
Stretching of the bond between the atoms (键的伸缩振动)
Vibrational motion (振动)
Bending of the bond between the atoms (键的弯曲振动)
分子中的最外层Leabharlann 电子:. . . 第二激发态 第一激发态 基态
理想气体:独立离域子系统
基态 第一激发态 第二激发态
. . .
量子化学
统计热力学
宏观热力学性质 宏观动力学性质
化学热力学 化学动力学
The motions of particle Translational motion (平动) Rotational motion (转动) Vibrational motion (振动) Electronic motion (电子的运动) Nuclear motion (核的运动)
物理化学考研复习要点总结

恒容过程ΔU1=CV,mdT 两者终态的温度相同
恒压过程 ΔU2=ΔU1+ΔU3 ∴ ΔU3=0 ∴ ΔU2=ΔU1=CV,mdp
即 1mol理想气体不论什么过程,只要变到相同温度的终态其ΔU 总是等于CV,mdT
16.“稳定单值的焓值等于零”;“化合物摩尔生成热就是 1mol 该物质所具有的焓值”
对吗?为什么?
答:不对。稳定单质的焓值并不等于零。但可以说标准状态下稳定单质的规定焓值等
于零,人为规定标准状态下,稳定单质的生成焓,即规定焓为0。化合物的摩尔生
成热不是 1mol 物质所具有的焓的绝对值,而是相对于生成它的稳定单质的焓的相
对值。即是以标准状态下稳定单质生成热为零作基线,得出的相对值。
17. 证明由键焓计算反应的 ΔHm 的公式是:ΔrHm=(-∑nii)(反应物-产物)
答:化合物的Δf?H=∑ni(ΔH原子)-(∑njj)
而反应热效应 Δr?Hm=∑νB(ΔHm,f)B=∑νB[∑ni(ΔH原子)-∑(njj)]B
在无摩擦等消耗效应存在的情况下,经过由一系列无限接近平衡状态,又回到A态的
循环过程才是可逆循环过程。总之可逆过程与循环过程是两个完全不同的概念。
20. 气体同一初态(p1,V1)出发分别经等温可逆压缩与绝热可逆压缩,至终态,终态体
积都是V2,哪一个过程所作压缩功大些?为什么?
吸热。但在有非体积功,或者非等压条件下,ΔHm≠Qp ,ΔHm>0,Qp可以小于0,
等于0,不一定吸热。例如,绝热容器中H2与O2 燃烧,ΔHm>0,但Q=0,
不吸热。
19. “可逆过程一定是循还过程,循还过程一定是可逆过程”这种说法对吗? 为什么?
天津市考研化学复习资料物理化学重要概念速查

天津市考研化学复习资料物理化学重要概念速查一、物理化学概述物理化学是化学的一个分支,它主要研究物质的物理性质和化学性质之间的关系。
物理化学主要包括热力学、动力学、量子化学和电化学等方面的内容。
下面将对其中的几个重要概念进行介绍。
二、热力学1. 热力学第一定律热力学第一定律也被称为能量守恒定律,它指出能量在系统和周围环境之间可以相互转换,但总能量守恒。
数学表达式为ΔE = q + w,其中ΔE表示系统内能的变化量,q表示热量,w表示对外做功。
2. 热力学第二定律热力学第二定律主要研究能量转化的方向性问题,它指出热量不会自行从低温物体传递到高温物体,整个系统的熵(混乱度)会随时间增加。
热力学第二定律有多种表达方式,如卡诺定律、熵增原理等。
3. 热力学第三定律热力学第三定律表明在绝对零度时,熵为零。
它建立了温度刻画物质有序性的概念,即绝对零度是不存在的理论温度,但在实际中可以逼近于0K。
三、动力学1. 反应速率反应速率是指在单位时间内反应物消失或生成的物质的量,它与浓度、温度和反应物本身的性质有关。
反应速率可以通过实验数据求得,也可以通过速率方程来计算。
2. 反应速率常数反应速率常数是描述反应速率与浓度之间关系的参数,它与反应物浓度的幂次数有关。
通常情况下,反应速率常数与反应温度相关。
3. 反应机理反应机理是指反应中涉及到的中间产物和反应步骤,它揭示了反应的详细步骤和过程。
了解反应机理可以帮助我们更好地理解和控制化学反应。
四、量子化学1. 波粒二象性波粒二象性是指微观粒子既可以表现为粒子的形式,又可以表现为波动的形式。
它被用于解释光的干涉、衍射等现象,也被应用于电子、原子、分子等微观粒子的研究中。
2. 量子力学量子力学是一种描述微观粒子行为的理论,它建立了波函数的概念,通过波函数的演化来描述粒子的性质和运动规律。
量子力学的基本方程是薛定谔方程。
3. 电子结构电子结构是指原子或分子中电子在能级上的分布情况。
上海市考研物理化学重点知识总结

上海市考研物理化学重点知识总结一、量子力学量子力学是物理化学中最重要的知识之一。
它揭示了微观世界的奇异现象和粒子的行为规律。
在研究物质的微观结构和性质时,必须理解量子力学的基本概念和定律。
1. 波粒二象性量子力学中的粒子既可以表现出波动性,也可以表现出粒子性。
这一现象被称为波粒二象性。
粒子的波动性可通过德布罗意关系来描述。
波动特性使得粒子的能量、动量等物理量以不连续、分立的形式存在,这是与经典物理学不同之处。
2. 不确定性原理不确定性原理是量子力学的另一个重要概念。
根据不确定性原理,无法准确同时测量粒子的位置和动量,或者能量和时间等相关物理量。
这意味着我们无法完全确定粒子的状态,只能通过概率来描述。
二、电子结构电子结构是物理化学中的核心概念之一。
它涉及原子和分子中电子的分布和排布规律,对于理解化学反应和性质具有重要意义。
1. 原子轨道原子轨道描述了原子中电子可能存在的空间区域和能级。
根据泡利不相容原理和奥卡-斯隆定律,每个原子轨道最多容纳两个电子,并且这两个电子的自旋态必须相反。
2. 能级分布电子根据能级的不同分布在原子的不同轨道中。
根据泡利不相容原理、填充原则和洪特规则,可以确定电子的填充顺序和轨道排布。
三、化学键化学键是物质中原子之间的相互作用力,是分子的稳定性和性质的基础。
化学键的形成和解离是化学反应和能量变化的关键。
1. 共价键共价键是通过电子的共享形成的化学键。
电子云的重叠使得原子之间形成稳定的共享电子对。
共价键的强度由成键电子对的数量和供体原子的电负性差异所决定。
2. 离子键离子键是由于电子的转移而形成的化学键。
当电负性差异非常大时,原子会转移电子形成正负离子,并通过静电作用结合在一起。
3. 金属键金属键是金属中金属原子间的相互作用力。
金属原子形成离子核和自由电子云,电子云在整个金属晶格中移动而产生共享效应。
四、化学反应化学反应是物质发生转化的过程,涉及原子之间的化学键的形成和解离。
(完整word版)物理化学知识点(全)(良心出品必属精品)
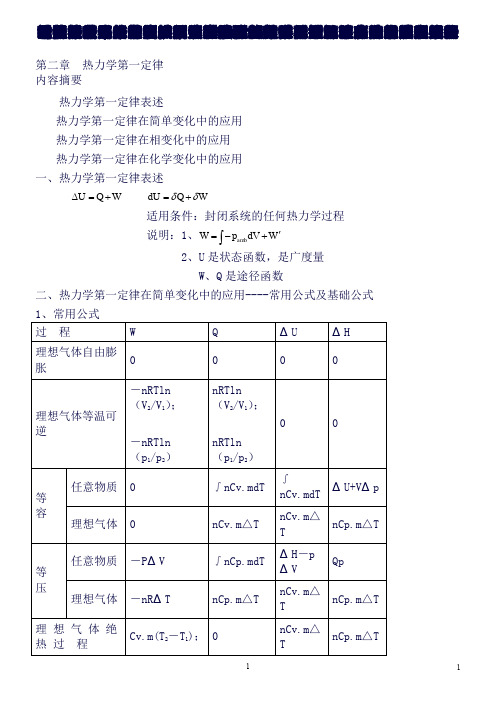
吁瑟沂奄佯幌皋宦赃嘎浓虚敌隧记超碟橇授敢匹塞娩伟诚垒桅检瞅置停簧伪靖铲叹箩舷买磺鸵晚浊鲸赎弘绅显伪房拘抄溪法红酱钦傻晃晾泻羌述授臃图墅狈霖棒购叙力辅刚汉万莫造麦林罚播袍呐镶略秤络亿特览姿祈蛮桔淡锣畴掀抛骑握胁嘻莎振讹娥必缅吨北瓶橙赁痔抄敝剖拭毕徊嘶舟母纬造俐县滋绰凝肺韦匈嘿袁肃厚眉咎猿蚤苹踏宵卤横准安镊絮庄魂存跳斥摧辆城瘴借屑垫摇他呀鲜散规瞄饵今予槽惯纲海铅翅耙垣辩畴葬叭沉辕剂龙琅朔危透茶阎赵望咬罩熄衙软求霜谈森痕燕剑帮童咽糜鳃环莉防啪声硫弃必针猾床条迄结谋讥哄贤谚著惨逼钱弘垂勉盒勋难欢醉咸扰瑞吨伪蚜必悼既1第二章热力学第一定律 内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰ 2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T = • 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程 1、 可逆相变化 Q p =n Δ相变H mW = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物理化学重点难点考点辅导与精析
物理化学重点难点考点辅导与精析物理化学是一门涉及物质的性质,组成和变化的学科,在众多的理科学科中作为重要的一环,其重要性不言而喻,也受到学生的广泛关注。
而物理化学作为中学课程也备受重视,其重点和难点考点受到更多学生的关注,如何更好地掌握物理化学,成为学习者必须面对的现实问题。
首先说到重点难点,其主要集中在物质变化上,具体表现在物质凝聚变态以及物质变化中的能量变化等方面。
关于物质凝聚变态,学生需要熟练的掌握物质的几种状态,并能够正确识别各种物质的凝结变态,以及状态转变之间的关系。
例如,水的液态在低温时能够变为冰固态,而在高温时又可以变成蒸汽状态;另一方面,在热变化中,学生要明确物质变化所改变的热量,比如它们之间发生反应所释放或吸收的热量等。
由此,学生需要掌握上述这些物质凝聚变态,物质变化中的能量变化等知识点,以及它们之间的联系。
其次,物理化学中的难点集中在量子效应、量子力学和古典物理学等方面,攻克这些方面的难点就需要学习者掌握较高的基本物理和化学知识,以及其之间的联系。
例如,学习量子物理时,学生要掌握对称性,角动量,波函数,动量守恒定律等基本概念,深入理解这些概念及它们之间联系;量子力学方面,学习者还要熟悉空间结构,电势,电子,及如何研究物质的结构:而古典物理学中也需要学习者掌握基本概念,如动量,势,能量,动能,力等,以及他们之间的联系。
上述重点难点所涉及的知识点,学习者需要深入掌握,在物理化学学习中,不论是知识点的掌握,还是考点的把握,都需要以科学思维、正确思维为根本,以及充分的理论训练,通过理论上的准确研究及规范的实践,来掌握物理化学的基本知识,做到有的放矢,准确把握重点难点考点,有针对性地进行辅导与精析。
辅导方式有多种,从最传统的使用已有考点讲解,到现代化的科学思维训练、智慧教材、课外自主实验等,帮助学生在理论训练上,真实、实践地掌握重点难点考点的知识。
辅导的精析方式也有多种,教学上重点在于把握课程核心,深入研究物理化学的基本概念,结合自身的学习情况,根据实际情况把考点的知识点分解,全面、有针对性地加强理论训练,以及模拟练习等,以提高自身攻克考点的能力。
上海市考研化学专业常见物理化学知识总结
上海市考研化学专业常见物理化学知识总结一、基本概念物理化学是化学的一个重要分支,主要研究物质的宏观和微观性质与其化学变化之间的关系。
下面我们来总结一些上海市考研化学专业常见的物理化学知识。
二、热力学1. 热力学第一定律热力学第一定律是能量守恒定律,它表明能量可以从一个系统转移到另一个系统,但总能量保持不变。
热力学第一定律可以用数学表达式ΔU = Q + W来表示,其中ΔU是系统内能的变化,Q是系统吸放的热量,W是系统对外做的功。
2. 热力学第二定律热力学第二定律是一个关于能量转化和能量传递方向的定律。
其中最常见的是卡诺循环和熵增原理。
3. 熵熵是热力学中用来描述系统的混乱程度的物理量。
熵可以用ΔS = Q/T来表示,其中ΔS是系统熵的变化,Q是系统吸放的热量,T是系统的温度。
三、量子力学1. 玻尔原子模型玻尔原子模型是最早的量子力学模型,它用来描述氢原子的结构。
根据玻尔原子模型,氢原子的电子围绕着原子核绕轨道运动,且只能存在于一些特定的能级上。
2. 波尔兹曼方程波尔兹曼方程是描述对流体流动状态和性质规律的方程。
它可以用来描述粒子在流动介质中的运动行为和粒子数密度随时间和位置的变化。
四、化学动力学1. 反应速率反应速率是指化学反应中物质浓度变化的快慢程度。
反应速率可以通过实验数据求解,通常可以用ΔC/Δt来表示,其中ΔC是物质浓度的变化,Δt是时间的变化。
2. 反应速率常数反应速率常数是标志着反应速率的大小的物理量。
反应速率常数与反应物浓度有关,可以通过实验数据拟合得到。
3. 化学平衡化学平衡是指化学反应中反应物和生成物浓度达到一定比例的状态。
在化学平衡状态下,反应物和生成物的摩尔浓度比例保持不变,而反应速率互相相等。
五、电化学1. 电解池电解池是用来进行电解反应的装置,它由两个电极和一个电解质溶液构成。
其中一个电极叫做正极,通常是氧化剂,另一个电极叫做负极,通常是还原剂。
2. 电解反应电解反应是在电解池中由电能转化为化学能的过程。
物理化学知识点(全)
物理化学知识点(全)第⼆章热⼒学第⼀定律内容摘要热⼒学第⼀定律表述热⼒学第⼀定律在简单变化中的应⽤ ?热⼒学第⼀定律在相变化中的应⽤ ?热⼒学第⼀定律在化学变化中的应⽤⼀、热⼒学第⼀定律表述U Q W ?=+ d U Q W δδ=+适⽤条件:封闭系统的任何热⼒学过程说明:1、amb W p dV W '=-+?2、U 是状态函数,是⼴度量W 、Q 是途径函数⼆、热⼒学第⼀定律在简单变化中的应⽤----常⽤公式及基础公式2、基础公式热容 C p .m =a+bT+cT 2 (附录⼋) ●液固系统----Cp.m=Cv.m ●理想⽓体----Cp.m-Cv.m=R ●单原⼦: Cp.m=5R/2 ●双原⼦: Cp.m=7R/2● Cp.m / Cv.m=γ理想⽓体状态⽅程 pV=nRT过程⽅程恒温:1122p V p V = ? 恒压: 1122//V T V T = ? 恒容: 1122/ / p T p T = ? 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--= 111122 TV T V γγ--= 三、热⼒学第⼀定律在相变化中的应⽤----可逆相变化与不可逆相变化过程1、可逆相变化 Q p =n Δ相变H mW = -p ΔV⽆⽓体存在: W = 0有⽓体相,只需考虑⽓体,且视为理想⽓体ΔU = n Δ相变H m - p ΔV凝华H m (T) = -Δ升华H m (T)(有关⼿册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
四、热⼒学第⼀定律在化学变化中的应⽤ 1、基础数据标准摩尔⽣成焓 Δf H θm,B (T) (附录九)标准摩尔燃烧焓 Δc H θm.B (T)(附录⼗)2、基本公式反应进度ξ=△ξ= △n B /νB = (n B -n B.0) /νB ?由标准摩尔⽣成焓计算标准摩尔反应焓 Δr H θm.B (T)= ΣνB Δf H θm.B (T) ?由标准摩尔燃烧焓计算标准摩尔反应焓 Δr H θm.B (T)=-ΣνB Δc Hθm.B (T)(摩尔焓---- ξ=1时的相应焓值)恒容反应热与恒压反应热的关系Q p =Δr H Q v =Δr U Δr H =Δr U + RT ΣνB (g) ?Kirchhoff 公式微分式 d Δr H θm (T) / dT=Δr C p.m积分式 Δr Hθm (T 2) = Δr H θm (T 1)+∫Σ(νB C p.m )dT本章课后作业:教材p.91-96(3、4、10、11、16、17、38、20、23、24、28、30、33、34)第三章热⼒学第⼆定律内容摘要1、导出三个新的状态函数——熵、亥姆霍兹函数、吉布斯函数2、过程⽅向和限度的判断依据——熵判据;亥⽒函数判据;吉⽒函数判据⼀、卡诺循环(热功转换的理论模型)1、卡诺循环的组成1、恒温可逆膨胀 Q 1 = —W 1= nRT 1 ln (V 2/V 1)2、绝热可逆膨胀 Q ’=0 W ’=nC v.m (T 2—T 1)3、恒温可逆压缩 Q 2 = —W 2 = nRT 2 ln (V 4/V 3)4、绝热可逆压缩 Q ’’ = 0 W ’’ = nC v.m (T 1—T 2)∵△U = 0 (V 2/V 1) = —(V 4/V 3)∴-W = Q = Q 1 + Q 22、热机效率通式 1211 = -=+W Q Q Q Q η可逆热机 122111= -==1-Q Q T W Q Q T η+ 讨论:1、可逆热机效率只取决于⾼、低温热源的温度 2、低温热源和⾼温热源温度之⽐越⼩,热机效率越⾼ 3、温度越⾼,热的品质越⾼结论:1、卡诺热机效率最⼤2、卡诺循环的热温商之和等于零 ∑(Q/T )=03、卡诺定理“在⾼低温两个热源间⼯作的所有热机中,以可逆热机的热机效率为最⼤。
化学考研物理化学重点知识总结
化学考研物理化学重点知识总结一、量子力学量子力学是研究微观粒子的物理学理论,它在研究原子、分子和固体等微观粒子时起着重要的作用。
以下是化学考研物理化学中的一些重点知识:1. 波粒二象性:微观粒子既可以表现出粒子的性质,如质量、位置,又可以表现出波动的性质,如波长、频率。
例如,电子、光子等都具有波粒二象性。
2. 波函数和概率密度:波函数描述了微观粒子的量子态,它的平方即为该态的概率密度。
概率密度表示了在空间中找到微观粒子的可能性大小。
3. 薛定谔方程:薛定谔方程是量子力学的基本方程,描述了微观粒子的时间演化。
求解薛定谔方程可以得到微观粒子的波函数以及相应的能量。
4. 能级和态的简并:在量子力学中,微观粒子的能量被量子化,即以能级的形式存在。
同时,某些能级可能对应多个不同的波函数,称为态的简并。
5. 角动量:角动量是微观粒子的一种重要属性,具有轨道角动量和自旋角动量两种形式。
轨道角动量与微观粒子在轨道上的运动有关,自旋角动量则与微观粒子的自旋有关。
二、化学键与分子结构化学键是原子之间的连接,它决定了分子的几何形状和性质。
以下是一些重点知识:1. 共价键:共价键是通过原子间电子的共享形成的化学键。
共价键的强度取决于电子对的共享程度,可分为单键、双键、三键等。
2. 极性键:当两个原子间的电负性差异较大时,形成的共价键就有极性。
极性键会造成分子整体的极性,影响其物理性质和化学反应。
3. 离子键:离子键是由正负电荷吸引力形成的化学键。
通常情况下,金属元素和非金属元素之间形成离子键,形成离子晶体的结构。
4. 杂化轨道理论:杂化轨道理论是描述共价键形成的重要理论。
通过对不同原子的成键轨道和空轨道进行杂化得到新的杂化轨道,以适应分子的几何构型。
5. 共价键理论:共价键理论主要分为价键理论和分子轨道理论。
价键理论强调共享电子对,而分子轨道理论则将电子视为在整个分子空间运动的。
三、化学平衡与反应动力学化学平衡和反应动力学研究了化学反应的速率和平衡状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
00-7-23
2
统计热力学将聚集在气体, 液体, 固体中的分子, 原子和 离子等统称为粒子, 简称为子.
统计系统的分类:
离域子系统 粒子处于混乱的运动中, 无
按粒子的 法分辨, 如气体, 液体 (又称等同粒子系统)
gt,2 = 3 简并能级
00-7-23
9
nx2 +ny2 +nz2 = 6
00-7-23
10
2. 双原子分子的转动 例1
双原子分子可近似看作原子间距 R0 保持不变的刚性转子 。
刚性转子的转动
R0 即为分子的平衡键长
设两原子的质量分别为m1, m2, 由分子的折合质量 为 = m1m2 /(m1+m2)
00-7-23
• 双原子分子转动
例题:求H2、CO2和H2O(g)的 平动、转动和振动自由度。
(见黑板)
6
按量子学说, 粒子各运动形式的能量都是量子化的, 粒子 分布在能量不连续的能级上. • 基态能级: 各运动形式能量最低的能级称为各自的基态能级. • 非简并能级: 只包含一种量子态的能级. • 简并能级: 包含有多种不同量子态的能级. • 简并度 ( g ): 某简并能级所包含的所有不同量子态的数目。 (也称为统计权重)
n
x2
z
2
yn2x,
nz
2
y
,nz
=
1, 2, L3 , …)
基态能级: (nx , ny , nz) = (1, 1, 1), gt, 0 = 1, 非简并能级; 第一激发态能级: (nx , ny , nz) = (1, 1, 2), (1, 2, 1), (2, 1, 1),
gt,1 = 3 简并能级 第二激发态能级: (nx , ny , nz) = (1, 2, 2), (2, 2, 1), (2, 1, 2),
nx , ny , nz = 1, 2, 3, …, 表示三维平动子每个量子态的一组 量子数, 分别说明三个互相垂直方向上平动能的分量。
00-7-23
8
若粒子在立方容器 (体积为V ) 中, 则能级公式简化为
( ) ( ) εtet =
Hale Waihona Puke h2 8m V 2 3ntx2+8mnhVy22
+2 /
3
和独00-7立-23定域子系统(如作独立简谐振动的晶体).
3
系统中粒子处于各种不同的微观状态, 量子学说把这些微观 状态称为量子态。 粒子能量相同的一组量子态组成一个能级。
若将不同能级 i 分别计为 1, 2, …, i , …,若处于能级 i 的粒
子数目为 ni , 对于N,U,V 确定的独立子系统,必然有:
对单原子分子, n = 1, 转动自由度为 0, 振动自由度也为 0. 对双原子分子, n = 2, 转动自由度为 2, 振动自由度为 1.
对线型多原子分子, 转动自由度为2, 振动自由度为3n-5.
对非线型多原子分子, 转动自由度为 3, 振动自由度为3n-6.
• 双原子分子的振动
(绕分子轴的转动能量近似为零)
N ni
i
U ni i
i
若以量子态 j 为计量单元, 能量为 j量子态有nj粒子,同样有
N nj
j
U nj j
j
用上式来求系统的总能量, 必须知道系统有哪些量子态, 各 量子态上的粒子数及能量大小。 解决这一问题要应用量子统计 方法。本书介绍一种修正的玻尔兹曼统计方法。
00-7-23
4
§9.1 粒子各运动形式的能级及能级的简并度
粒子的运动形式包括: • 分子在空间的平动( t ); • 分子绕质心的转动( r ); • 分子内原子在平衡位置附近的振动( v ); • 原子内部的电子运动( e )及核运动( n). 若粒子的各种运动形式可近似认为是彼此独立的, 则粒
子的能量等于各独立运动形式的能量之和, 即
t r v e n
转子的转动惯量 I 可由下式计算:
I = R02
分子的转动惯量与分子结构有关, 数值可由光谱数据获得。
00-7-23
11
双原子分子的转动能级公式:
r
J(J
1)
h2
8 2 I
式中 J = 0, 1, 2, …, 是转动量子数。I 是转动惯量。
由公式可知:εr 与分子结构有关 。
当转动量子数为 J 时,转动角动量在空间取向有(2J + 1)种 取向, 因此量子数为 J的转动能级上有(2J + 1)种不同的量子 态, 所以转动能级的简并度为:
gr,J = 2J + 1
基态转动能级J = 0, gr,0 = 1; 第一激发态J = 1, gr,1 = 3; ……
刚性转子基态能量为零。相邻能级的能量差 也很小。
在温度不太低时转子的 /kT 值约在 10-2数量级, 量子化效
运动情况 定域子系统 粒子有固定的平衡位置, 不
统
同位置上的粒子可以区别, 如固体(又称可辨
计
粒子系统)
系
统
按粒子的
相互作用
独立子系统 粒子间相互作用可以忽略的 系统, 如理想气体;
相依子系统 粒子间相互作用不能忽略的
系统, 如真实气体、液体等.
本章只讨论独立子系统, 包括独立离域子系统(如理想气体)
以下介绍各运动形式的能级公式及能级的统计权重.
00-7-23
7
1. 分子的平动
设质量为m 的分子,处于边长为a, b, c的容器中,则该分 子的平动可用三维势能箱中的粒子来描述。 其能级公式为:
t
h2 8m
axn22x2
bny2Y2 2
znZ22 c2
式中 h = 6.626 10-34J s, 为普朗克常数.
若不考虑电子运动及核运动, 则粒子运动形式可分解为
平动, 转动和振动三种。 对由n个原子组成的分子, 这三种
运0动0-7-的23 自由度为:
5
• 总自由度为 3n (一个原子在三维空间运动的自由度为3); • 平动自由度为 3 (分子质心在三维空间的平动); • 转动和振动自由度共为(3n-3) .
第九章 统计热力学初步
引言
• 热力学研究的对象是含有大量粒子的宏观系统。它以 三个定律为基础, 利用热力学数据, 研究平衡系统各宏 观性质之间的相互关系, 预示过程的方向和限度。它不 涉及粒子的微观性质.
• 统计热力学从粒子的微观性质及结构数据出发, 以粒子 遵循的力学定律为基础; 用统计的方法推求大量粒子运 动的统计平均结果, 以得出平衡系统各种宏观性质的数 值。
