附教程欧盟国及美日上市药品检索方法
国外上市药品说明书查找途径

国外上市药品说明书查询途径和网址一:美国FDA批准上市的药品:1.CDER的drug@FDA是首选,权威且方便快捷,输入通用名或是商品名或日期,点击后就进入药品信息的网页,可查看药品的批准历史.治疗等效性的信息,当然最有价值的还是说明书信息(label information)。
——drug@FDA网址:/scripts/cder/drugsatfda/2.也可以选择直接登陆/dailymed/about.cfm,可查询FDA批准的处方药说明书。
3.rxlist,几乎可查询所有处方药,除说明书以外,还包括其它的特色,比如Top300,网上商店等等,这里就不一一赘述了,有兴趣上去转转,一定会有收获。
rxlist网址:/script/main/hp.asp二:欧洲上市批准的药品1.登陆emea的官方网站,进入human medicines的A-Z list,然后按字母顺序查找,,包括品种综述和公开评价报告,后者主要包括摘要.病人信息.说明书等,但美中不足的是A-Z list只提供近两年欧盟批准的药品信息,更早的信息在什么地方查询还不知道,希望大家指点!emea:http://www.ema.europa.eu/ema/index.jsp?curl=/pages/home/Home_Page.jsp2.eMC:/更多的药品信息综述,在emea网站上没有找到的可以上这里试试。
3.网址:/mrindex/index.htmlThis Product Index includes medicines approved in the Member States of the European Union according to the procedure for Mutual Recognition 通过欧盟各成员的互认程序后批准的药品索引,网页左下方的quicksearch中输入药品名快速查询,也可以点击find product后进行高级搜索,选择Rms(Reference Member State),或是cms(Concerned Member States ),next后进入下一个界面选择限定条件进一步搜索. 4.emea 06/12/2006 已经发布了其药品数据库EudraPharm ,支持产品名或活性成分搜索。
国外上市药品说明书查找途径

国外上市药品说明书查找途径国外上市药品说明书查找途径:1、简介国外上市药品说明书是指在国外市场上销售的药品所附带的使用指南,它包含了药物的成分、剂量、用途、适应症、不良反应、使用方法等详细信息,以帮助医生和患者正确、安全地使用药物。
在国外上市的药品说明书往往由药品生产厂商或相关监管机构提供,并在官方网站上进行发布。
2、查找途径在寻找国外上市药品说明书时,以下是几个常用的途径:2.1 药品生产商官方网站大多数药品生产商会在它们的官方网站上提供药品的详细信息,包括说明书。
访问药品生产商的官方网站,通过搜索功能或浏览产品页面,可以找到并所需的药品说明书。
2.2 药品监管机构网站国外的药品监管机构也通常会提供药品信息,包括说明书。
例如,美国的食品药品监督管理局(FDA)和欧洲药品管理局(EMA)等机构,在其官方网站上提供了药品数据库和文档功能,可以查找并获取所需的药品说明书。
2.3 医学文献数据库一些医学文献数据库,如PubMed、Embase等,也收录了一部分国外上市药品的说明书。
通过在这些数据库中搜索药品名称,可以找到相关的研究论文和说明书等文献。
2.4 药品信息数据库一些第三方的药品信息数据库,如、Medscape等,在网站上提供了药品详细信息和说明书的。
通过在这些数据库中搜索药品名称,可以找到相关的药品说明书。
2.5 国际合作机构一些国际合作机构,如世界卫生组织(WHO)和国际药物监管机构协调委员会(ICMRA),也提供了一些国外上市药品的说明书和其他相关文档。
通过访问它们的官方网站,可以查找并所需的文献。
3、附件本文档无附件。
4、法律名词及注释4.1 药品生产商:药品制造、销售和分发药品的机构或企业。
4.2 药品监管机构:负责药品监管和审批的机构或独立机构,确保药品的质量、安全和有效性。
4.3 食品药品监督管理局(FDA):美国的药品和食品监管机构,负责监管和审批药品、医疗器械和食品。
4.4 欧洲药品管理局(EMA):负责欧洲联盟国家的药品监管、协调和审批工作的机构。
附教程欧盟国及美日上市药品检索方法

[附教程]欧盟28国及美日上市药品检索方法自国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》以来,全国仿制药将分期分批开展质量和疗效一致性评价工作。
那么对原研上市药品开展调研,获取详细信息并准确寻找参比制剂,就显得比较重要了。
鉴于目前我国参比制剂的确定主要范围在美、日、欧(其它常用的如阿根廷、加拿大、印度等国的查询方法暂不在本文之列),本人结合自身检索经验和与同行的交流学习,整理了欧盟及美、日的药品检索方法,供同行交流探讨。
本文不仅仅提供信息检索途径,也是提供一种检索思维,希望对大家有所帮助。
一、翻译各国药品查询,语言是一大障碍,先推荐几个本人常用的翻译工具,根据需要自行选择:1、谷歌在线翻译(没被禁止,翻译速度挺快);1965年4月8日,法国、联邦德国、意大利、荷兰、比利时和卢森堡6国在比利时首都布鲁塞尔又签署《布鲁塞尔条约》,1967年7月1日,《布鲁塞尔条约》生效,欧共体正式诞生;1973年英国、丹麦和爱尔兰加入欧共体;1981年希腊加入欧共体;1986年葡萄牙和西班牙加入欧共体;1993年11月1日,根据内外发展的需要,欧共体正式易名为欧洲联盟;1995年奥地利、瑞典和芬兰加入欧盟;2004年5月1日,马耳他、塞浦路斯、波兰、匈牙利、捷克、斯洛伐克、斯洛文尼亚、爱沙尼亚、拉脱维亚、立陶宛10国加入欧盟;2007年1月1日,罗马尼亚、保加利亚加入欧盟;2013年7月1日,克罗地亚正式加入欧洲联盟成为第28个成员国。
三、检索药品检索首先要获得药品的商品名和活性成分名,其中商品名一般是英文即可,而活性成分名一般为各国相应语言的名称,差别一般较大,有的即使是英文,不同国家可能也会存在微小差异,所以检索时应灵活运用,综合运用检索信息。
另外,在品种相应国家的企业官网也有许多信息可供参考。
下面先提供三个获得不同国家药品商品名的途径:1、马丁代尔大典(ProprietaryPreparations部分);3、西班牙官网(前提是要在西班牙上市,主要是在欧盟上市国的商品名);(一)美国FDA官网上信息量很大,有Drugs@FDA、橙皮书、BE一致性指南、非活性成分数据库、溶出数据库等等。
如何查询药品在国外获批情况?

如何查询药品在国外获批情况?药企在做仿制药立项的时候会了解药品在国内外获批情况,主要是查询国内、欧、美、日这几个国家的药品,查询同剂型/不同剂型、同靶点/不同靶点等等在国内外上市获批的情况,以及全球首次获批的情况,原料药登记备案信息等,分析竞争情况,查看竞争对手数量。
以上这些数据很多都会到各大药监局查询国内外药品信息,这就会出现问题整合时间慢,查询效率低,所以推荐使用药融云数据库查询,在药融云的“全球上市药品数据库”中能了解国内外药品获批情况包含了美国FDA批准药品数据库、日本药品数据库、欧盟上市药品数据库。
在药融云的上市药品数据库中的数据来源与官方数据,经过深度的加工和精细化的处理,制定了一套标准化的操作流程,能快捷方便的查询获取数据。
可通过多维度的检索方式可查询“美国FDA批准药品”的审批注册信息、说明书及相关批准文件等。
药物信息主要包括:商品名、申请机构、申请号、活性成分、剂型给药途径、是否参比制剂、是否生物等效试验对照药品、治疗等效代码、药品提交类型(新药化学类别)和审评类别、审批历史信息等。
列如搜索药品名称为“西地那非”在条件筛选中的申请类型选择“新药申请”点击搜索之后,可以申请号浏览、活性成分浏览、申报企业浏览,能查询到药品的说明书,以及各个药企申报的药品信息。
点击“药品名称”进入详情页面,在药品首次批准信息,能查询提交序号、批准日期、批准类型、提交类型、审评通道、是否孤儿药,以及相关文件(说明书、批准信、审评文件)信息。
然后就是欧盟获批上市药品信息,主要是欧盟集中审批药品数据库,这部分的数据是在欧盟所有国家上市的药品,而欧盟互认程序药品数据库包含的只是在欧盟一部分国家上市,可以通过模糊检索、精准检索、组合检索、条件筛选、高级搜索“是或非”、热点检索、智能化等检索方式,能快速查到欧盟上市药品信息。
日本上市药品数据库收载了日本PMDA批准的1万+药品数据,提供中、英、日文药品名称检索,规避语言障碍,通过药品名称、生产企业、许可证号、ATC编码等可查询目标产品剂型、制剂处方(辅料)信息、上市日期、日本药价标准目录收载的药品价格、药品说明书,查阅审评报告与IF文件(药物综述资料),有利于更好地理解药物特点。
各国的原研药品信息查询方法

各国的原研药品信息查询方法原研药品是指由制药公司自行研发并获得批准上市销售的药品,也被称为创新药品。
各国的原研药品信息查询方法可能会有所不同,下面将就几个主要国家来介绍各自的查询方法。
1.美国(FDA):美国食品药品监督管理局(Food and Drug Administration)是美国的药品监管机构。
他们在官方网站上提供了一个名为“药物信息”的在线查询平台,用户可以通过该平台并获取到相关的原研药品信息,包括药品的适应症、剂量、注意事项等。
2.欧洲(EMA):欧洲药品管理局(European Medicines Agency)是欧洲的药品监管机构。
他们在官方网站上提供了一个名为“药物数据库”的查询工具,用户可以通过该工具并获取到欧洲上市的原研药品的详细信息,包括药品的生产商、适应症、剂量、副作用等。
3.英国(MHRA):英国药品和医疗保健产品规管局(Medicines and Healthcare products Regulatory Agency)是英国的药品监管机构。
他们在官方网站上提供了一个名为“电子药物信息汇总”的在线查询平台,用户可以通过该平台并获取到在英国上市的原研药品的详细信息,包括药品的适应症、剂量、注意事项等。
4.日本:日本厚生劳动省(Ministry of Health, Labour and Welfare)是日本的药品监管机构。
他们在官方网站上提供了一个名为“新药信息”的在线查询平台,用户可以通过该平台并获取到日本上市的原研药品的详细信息,包括药品的适应症、剂量、副作用等。
5.中国:国家药品监督管理局是中国的药品监管机构。
他们在官方网站上提供了一个名为“国家药品信息查询”的在线查询平台,用户可以通过该平台并获取到国内上市的原研药品的详细信息,包括药品的适应症、剂量、副作用等。
此外,用户还可以通过中国知网等学术数据库查询到一些原研药品的研究论文和临床试验结果。
总而言之,各国的原研药品信息查询方法主要集中在各国的药品监管机构的官方网站上,用户可以通过在线查询平台并获取到相关的药品信息。
药品信息查询的十种方法(FDACDE)
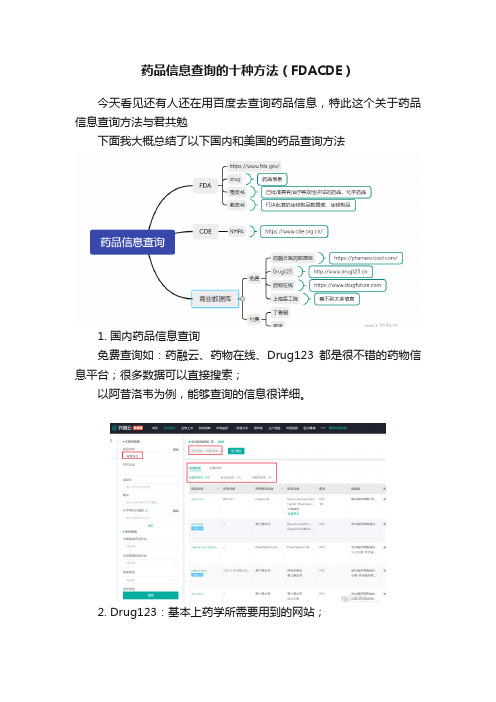
药品信息查询的十种方法(FDACDE)今天看见还有人还在用百度去查询药品信息,特此这个关于药品信息查询方法与君共勉下面我大概总结了以下国内和美国的药品查询方法1. 国内药品信息查询免费查询如:药融云、药物在线、Drug123都是很不错的药物信息平台;很多数据可以直接搜索;以阿昔洛韦为例,能够查询的信息很详细。
2. Drug123:基本上药学所需要用到的网站;3.上海医工院数据库目前查不到太多相关信息,预计不好用;4.最直接的是CDE和FDA,但是有些信息查询看不到具体情况,有时候需要多个平台交叉进行查证。
5. 收费的有丁香园蓝宙就不过多介绍二、CDE受理信息查询1. 首先进入CDE官网,点进信息公开栏,受理品种信息。
2. 可查看受理药品信息及上市药品信息;三、FDA查询药品信息进入FDA官网:找到Drugs,点击进入。
我们以查找抗癌药物Sorafenib(Nexavar)的药品说明书和审批历史为例。
1、首先进入Drugs@FDA的搜索栏输入活性成分”Sorafenib”或者”Nexavar”,然后点击提交进入”DrugDetails”,看到药品详细信息我们继续点击”Approval Date(s) and History, Letters, Labels, Reviews for NDA 021923通过标签信息和申请列表,理清这个药物从首次获批到现在的历次变更,对应每次变更都有FDA的Letter解释及这次变更的原因和FDA的意见。
我们还是以Sorafenib增加适应症为例。
从Sorafenib的最新标签来看,该药先后获得了3个适应症有一份十分重要的资料:”Review”.点击进入该药的DrugApproval Package,能找到该药的医学、化学、药学、统计学及临床方面的审评意见,帮助我们了解该药的的审评标准。
点击Therapeutic Equivalents 查找该药品仿制药的治疗等效产品。
药物研发文献检索系列培训之一美、日上市药品信息检索

2019/4/29
7
溶出方法数据库:
提供药品的溶出采用的方法、转速、介质、介质用量和 推荐取样时间等信息。
两种检索方式:关键词检索和活性成分按首个字母排序 查找
2019/4/29
8
药品信息搜索:
提供药品审批历史记录,信件,综述,及相关文件、说明书、 药品注册分类、审评分类、治疗等效等信息。
可采用三种搜索方式:1)关键词检索;2)活性成分按首个 字母排序查找;3)按审批月份检索
药物研发文献检索系列培训之一
——美、日上市药品信息检索
2019/4/29
王德平
2016年6月
1
内容介绍
上市药品信息查询: 美国上市药品信息查询; 日本上市药品信息查询;
2019/4/29
2
FDA药品信息查询
FDA网址:/ 点击:Drugs按钮进入药品信息界面
2019/4/29
9
FDA橙皮书:
提供药品在FDA批准的具有生物等效一致性药品信息: 申请号、持有人、批准日期、剂型规格、商品名、药品专利、 一致性评价等信息。
有五种检索方式:活性成分、申请持有人、商品名、药品 专利。
药品按照处方药、非处方药和已撤市进行分类。
2019/4/29
10
二)指南,合规 性和监管信息 (Guidance, Compliance & Regulatory Information )
2019/4/29
13
日文名称查询
较常采用的方法手段: 1、 http://moldb.nihs.go.jp/jan/ 可通过活性成分的 CAS号、英文名称检索药品的日文名等信息 2、 http://www.kegg.jp/kegg/drug/drug_ja.html 支持英 文一般名称检索,检索到本药物指导原则:药 品开发、注册、生产、 仿制药BE评价等相 关指导原则。
欧美日本药品申报信息查询小贴士

欧美日本药品申报信息查询小贴士1:美国FDA申报信息查询FDA网站:/索引:/scripts/cder/drugsatfda/index.cfm注意:(1)直接在首页SEARCH搜索药品英文名(通用名),可搜集到更多更全的资料。
(2)FDA网站上公布的资料基本都是概括性的东西。
一般原研厂的“Label information”里面有主药性状、制剂所用辅料种类,临床前与临床试验的结果等。
仿制药厂提供Label的较少。
(3)确认是在美国上市的药品才有可能在此查到相关信息。
2:欧洲EMEA申报信息查询EMEA网站http://www.emea.europa.eu/home.htm索引:http://www.emea.europa.eu/htms/human/epar/v.htm注意:(1)直接在首页SEARCH搜索药品英文名(通用名)或商品名,可搜集到更多更全的资料。
(2)EMEA网站上公布的资料信息比较全面。
(3)确认是在欧盟上市的药品才有可能在此查到相关信息。
3:日本厚生劳动省申报信息查询网站:.pmda.go.jp/shinyaku/shinyaku_index.html检索界面:.pmda.go.jp/shinyaku/shinyaku_index.html比如用检索词アゼルニジピン进入:【新薬の承认审査に関する情报】即可。
4:日本申报厂家网上公布信息(1)日本厚生劳动省公布的申报信息可能是不全面的,有些关键部分被黑方块涂抹,需要到原研的公司的网站上查询,日本在药品申报方面非常透明,所有资料必须公布。
(2)可以通过日本厚生劳动省申报信息中获取申报厂家的名称,也可直接通过GOOLEE网站,输入药品日文名称,再输入以下描红的字眼的关键词,也可找到申报厂家,如果还找不到,那就真的找不到拉。
塩酸ベバントロール贩売名、日本标准商品分类番号、塩酸ベバントロール承认番号. 通过以上检索同时要检索到药品制剂名称,才能方面后面检索(3)在GOOLEE网站上输入日本厂家名称,打开厂家网站,以END为例(アゼルニジピン),申报厂家日本第一三共,网站https://www.daiichisankyo.co.jp/进入https://www.daiichisankyo.co.jp/med/di/index?syllabary=ka选择アゼルニジピン(END)的制剂日文名,查询到所需文献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[附教程]欧盟28国及美日上市药品检索方法自国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》以来,全国仿制药将分期分批开展质量和疗效一致性评价工作。
那么对原研上市药品开展调研,获取详细信息并准确寻找参比制剂,就显得比较重要了。
鉴于目前我国参比制剂的确定主要范围在美、日、欧(其它常用的如阿根廷、加拿大、印度等国的查询方法暂不在本文之列),本人结合自身检索经验和与同行的交流学习,整理了欧盟及美、日的药品检索方法,供同行交流探讨。
本文不仅仅提供信息检索途径,也是提供一种检索思维,希望对大家有所帮助。
一、翻译各国药品查询,语言是一大障碍,先推荐几个本人常用的翻译工具,根据需要自行选择:1、谷歌在线翻译(没被禁止,翻译速度挺快);1965年4月8日,法国、联邦德国、意大利、荷兰、比利时和卢森堡6国在比利时首都布鲁塞尔又签署《布鲁塞尔条约》,1967年7月1日,《布鲁塞尔条约》生效,欧共体正式诞生;1973年英国、丹麦和爱尔兰加入欧共体;1981年希腊加入欧共体;1986年葡萄牙和西班牙加入欧共体;1993年11月1日,根据内外发展的需要,欧共体正式易名为欧洲联盟;1995年奥地利、瑞典和芬兰加入欧盟;2004年5月1日,马耳他、塞浦路斯、波兰、匈牙利、捷克、斯洛伐克、斯洛文尼亚、爱沙尼亚、拉脱维亚、立陶宛10国加入欧盟;2007年1月1日,罗马尼亚、保加利亚加入欧盟;2013年7月1日,克罗地亚正式加入欧洲联盟成为第28个成员国。
三、检索药品检索首先要获得药品的商品名和活性成分名,其中商品名一般是英文即可,而活性成分名一般为各国相应语言的名称,差别一般较大,有的即使是英文,不同国家可能也会存在微小差异,所以检索时应灵活运用,综合运用检索信息。
另外,在品种相应国家的企业官网也有许多信息可供参考。
下面先提供三个获得不同国家药品商品名的途径:1、马丁代尔大典(Proprietary Preparations部分);3、西班牙官网(前提是要在西班牙上市,主要是在欧盟上市国的商品名);(一)美国FDA官网上信息量很大,有Drugs@FDA、橙皮书、BE一致性指南、非活性成分数据库、溶出数据库等等。
药品查询常用Drugs@FDA、橙皮书两个数据库。
由于美国药品查询网上已有大量分享,在此不再过多赘述。
不过注意名称问题,如绒促性素我国数据库翻译是:Chorionic Gonadotrophin,而FDA的则是CHORIONICGONADOTROPIN,所以检索前面的则是无结果,可检索Chorionic获得信息。
(二)日本日本对批准药品各种信息公开的程度是很高的。
不过药品检索需要有准确的日文名称,下面先介绍几个准确找到日文名称的方法,不过要综合运用,确保名称准确无误:1、有些老的品种可在我国CDE网站的体外溶出信息库里(日本橙溶出曲线数据库的翻译)找到日文名称:2、通过谷粉搜搜(谷歌):英文名称+日本。
这种可信度没有1、4高;点击红色方框:点击红色处方药方框:在上图设定项全部打钩。
输入日文一般名,在最下面点击以ヒト下垂体性性腺刺激ホルモン为例检索,得:点击红色方框:有说明书和IF文件,未见申报资料和报告书。
不过日本的说明书里一般不包含毒理研究资料,但是在不良反应方面一般是非常全面的。
再以リラナフタート为例检索:点击一般名进入:点击检索:点击红色方框:点击红色方框:点击红色方框:1、法国一、简介1967年7月1日,法国加入欧共体成员国。
语言为法语。
国旗为:logo为:点击红色方框:点击上图的“帮助”以了解本站相关的使用信息。
以Ovitrelle为例,检索:点击获得详细信息:有些信息,可自行查看。
2、德国一、简介1967年7月1日,德国加入欧共体成员国。
语言为德语。
国旗为:,logo为点击红色方框:点击红色方框:点击红色方框:点击红色方框:点击右下角的红色方框:以Targocid为例检索,点击方框的los:点击红色方框:点击:3.意大利一、简介1967年7月1日,意大利成为首批进入欧共体的6国成员之一,语言为意大利语。
国旗为,logo为点击红色方框进入点击红色方框,进入以Simeticone为例,检索活性成分,未检索到,如下:点击红色方框,输入simeticone,得下图。
有PIL、SPC等信息,点击进入查看详细信息。
下图蓝色方框,为本品意大利语,重复上面的检索。
见下图:有不同剂型的商品名,同马丁代尔大典的基本吻合。
如下点进去查找先关信息。
另外,点击上图绿色方框的公开数据:点击“药物清单数据”:等等,下面还有一些,不一一列举,根据需要自己查看。
4.荷兰一、简介1967年7月1日,荷兰成为首批欧共体成员国之一。
语言为荷兰语。
国旗为,logo为点击上面的红色方框,再点击Voor mensen(人用),或者点击下面的2个红色方框,再点击胶囊/片剂形状图标进入以Chorionic Gonadotrophin为例(英文商品名、API名均可),本品在荷兰有多个商品名(Choragon; Ovitrelle; Pregnyl; Profasi),一一检索。
以Choragon为例,结果如下:点击红色方框进入,得:获得PDF文件。
5、比利时一、简介1967年7月1日,比利时成为首批欧共体成员国之一。
比利时是西欧的一个联邦国家,首都为布鲁塞尔,欧盟总部所在地。
官方语言为法语、荷兰语和德语。
全国划分为法语区、荷兰语区、德语区和布鲁塞尔首都法荷语双语区。
国旗为,logo为红色方框选择语言和下载PIL、SPC。
主界面:右边有,点击进入搜索英文商品名或活性成分名均可。
还以Teicoplanin 为例,点击红色方框:蓝色方框为药品分类,红色方框可下载RCP,图片中语言为法语。
6、卢森堡一、简介1967年7月1日,卢森堡成为首批欧共体成员国之一。
语言为法语、德语、卢森堡语,大小相当于国内的一个县。
国旗为,logo为进入,是比利时的药品查询地址?共用的?(百度了一下卢森堡与比利时的关系:以前这两块地方都是卢森堡大公管辖的,而卢森堡大公是由尼德兰国王代领的,所以当时的尼德兰包括现在的荷兰比利时和卢森堡。
在1830年到1839年比利时革命期间,比利时从尼德兰独立,而亲比利时的卢森堡西部地区就加入了比利时。
所以现在比利时有个省叫做卢森堡。
而剩下的半个卢森堡就变成了今天的卢森堡大公国。
)三、检索(续-欧盟2)7、英国一、简介1973年,英国加入欧共体成员国。
语言为英语。
国旗为,logo为点击下面的红色方框:点击红色方框:点击红色方框,以Senokot为例检索:点击获得PAR报告。
点击首图的第一个红色方框:点击:点击获得SPC、PIL信息。
8、丹麦一、简介1973年,丹麦加入欧共体成员国。
语言为丹麦语,第二官方语言为英语。
国旗为,logo为点击红色方框:点击红色方框获得SPC、PIL:点击下面红色方框:进入得:输入英文查询即可查看价格信息。
9、爱尔兰一、简介1973年,爱尔兰加入欧共体成员国。
语言为爱尔兰、英语。
,logo为但是,点进去老是提醒错误,不清楚什么原因,用下面的红色方框检索以Ovitrelle 为例(与输入CHORIONIC GONADOTROPHIN 检索,结果有所不同,所以检索时,可商品名/一般名同时检索获得综合信息):红色方框获得信息,蓝色方框显示有8个药品。
进入上面的仿制药与替代药方框,点击搜索:在下面点击show products或者加法号点击左边红框:信息很多,有的有PAR,里面可能会提到做BE用的参比制剂。
10、希腊一、简介1981年,希腊加入欧共体成员国。
语言为希腊语。
国旗为,logo为左上角可选择语言,点击国家处方集:点击红色方框,或者点左侧的search点击红色方框,选英文界面还以OVITRELLE为例,点击进去,有PSC、PIL、PAR、价格等很多信息,但是经国家程序批准的药品,其PDF文件为希腊语。
另外,还有一些其他信息,根据需要研究。
11、葡萄牙一、简介1986年,葡萄牙加入欧共体。
语言为葡萄牙语。
国旗为,logo为点击左下角进入药品检索:点击红色方框(挺人性化的,还有英文翻译),以Sodium Picosulfate为例搜索,未检索到,以其商品名Fructines,检索得:可见活性成分名为Picossulfato de s骴io ,以该名检索:点详细信息:12、西班牙一、简介1986年,西班牙加入欧共体。
语言为西班牙语、英语,全球约有5亿人口说西班牙语。
国旗为,logo为红色方框可选择英语,该页面右中位置点击红色方框得:选择人用药品,点击蓝色方框:以Targocid为例,查询:点击方框获得详细信息,其中有一条介绍了该品种在欧盟其它国家上市的商品名称,可与马丁代尔大典配合使用:13、奥地利一、简介1995年,奥地利加入欧盟。
语言为德语、英语。
,logo为选择英文页面,以Targocid为例检索得:14、瑞典一、简介1995年,瑞典加入欧共体成员国。
语言为瑞典语。
国旗为,logo为以Chorionic Gonadotrophin 为例,本品在瑞典有3个商品名:以Ovitrelle为例检索:点击红色方框或详细信息:三、检索(续-欧盟3)15、芬兰一、简介1995年,芬兰加入欧共体成员国。
语言为芬兰语、瑞典语。
国旗为点击方法获得相应信息。
也有其他下载SPC和PIL的方法,途径差不多,大家研究下官网即可。
16、马耳他一、简介2004年5月1日,马耳他加入欧盟。
语言为马耳他语、英语。
国旗为,logo为下载详细信息。
页面上也有其他信息,可自行了解。
17、塞浦路斯一、简介2004年5月1日,塞浦路斯加入欧盟。
语言为希腊语、土耳其语。
国旗为,logo为点击红色方框:点击红色方框的链接,界面同希腊的基本一样:以PREGNYL为例:点击获得详细信息。
18、波兰一、简介2004年5月1日,波兰加入欧盟。
语言为波兰语。
国旗为,logo为点击红色方框:以Pregnyl为例,检索:点击获得详细信息:当然,也并不是所有的品种都有这些信息,如采用IR、CEN 程序进入波兰的产品可能就没有。
另外也可以点击首张图片的绿色方框:点击波兰国旗:点击红色方框:再点击红色方框也可进入检索界面。
19、匈牙利一、简介2004年5月1日,匈牙利加入欧盟。
语言为匈牙利语。
国旗为,logo为点击:以Choragon为例检索,注意是在红色方框、蓝色方框都可以检索:就是蓝色方框网页有点慢:点击查看详细信息:有的品种还会有PAR,RMP(风险管理计划RiskManagement Plan)另,产品上市状态缩写,与常用的缩写稍有不同(以下为谷歌翻译,基本为原文拷贝过来的):TK:该产品具有有效的销售许可CTK:是由欧洲药品管理局签发,授权是在所有欧盟成员国有效。
