化学方程式PPT课件31 人教版优质课件
合集下载
化学方程式(PPT课件(初中科学)11张)

以磷在空气中燃烧生成五氧化二磷的反应为例
写
左 (短线连接) 右
反应物化学式
生成物化学式
P + O2
P2O5
配 配平根据 质量守恒定律
配平过程 化学式前面上适当的化学
计量数使左右两边的每一种元素的原子 总数相等
配平方法 最小公倍数法、视察法、 奇偶法等
4P + 502
2P2O5
注 注明反应条件,生成物状态
化学方程式的涵义
1、表示什么物质反应生成什么物质。
2、表示各反应物、生成物之间的原子、分子个数
之比。
3、表示反应物、生成物各物质之间的质量比
以 4P + 5O2 点燃 2P2O5 为例
124 160
284
(1)表示磷和氧气反应生成五氧化二磷。
(2)表示反应物中磷原子、氧分子和生成物中五氧化
二磷分子的个数比为4∶5∶2
条件:点燃、加热(△) 状态符号:气体 沉淀
催化剂等
4P + 502 点燃 2P205
等 将短线改为等号
4P + 502 点燃 2P205
查 检查化学式是否写错,化学方程式是否配
平,条件和物质状态标注是否标了,标了是 否恰当
课堂练习1
1、铁+氧气 点燃 四氧化三铁
3Fe + O2 点燃 Fe3O4
1、1、2化学方程式
用文字表达式来表示化学反应:
A、碳在氧气中燃烧生成二氧化碳
碳+氧气 点燃 二氧化碳
B、氢气在氧气中燃烧生成水 氢气+氧气 点燃 水
文字表达式不能表示? 化学方程式的定义: 用化学式来表示化学反应的式子
C + O2 点燃 CO2
写
左 (短线连接) 右
反应物化学式
生成物化学式
P + O2
P2O5
配 配平根据 质量守恒定律
配平过程 化学式前面上适当的化学
计量数使左右两边的每一种元素的原子 总数相等
配平方法 最小公倍数法、视察法、 奇偶法等
4P + 502
2P2O5
注 注明反应条件,生成物状态
化学方程式的涵义
1、表示什么物质反应生成什么物质。
2、表示各反应物、生成物之间的原子、分子个数
之比。
3、表示反应物、生成物各物质之间的质量比
以 4P + 5O2 点燃 2P2O5 为例
124 160
284
(1)表示磷和氧气反应生成五氧化二磷。
(2)表示反应物中磷原子、氧分子和生成物中五氧化
二磷分子的个数比为4∶5∶2
条件:点燃、加热(△) 状态符号:气体 沉淀
催化剂等
4P + 502 点燃 2P205
等 将短线改为等号
4P + 502 点燃 2P205
查 检查化学式是否写错,化学方程式是否配
平,条件和物质状态标注是否标了,标了是 否恰当
课堂练习1
1、铁+氧气 点燃 四氧化三铁
3Fe + O2 点燃 Fe3O4
1、1、2化学方程式
用文字表达式来表示化学反应:
A、碳在氧气中燃烧生成二氧化碳
碳+氧气 点燃 二氧化碳
B、氢气在氧气中燃烧生成水 氢气+氧气 点燃 水
文字表达式不能表示? 化学方程式的定义: 用化学式来表示化学反应的式子
C + O2 点燃 CO2
人教版化学方程式复习课件

(选填“含有”、“不含有”、“可能含有”)。
(2)4.6g某物质在空气中完全燃烧生成8.8g CO2和 5.4gH2O,通过计算,该物质 含有 碳元素, 含有氢元素, _含_有__氧元素。(以上三空选填“含有”、“不含有”、
“可能含有”)。其中碳元素 2.4 g,氢元素0.6 g,氧元
素 1.6 g。
“一个可能变”:
分子的总数目可能变。
2H2+O2 2H2O H2+Cl2 2HCl
【例1】判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)根据质量守恒定律,1L氢气和1L氧气反应生成2L水。
( ×)
(2)10g水蒸发变成10g水蒸气符合质量守恒定律。(
×)
(3)蜡烛完全燃烧后,蜡烛没有了,这违背了质量守恒定律。
大家有疑问的,可以询问和交流
可以互相讨论下,但要小声点
8
【练习2】根据2CH3OH+3X+4NaOH=2Na2CO3+6H20, 推求X的化学式为( A )
A.O2
B.CO
C.CO2
D.H2
【练习3】a克过氧化氢溶液和b克二氧化锰混合, 待完
全反应后得c克残余物,则生成氧气的质量为( B )
A. (a-c)克
三、有关化学方程式的计算 1.计算依据 ①质量守恒定律:反应物质量总和等于生成物质 量总和;
②方程式中各物质的质量之比等于它们的相对分 子质量与化学计量数乘积之比
2.计算步骤:“设、方、关、比、算、答”。
【例7】已知化学反应:2A+B=2C+D,当10gA 和8gB恰好完全反应后,生成6gC。如果要得到
注意:
①反应物无气体,而生成物有 气体的,需要在生成物气体物质的化 学式右边标“↑”。②在溶液中的反 应,如果反应物没有固体,生成物有 固体,需要在生成物固体物质的化学 式右边标“↓”。③配平化学方程式 时不能改动化学式右下角的数字。
人教版初中化学《化学方程式》ppt

完善假设:
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
3.完成白磷燃烧前后质量的测定、氢氧化钠与硫酸 铜反应前后质量的测定实验,验证假设,提出质量守恒定 律。
4.为什么物质在发生化学反应前后,各物质的质量 总和相等?用分子和原子的知识加以分析。
实验一定要用到什么仪器?___天__平___。 实验中需称量几次?___至__少__3_次___。 此实验是为了证明参加反应的各物质的质量总和与 反应后生成物的质量总和的关系,因此你对设计的实验装 置有何要求? ___装__置__密__封__性__要__好___
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
人教版初中化学《Biblioteka 学方程式》ppt( PPT优 秀课件 )
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
生活中有这样的现象:如蜡烛燃烧后就没了;铁生锈后变 重了等等。那么化学反应前后各物质的质量总和到底有没 有变化呢?
请提出你的猜想:__化__学__反__应__前__后__各__物__质__的__质__量__总__和__ _保__持__不__变____。
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
2.用分子和原子的知识解释化学反应的微观本质: _化__学__反__应__的__微__观__本__质__是__分__子__拆__分__成__原__子__,__原__子__重__新__组_____ _合__,__形__成__新__的__分__子____。
5.联系生活实际,利用质量守恒定律知识解释一些 现象。
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
3.完成白磷燃烧前后质量的测定、氢氧化钠与硫酸 铜反应前后质量的测定实验,验证假设,提出质量守恒定 律。
4.为什么物质在发生化学反应前后,各物质的质量 总和相等?用分子和原子的知识加以分析。
实验一定要用到什么仪器?___天__平___。 实验中需称量几次?___至__少__3_次___。 此实验是为了证明参加反应的各物质的质量总和与 反应后生成物的质量总和的关系,因此你对设计的实验装 置有何要求? ___装__置__密__封__性__要__好___
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
人教版初中化学《Biblioteka 学方程式》ppt( PPT优 秀课件 )
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
生活中有这样的现象:如蜡烛燃烧后就没了;铁生锈后变 重了等等。那么化学反应前后各物质的质量总和到底有没 有变化呢?
请提出你的猜想:__化__学__反__应__前__后__各__物__质__的__质__量__总__和__ _保__持__不__变____。
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
2.用分子和原子的知识解释化学反应的微观本质: _化__学__反__应__的__微__观__本__质__是__分__子__拆__分__成__原__子__,__原__子__重__新__组_____ _合__,__形__成__新__的__分__子____。
5.联系生活实际,利用质量守恒定律知识解释一些 现象。
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
人教版初中化学《化学方程式》ppt( PPT优 秀课件 )
《化学方程式》化学反应的定量关系PPT课件(第1课时)

探究新知
当反应物没有气体参加,而生成物有气体时, 在生成气体的化学式右边要注“↑”号。
2KMnO4 K2MnO4+MnO2+O2
点燃
C + O2
CO2
探究新知
溶液中的反应,如果反应物没有固体,生成物中 有固体时,在生成固体的化学式右边要注“↓”号。
2NaOH + CuSO4 ═ Na2SO4 + Cu(OH)2 溶液 固体
探究新知
木炭在氧气中燃烧生成二氧化碳的反应 可以用文字表示为
碳 + 氧气
点燃 二氧化碳
探究新知
“和 ”
“反应条件 ”
“生成 ”
碳 + 氧气
点燃 二氧化碳
反应物
生成物
探究新知
C OO
OCO
点燃
C + O2
CO2
12 : 16 ×2 : 12+16 ×2
12 : 32 :
44
探究新知
化学方程式的读法
点燃
C + O2
CO2
(1)宏观读法: 碳和氧气在点燃的条件下生成二氧化碳。
探究新知
点燃
C + O2
CO2
(2)数量读法:每12份质量的碳跟32份质量的氧
气反应生成44份质量的二氧化碳。
(3)微观读法:每1个碳原子和1个氧分子反应生
成1个二氧化碳分子。
探究新知
2 H2Hale Waihona Puke 通电 2H2↑+ O2 ↑
归纳总结
小结:在化学式前添加适当的数字(化学计量数), 使等号两边各原子的总数都相等,这叫化学方程式 的配平。
探究新知
【活动与探究】: 配平的方法
5.2化学方程式 课件-人教版九年级化学上册
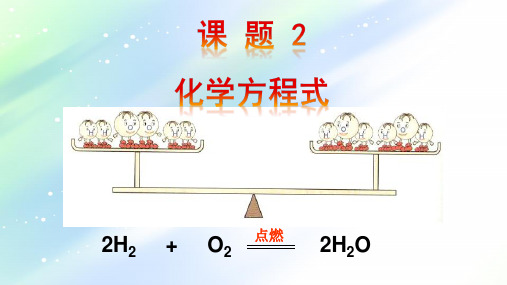
化学方程式: C +
氧气 点燃 二氧化碳
反应条件 生成
O2 点燃
CO2
如: 3Fe + 2O2 点燃 Fe3O4
2KMnO4
K2MnO4 + MnO2 + O2
质这的是含什义么:式碳子和?氧它气可在以点提燃供条件下
化 哪些信息?反它应怎生么成读二呢氧? 化碳
学
方 程
C + O2 点燃 CO2
微观含义; 每一个
C + O2点燃 CO2 反应物:C、O2。生成 物:CO2。条件:点燃
C + O2点燃 CO2
12 :16×2 :12+16×2
12 : 32 : 44
C + O2点燃 CO2
1 :1 : 1
1、所有的化学反应必须遵守 质量守恒 定律? 为什么质量会守恒呢? 在化学反应中,反应前后原子的种类没有改变, 数目没有增减,原子的质量也没有改变。
生成物的化学 式书写错误
2. H2O 通电 H2↑ + O2↑
没有配平
3. Fe+CuSO4
Cu↓+ FeSO4
不应该标生 成物的状态
4. 2KMnO4 Δ K2MnO4+ MnO2+ O2
未标明气 体的状态
点燃
5. Mg+ O2 Mg2O
不应该在化学 式中间配平
6. 4H2O2 MnO2 4H2O+2O2
③ 化学计量数1可以省略不写,各化学式前的计量数 必须是最简整数比。
课堂练习:配平铁在氧气中燃烧生成四氧化三铁的
化学方程式。
点燃
3 Fe +2 O2
Fe3O4
(1)观察法
氧气 点燃 二氧化碳
反应条件 生成
O2 点燃
CO2
如: 3Fe + 2O2 点燃 Fe3O4
2KMnO4
K2MnO4 + MnO2 + O2
质这的是含什义么:式碳子和?氧它气可在以点提燃供条件下
化 哪些信息?反它应怎生么成读二呢氧? 化碳
学
方 程
C + O2 点燃 CO2
微观含义; 每一个
C + O2点燃 CO2 反应物:C、O2。生成 物:CO2。条件:点燃
C + O2点燃 CO2
12 :16×2 :12+16×2
12 : 32 : 44
C + O2点燃 CO2
1 :1 : 1
1、所有的化学反应必须遵守 质量守恒 定律? 为什么质量会守恒呢? 在化学反应中,反应前后原子的种类没有改变, 数目没有增减,原子的质量也没有改变。
生成物的化学 式书写错误
2. H2O 通电 H2↑ + O2↑
没有配平
3. Fe+CuSO4
Cu↓+ FeSO4
不应该标生 成物的状态
4. 2KMnO4 Δ K2MnO4+ MnO2+ O2
未标明气 体的状态
点燃
5. Mg+ O2 Mg2O
不应该在化学 式中间配平
6. 4H2O2 MnO2 4H2O+2O2
③ 化学计量数1可以省略不写,各化学式前的计量数 必须是最简整数比。
课堂练习:配平铁在氧气中燃烧生成四氧化三铁的
化学方程式。
点燃
3 Fe +2 O2
Fe3O4
(1)观察法
《化学方程式》PPT优质课件

③表示各物质之间粒子个数比
即化学式前面的系数比(计量数)
请写出4P + 5O2 点燃 2P2O5 表示的意义
(1)磷和氧气在点燃的条件下反应生成五氧化二磷; (2)参加反应的磷、氧气、五氧化二磷的分子个数比 是4:5:2; (3)每124份质量的磷与160份质量的氧气恰好完全反 应,生成284份质量的五氧化二磷。
4.化学方程式的读法
点燃
C + O2
CO2
③读出反应物和生成物的各粒子个数比
每1个碳原子与1个氧分子反应,生成 1个二氧化碳分子
粒子个数比即化学式前 面的化学计量数之比
氧化铜与氢气在加热条件下反应: CuO+H2 △ Cu+H2O
宏观:氧化铜和氢气加热生成铜和水
微观:一个氧化铜分子和一个氢分子加热生成一个铜原子和 一个水分子
2.化学方程式的表示方法
“与”“反应条件”
C + O2 点燃 CO2
反应物 “生成”生成物
化学方程式表示的意义
表示反应物、 生成物和反应 条件
表示各物质之 间的质量比
表示参加反应 的各粒子的相 对数量
3.化学方程式提供的信息
①表示反应物、生成物及反应条件
②表示反应物、生成物各物质的质量比
即化学式的相对分子质量×前面的系数所得的值之比 C + O2 点燃 CO2 12 : 16×2 : 12+16×2 12 : 32 : 44
1.碳在氧气中燃烧生成二氧化碳 语言表达
2.碳+氧气 点燃 二氧化碳 文字表达式
3.C+O2点燃 CO2
化学方程式
反应条件
反应物
生成物
碳 + 氧气 点燃 二氧化碳
化学方程式的简单计算PPT课件 人教版
3)在反应X+2Y =R+2M中,当1.6克的X与Y完全反应后生成4.4克的R,且生成物R和M 的质量比是11:9 ,则在此反应中Y和M的质量比是( )
16:9
1)在化学反应中A+B2=AB2的质量关系如图,将8克的A与10克的B 2充分反应,则生成AB2的质量—— 16
消耗B2的质量( 克)
10
A H 2和 N 2 B O 2和 N 2 C H 2、 O 2 和 N 2 D N2 11克
4)3克的碳和10克的氧气反应,求生成二氧化碳的质量?
1)下列六个化学方程式,用序号回答: ⑴ 4Fe+O2=2Fe2O3 ⑵ S+O2 = SO 2 ⑶ CH4 +2 O2 = CO2 + 2H2O 高温 ⑷ C+CuO=Cu+CO2 ⑸ Zn+H2SO4 = ZnSO4+H2 ⑹ 2NaOH+CuSO4 =Cu(OH)2+Na2SO4
1)化学式书写错误的是(
点燃
1 4
)
2)“ ” 或 “
” 使用不当的是( 3 、6 ) )
3)化学方程式未配平的是( 4)没有注明反应条件的是(
23 ) 5
)
5)化学方程式书写完全正确的是(
2)已知在反应中3A+2B=2C+D中,反应物A、B的质量比为3:4.当反应生成C和D的质 量共140克时,消耗B的质量是(80克 )
4、有一种含有水的过氧化氢样品10g,在二氧化 锰的催化作用下,完全分解得到3.2g氧气,试求过 氧化氢样品中过氧化氢的质量 分数? 68%
5、在反应4A+3B==2C中,若2.7gA完全反 应生成 5.1 g的C.已知B的相对分子质量为 32,则C的相对分子质量为( C ) A、34 B、68 C、102 D 、204
《化学方程式》PPT课件(公开课)2022年人教版 (8)
所以,反应前后各物质的质量总和必然相等。
3、质量守恒定律中的变和不变:
元素种类不变;
元素质量不变;
宏观
六不变
物质总质量不变; 原子种类不变;
原子数目不变;
微观
原子质量不变;
两改变
物质的种类改变; 分子的种类改变;
4、根据质量守恒定律解释一些实验现象:
镁条在空气中燃烧后,生成的白色粉末的 质量比原来镁条的质量增加,这符合质量守恒 定律吗?
离子 H+ Na+ Ca2+ Ba2+ Cu2+ Ag+
OH—— 溶 微溶 溶 不溶 ____
NO3-
Cl-
溶,挥 溶,挥
溶
溶
溶
溶
溶
溶
溶
溶
溶 不溶
SO42溶 溶 微溶 不溶 溶 微溶
CO32溶,挥
溶 不溶 不溶 不溶 不溶
写一写化学方程式:
1.铁与硫酸铜的反应
Fe + CuSO4 = FeSO4 + Cu 2.实验室制取二氧化碳
()
B
A、原子种类
B、分子个数
C、原子个数
D、原子质量
2、参加反应的各物质质量总和等于反应后生成的
各物质质量总和。是因为
( )C
A.反应后物质的种类没有变化
B.反应后分子的种类没有变化
C.反应后原子的种类、数目和质量没有变化
D.反应后分子的种类、数目和质量没有变化
3、根据质量守恒定律可以推知,铁丝在氧气中燃
3、经历归纳盐的性质的探究过程,发展学生热爱科学的情感和 学习化学的兴趣。
重点:盐的性质 复分解反应
难点:复分解反应
三、教法和学法
3、质量守恒定律中的变和不变:
元素种类不变;
元素质量不变;
宏观
六不变
物质总质量不变; 原子种类不变;
原子数目不变;
微观
原子质量不变;
两改变
物质的种类改变; 分子的种类改变;
4、根据质量守恒定律解释一些实验现象:
镁条在空气中燃烧后,生成的白色粉末的 质量比原来镁条的质量增加,这符合质量守恒 定律吗?
离子 H+ Na+ Ca2+ Ba2+ Cu2+ Ag+
OH—— 溶 微溶 溶 不溶 ____
NO3-
Cl-
溶,挥 溶,挥
溶
溶
溶
溶
溶
溶
溶
溶
溶 不溶
SO42溶 溶 微溶 不溶 溶 微溶
CO32溶,挥
溶 不溶 不溶 不溶 不溶
写一写化学方程式:
1.铁与硫酸铜的反应
Fe + CuSO4 = FeSO4 + Cu 2.实验室制取二氧化碳
()
B
A、原子种类
B、分子个数
C、原子个数
D、原子质量
2、参加反应的各物质质量总和等于反应后生成的
各物质质量总和。是因为
( )C
A.反应后物质的种类没有变化
B.反应后分子的种类没有变化
C.反应后原子的种类、数目和质量没有变化
D.反应后分子的种类、数目和质量没有变化
3、根据质量守恒定律可以推知,铁丝在氧气中燃
3、经历归纳盐的性质的探究过程,发展学生热爱科学的情感和 学习化学的兴趣。
重点:盐的性质 复分解反应
难点:复分解反应
三、教法和学法
中考科学总复习第31讲质量守恒定律及化学方程式(精讲)(课件31张)
气体的质量大于实验二,所以实验二中稀盐酸有剩余,8 g样品已
完全反应 。
(2)表中的m值为 152.9 。
(3)根据实验二中的数据计算样品中Na2CO3的质量分数。 (3)解:根据质量守恒定律可得,生成的二氧化碳的质量为
150 g+8 g-155.8 g=2.2 g
设参加反应的碳酸钠的质量为x
Na2CO3+2HCl===2NaCl+H2O+CO2↑
已知实验中产生的化学反应: NaOH+HCl===NaCl+H2O Na2CO3+2HCl===2NaCl+H2O+CO2↑
(1)分析表中数据,写出判断实验二中的样品已完全反应的理由: 实验三产生的气体的质量为150 g+12 g-158.7 g=3.3 g,实验二
产生的气体的质量为150 g+8 g-155.8 g=2.2 g,实验三产生的
03 实验突破
验证质量守恒定律
返回
【知识拓展】 1.实验误差分析 任何化学反应都遵守质量守恒定律,如果在探究质量守恒定律时, 反应前后质量产生了改变,可能原因有: (1)有气体物质参加了反应; (2)有气体(或固体)生成物逸散到空气中去了; (3)反应后,气球胀大,造成气球所受空气的浮力增大等。 2.实验评价: 探究质量守恒定律时,评价实验设计是否合理,主要看以下几点: (1)所选物质是否产生化学反应; (2)所用装置是否密闭; (3)如果有物质燃烧,是否有气体缓冲装置; (4)产物是否污染空气等。
度到达可燃物着火点 ;玻璃管受热不燃烧,白磷受热能燃烧,可 知燃烧的条件是 可燃物 。 (3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针
向左偏 (填“向左偏”“向右偏”或“指向中间”)。 (P4)4白+磷5O(P2 4)燃烧2P生2O成5 P2O。5,写出该反应的化学方程式:
3.3化学方程式(第1课时)(PPT课件(初中科学)21张)
1、反应物是铁和氧气,生成物是四氧化三铁。 2、反应物在点燃的条件下进行反应。 3、各物质的分子(金属单质为原子)的个数比为3:2:1。 4、反应物、生成物各物质的质量比为21:8:29。
质的意义 反应物、生成物和反应条件
量的意义 各物质的分子或原子个数比 各物质的质量比
如何来读化学方程式呢?
点燃
课堂测评
2、关于化学方程式S+O2↑ ══ SO3中出现的错误,下列表述中
不正确的是( A )
A.反应物的化学式有误 B.气体符号标注有误 C.生成物的化学式有误 D.反应条件有误
课堂测评
3、配平下列化学方程式。
(1)C+CO2 高温 CO
高温
C+CO2 ═══ 2CO
(2)CH4+O2 点燃 CO2+H2O
【练习】按要求填空。
(1)化学式书写错误的是____②__④__⑥________; (2)未注明或注错反应条件的是___③_________; (3)没有配平的是___②__⑤_______; (4)“↓”或“↑”使用不恰当的是_____①__③_____。
3、化学方程式的配平方法
配平就是在化学方程式左右两边的化学式前面,配上适当 的化学计量数,使式子两边每一种元素的原子总数相等。
计量数。
点燃
2Mg+ O2═══ 2 MgO
奇数配偶法
奇数配偶法适用于化学方程式两边某一元素多次出现,并 且两边的元素原子总数有一奇一偶。
点燃
4FeS2+ 11O2═══ 2Fe2O3+ 8 SO2
课堂测评
1、下列有关书写化学方程式的原则或步骤的叙述中错误的
是( D )
A.必须遵循质量守恒定律 B.一定要注明反应条件 C.要注明生成物的状态(气体、沉淀) D.在化学方程式配平的过程中,需要改动化学式中元素符 号右下角的数字,这样可以使配平容易些
质的意义 反应物、生成物和反应条件
量的意义 各物质的分子或原子个数比 各物质的质量比
如何来读化学方程式呢?
点燃
课堂测评
2、关于化学方程式S+O2↑ ══ SO3中出现的错误,下列表述中
不正确的是( A )
A.反应物的化学式有误 B.气体符号标注有误 C.生成物的化学式有误 D.反应条件有误
课堂测评
3、配平下列化学方程式。
(1)C+CO2 高温 CO
高温
C+CO2 ═══ 2CO
(2)CH4+O2 点燃 CO2+H2O
【练习】按要求填空。
(1)化学式书写错误的是____②__④__⑥________; (2)未注明或注错反应条件的是___③_________; (3)没有配平的是___②__⑤_______; (4)“↓”或“↑”使用不恰当的是_____①__③_____。
3、化学方程式的配平方法
配平就是在化学方程式左右两边的化学式前面,配上适当 的化学计量数,使式子两边每一种元素的原子总数相等。
计量数。
点燃
2Mg+ O2═══ 2 MgO
奇数配偶法
奇数配偶法适用于化学方程式两边某一元素多次出现,并 且两边的元素原子总数有一奇一偶。
点燃
4FeS2+ 11O2═══ 2Fe2O3+ 8 SO2
课堂测评
1、下列有关书写化学方程式的原则或步骤的叙述中错误的
是( D )
A.必须遵循质量守恒定律 B.一定要注明反应条件 C.要注明生成物的状态(气体、沉淀) D.在化学方程式配平的过程中,需要改动化学式中元素符 号右下角的数字,这样可以使配平容易些
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(三)应用
1. 进行有关的计算 2. 推测一些物质的组成 3. 解释一些实验事实
质量守恒定律适用于一切化学反应
二、化学变化的表示方法 木炭在空气中燃烧
碳+ 氧气 点燃
点燃
C + O2
点燃
C + O2
二氧化碳 C O2 C O2
(一)化学方程式的定义
用化学式表示化学反应的式子
(二)意义
点燃
C+
O2
C O2
1.质的意义
表示反应物、生成物、反应条件是什么
2.量的意义
表示反应物、生成物之间的质量比
(三)书写原则
1、以客观事实为依据 2、遵循质量守恒定律
(四)、书写步骤
1.写反应物和生成物的化学式
水电解的化学方程式
左
(短线连接)
右
反应物化学式
生成物化学式
H2O
H2 + O2
2.配平化学方程式,
点燃
2Mg + O2 ====== 2 Mg O
2×24 :16×2 : (24+16)×2
48 : 32 :
80
若: 48克 : ( )克 : ( ) 克
若:( )克 : ( )克 : 4 0 克
(二)例题分析
[例题]:3g镁在氧气中充分燃烧,可以生成多少g氧化镁?
解:设可生成氧化镁的质量为X (1)设未知量 …设
书写步骤
写 写出反应物和生成物的化学式 配 配平化学方程式 注 注明条件,生成物状态 等 将短线改为等号
练一练 1
1.铝箔燃烧
点燃
4Al + 3O2
2Al2O3
2.实验室用过氧化氢制取氧气
MnO2
2 H2O2
2 H2O
+
O2
3.高锰酸钾受热分解
2 KMnO4 Δ
K2MnO4 + MnO2 + O2
4 、成功离你很近,只要再多一点点坚持,你就会尝到胜利的果实。 10 、要想壮志凌云,就须脚踏实地。 7 、对生命而言,接纳才是最好的温柔,不论是接纳一个人的出现,还是,接纳一个人的从此不见。 13 、不要等待机会,而要创造机会;没有天生的信心,只有不断培养的信心。只有一条路不能选择--那就是放弃的路;只有一条路不能拒绝--那就是成长的路。态度决定高度,高度决定命运。对自己 要狠一点,再狠一点,因为,你要的比别人多,就必须付出得比别人多…
配平依据 质量守恒定律
配平过程 化学式前面配上适当的化学计量 数使左右两边的每一种元素的原子总 数相等。
配平方法
观察法、最小公倍数法等等
化学方程式的配平方法
1、观察法
点燃
S + O2
SO2
2、最小公倍数法:利用反应前后某一元素原子
数的最小公倍数加以配平的方法。
点燃
4 P +5 O 2
2 P2O5
注:化学式前的化学计量数是最简整数比
36
4
32
1、水在通电条件下生成氢气和氧气
2、两个水分子在通电条件下生成两个氢分 子和一个氧分子 3、每36份质量的水在通电的条件下生成4份 质量的氢气和32份质量的氧气
三、化学变化中的定量计算
(一)计算的依据
化学方程式具有量的意义
通电
2H2O = 2H2↑ + O2↑
36
4
32
360g
镁在空气中燃烧反应中,反应物与生成物之间的质量比
练一练 2
指出下列化学方程式的错误之处,说明原因
点燃
(1)Mg + O2
MgO2 ( 生成物的化学式书写错误)
通电
(2) H2O
H2↑+ O2↑
(没有配平)
Δ (3) 2KMnO4 K2MnO4+ MnO2+ O2
(未标明气体的状态)
(五)读法
1.宏观读法 2.微观读法
3.质量读法
通电
2H2O = 2H2↑+ O2↑
练 习 配 平:
2 KClO3
MnO2
Δ 2 KCl+ 3 O2
3 Fe + 2 O2
点燃 Fe3O4
点燃
CH4 + 2 O2
C O2 + 2 H2O
3.注明化学反应条件、生成物的状态
如:(点燃、加热“Δ”、催化剂等)
(生成的气体用“↑”、沉淀用
4.把“短↓线”改)成等号。
2 H2O 通电 2 H2↑ + O2↑
点燃
2 Mg + O 2 ====== 2 Mg O (2)写出化学方程式…方
48
80
3g
X (3)标出相关的量…量
48 ------
=
3--g----
80 X
(4) 列比例式,求解….比
X = -8-0--×---3-g---- ….. …... ………………算 48
=5g
答:3g镁在氧气中充分燃烧可生成氧化镁 5 g
第3节 化学方程式1
一、质量守恒定律
(一)内容
参加化学反应的各物质的质量 总和等于反应后生成的各物质的质 量总和。
(二)原因
原子种类 原子数目 原子质量
反应前后没有改变
宏观
微观
物 质 的 总 质
元素种类 不 原子种类
原子数目元素质量 变 原子量量物质的种类 改变 分子的种类
可能 改变
分子的数目
(5) 简明地写出答案….答
18 、成功就是坚韧不拔,直到成功,靠的都是强烈的成功欲望!“,by松下幸之助。---我可以说我接触过无数成功人士。凡是大成之人,都有这种坚韧不拔的好胜心和成功欲望。钱对他们来说只是 竞争过程中的一小部分,真正吸引他们的还是成功以及其带来的满足感和影响力! 10 、庸人的缺点就在于不能控制自己的感情,容易失去理智,而成功者则善于把握这个尺度,谨慎处事。 7 、只要厄运打不垮信念,希望之光就会驱散绝望之云。 5 、每个人都有美好的梦想,只有坚持,你的梦想才能实现。 2 、把汗水变成珍珠,把梦想变成现实! 19 、最有希望得成功者,并不是才干出众的人,而是那些最善于利用时机去努力开创的人。 8 、每朵花都有盛开的理由。 8 、永远别渴望做个任何人都不得罪的人,有人反对,有人支持,然后自己做出决定才是精彩的人生。 13 、如果有天我们湮没在人潮中,庸碌一生,那是因为我们没有努力要活的丰盛。 12 、面对命运不妥协,面对困难不退缩,这样才能做自己的英雄。 15 、生命对某些人来说是美丽的,这些人的一生都为某个目标而奋斗。 13 、在现在这个知识大爆炸的年代里,谁不继续学习,谁必将被社会淘汰,只有不断地为自己充电,才能在竞争中立于不败之地。 6 、遇难心不慌,遇易心更细。 6 、我相信,无论今后的道路多么坎坷,只要抓住今天,迟早会在奋斗中尝到人生的甘甜。抓住人生中的一分一秒,胜过虚度中的一月一年! 8 、成功不是将来才有的,而是从决定去做的那一刻起,持续累积而成。 3 、尊严来自实力,实力来自拼搏! 8 、我自信,我出色:我拼搏,我成功! 10 、每个人都有孤独的时候。要学会忍受孤独,这样才会成熟起来。年轻人到了一个陌生环境,面对形形色色的人和事,一下子不知所措,有时连倾心说话的地方也没有。这时,千万别浮躁, 学会静心,学会忍受孤独。在孤独中思考,在思考中成熟,在成熟中升华。不要因为寂寞乱了方寸,去做无聊的事,白白浪费时间。
