生理盐水中氯化钠含量的测定(银量法) 实验报告
银量法测定烧碱中Nacl的含量论文

目录摘要┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄2一、前言┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄21、烧碱中Nacl的介绍┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄2、Nacl的测定方法┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄3、国内外相关研究方法┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄二、实验部分┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄1、原理┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄2、仪器┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄3、试剂┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄4、试样的准备┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄5、操作程序┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄6、结果的计算和表示方法┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄三、分析方法研究┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄1、莫尔法┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄2、法扬司法┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄3、佛尔哈德法┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄四、样品分析┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄1、样品的测定┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄2、精密度和回收率┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄五、结论┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄参考文献┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄致谢┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄银量法测定烧碱中Nacl的含量xxxxxx专业[摘要]随着科学技术的不断进步,人们对产品质量的要求越来越严格。
产品中存在的某杂质指标,也越来越受到重视。
沉淀滴定法—生理盐水中氯化钠含量测定(分析化学课件)

中生理盐水中氯化钠的含量测定 一、实验仪器及试剂 实验仪器:酸式滴定管(25mL) 移液管(25mL) 锥形瓶(250mL)
试剂: 0.1mol/LAgNO3溶液 K2CrO4溶液(50 g/L) 生理盐水
生理盐水中氯化钠含量测定 二、测定步骤
将生理盐水稀释1倍后,用移液管精确移取已稀 释的生理盐水25mL置于锥形瓶中,加1mLK2CrO4 溶液,在不断摇动下,用AgNO3滴定液滴定至溶液 呈砖红色即为终点。
.44 g/mol
生理盐水中氯化钠含量测定 注意事项
ü 滴定必须在中性或弱碱性溶液中进行。 ü 滴定时要注意滴定速度并充分摇动。 ü AgNO3试剂及其溶液具有腐蚀性,能破坏皮
肤组织,注意切勿接触皮肤及衣服。
生理盐水中氯化钠含量测定 三、数据处理
记录项目
生理盐水中NaCl含量 测定
次序
滴定液浓度c(mo1/L) 消耗滴定液体积V(mL)
NaCl含量(g/L) NaCl平均含量(g/L)
相对偏差
1
2
0.1003
19.50
19.30
9.14
9.05
9.09
0.5%
NaCl
c AgNO3
VAgNO3 M NaCl 1
生理盐水中氯化钠含量的测定(银量法) 实验报告

实验二十三 生理盐水中氯化钠含量的测定(银量法)一、实验目的(1)学习银量法测定氯的原理和方法;(2)掌握莫尔法的实际应用。
二、实验原理银量法是指以生成难溶银盐(如、、和)的反应为基础的沉AgCl AgBr AgI AgSCN 淀滴定法成为银量法。
银量法需要借助指示剂来确定滴定终点。
根据作用指示剂的不同,银量法又分为莫尔法。
佛尔哈德法和法扬司法。
本实验是在中性溶液中以为指示剂(莫尔法),用标准溶液来测定的42CrO K 3AgNO -Cl 含量:(白)↓=+-+AgCl Cl Ag (砖红色)↓=++42-24CrO Ag CrO Ag 由于的溶解度小于,沉淀将首先从溶液中析出。
根据分布沉淀原AgCl 4AgCrO AgCl 理进行的计算表明,开始沉淀时已定量沉淀,稍一过量,即与4AgCrO AgCl 3AgNO 离子生成砖红色沉淀,指示终点到达。
-24CrO 实验过程中,应注意以下两点:(1)应控制好指示剂的用量。
因为用量太大时使终点提前到达导致负误差,而用42CrO K 量太小时终点拖后导致正误差。
(2)应控制好溶液的酸度。
因为离子在水溶液中存在下述平衡,-24CrO ⇌+-+O H CrO 324OH HCrO 24+-酸性太强,平衡右移,导致离子浓度下降和终点拖后。
但在碱性太强的溶液中,-24CrO 离子又会生成沉淀:+Ag O Ag 2 ↓=+-+AgOH 2OH 2Ag 2 OH O Ag AgOH 222+↓=所以莫尔法要求溶液的pH 值在6.5~10.5之间。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂仪器:烧杯,电子分析天平,容量瓶(100mL ),坩埚,煤气灯,锥形瓶(250mL ),酸式滴定管(50mL ),移液管(25mL )。
试剂:(s ,A.R.),(s ,A.R.),(5%)溶液,生理盐水样品。
3AgNO NaCl 42CrO K 四、实验步骤1.0.1mol/L 标准溶液的配制3AgNO 标准溶液可直接用分析纯的结晶配制,但由于不稳定,见光3AgNO 3AgNO 3AgNO 易分解,故若要精确测定,则要基准物来标定。
生理盐水中NaCl测定

• 1 学习莫尔法测定氯的原理与和方法。 • 2 掌握莫尔法的实际应用。 • 3 实验数据记录与处理。
二 实验原理
• 本实验是在中性溶液中以K2CrO4为指示剂,用 AgNO3标准溶液进行滴定。由于AgCl的溶解度比 Ag2CrO4小,因此溶液中首先析出AgCl沉淀,当 AgCl定量沉淀后,稍过量的AgNO3溶液即与 CrO42-生成砖红色Ag2CrO4沉淀,指示到达终点。 • Ag﹢+ Clˉ → AgCl ↓ (白) • Ag﹢+ CrO4ˉ → Ag2CrO4 ↓ (砖红色)
• (2)间接配制 将氯化钠置于坩埚中,用煤气灯加热至 500~600°C干燥后,冷却,放置在干燥器中 冷却备用。 用台秤称量1.7g的AgNO3,定量转移100ml容 量瓶中,用水稀释至刻度,摇匀。 (3)标定 准确称取0.15~0.20g的NaCl 三分,分别置于三 个锥形瓶中,各加25ml水使其溶解,加1ml K2CrO4溶液,在充分摇动下,用AgNO3溶液 滴定至溶液刚出现稳定的砖红色,记录 AgNO3溶液的用量,并计算AgNO3浓度。
项目 NaCl 的质量,g AgNO3终读数,ml AgNO3初读数,ml AgNO3消耗的体积,ml AgNO3的浓度,mol/L AgNO3的平均浓度,mol/L 相对偏差,% 1 2 3
• 2 生理盐水中NaCl 的含量测定的数据记录表。 项目 生理盐水的体积(稀释后) /ml 1 2 3
AgNO3终读数 ,ml
• 2 测定生理盐水中NaCl 的含量 将生理盐水稀释1倍后,用移液管精确移 取已稀释的生理盐水25ml,加1ml 的 K2CrO4指示剂,用标准的AgNO3溶液滴定 至溶液刚出现稳定的砖红色(边摇边滴)。平 行测定3次,计算NaCl 的含量。
生理盐水中氯化钠含量的测定

生理盐水中氯化钠含量的测定文稿归稿存档编号:[KKUY-KKIO69-OTM243-OLUI129-G00I-FDQS58-生理盐水中氯化钠含量的测定2010/10/15一、目的要求:1、学习银量法测定氯的原理和方法;2、掌握莫尔法的实际应用二、实验原理:银量法需借助指示剂来确定终点,根据所用指示剂的不同,银量法又分为莫尔法佛尔哈德法和法扬司法。
本实验在中性溶液中以K2CrO4为指示剂,用AgNO3标准溶液来测定Cl-的含量:Ag+ + Cl-= AgCl↓(白色)Ag+ + CrO42-= Ag2CrO4↓(砖红色)由于AgCl的溶解度小于Ag2CrO4的溶解度,所以在滴定过程中AgCl先沉淀出来,当AgCl定量沉淀后,微过量的AgNO3溶液便与CrO42-生成砖红色Ag2CrO4沉淀,指示出滴定的终点。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂:1)仪器:①酸式滴定管、移液管、容量瓶。
②锥形瓶(6个)、洗瓶。
③电子天平。
2)试剂:分析中,除非另有说明,限用分析纯试剂、蒸馏水或相同纯度的水。
①AgNO3②NaCl()③K2CrO4(w为0.05)溶液④生理盐水样品四、实验步骤1)0.1mol/L AgNO3标准溶液的配制:AgNO3标准溶液可直接用分析纯的AgNO3结晶配制,但由于AgNO3不稳定,见光易分解,故若要精确测定,则要基准物(NaCl)来标定。
称取1.702g AgNO3,加适量水溶解,转移到100ml容量瓶中,用水稀释至刻度线。
2)标定:准确称取0.0585g NaCl,分别置于三个锥形瓶中,各加25ml水使其溶解。
加1mlK 2CrO4溶液。
在充分摇动下,用AgNO3溶液滴定至溶液刚出现稳定的砖红色。
记录 AgNO3溶液的用量。
重复滴定二次。
计算AgNO3溶液的浓度。
表一:各物质加入质量和滴定到终点的体积24AgNO3(滴定前 ml)413.222.33)测定生理盐水中NaCl的含量:用移液管精确移取已稀释的生理食盐水25ml置于三个锥形瓶中,各加入1ml K2CrO4指示剂,用标准 AgNO3溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。
盐水中氯化钠含量测定方法的探讨
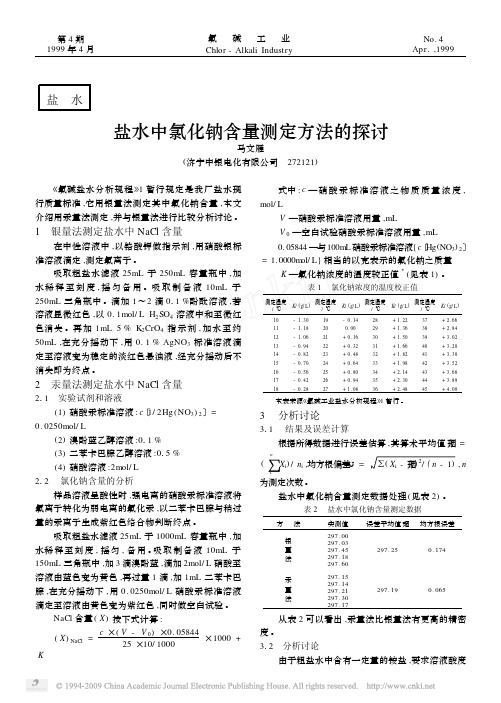
盐 水盐水中氯化钠含量测定方法的探讨马文雁(济宁中银电化有限公司 272121) 《氯碱盐水分析规程》1暂行规定是我厂盐水现行质量标准,它用银量法测定其中氯化钠含量,本文介绍用汞量法测定,并与银量法进行比较分析讨论。
1 银量法测定盐水中NaCl含量在中性溶液中,以铬酸钾做指示剂,用硝酸银标准溶液滴定,测定氯离子。
吸取粗盐水滤液25mL于250mL容量瓶中,加水稀释至刻度,摇匀备用。
吸取制备液10mL于250mL三角瓶中。
滴加1~2滴011%酚酞溶液,若溶液显微红色,以0.1mol/L H2SO4溶液中和至微红色消失。
再加1mL5%K2CrO4指示剂,加水至约50mL,在充分摇动下,用0.1%AgNO3标准溶液滴定至溶液变为稳定的淡红色悬浊液,经充分摇动后不消失即为终点。
2 汞量法测定盐水中NaCl含量211 实验试剂和溶液(1)硝酸汞标准溶液:c〔1/2Hg(NO3)2〕=0.0250mol/L(2)溴酚蓝乙醇溶液:011%(3)二苯卡巴腙乙醇溶液:015%(4)硝酸溶液:2mol/L212 氯化钠含量的分析样品溶液呈酸性时,强电离的硝酸汞标准溶液将氯离子转化为弱电离的氯化汞,以二苯卡巴腙与稍过量的汞离子生成紫红色络合物判断终点。
吸取粗盐水滤液25mL于1000mL容量瓶中,加水稀释至刻度,摇匀,备用。
吸取制备液10mL于150mL三角瓶中,加3滴溴酚蓝,滴加2mol/L硝酸至溶液由蓝色变为黄色,再过量1滴,加1mL二苯卡巴腙,在充分摇动下,用0.0250mol/L硝酸汞标准溶液滴定至溶液由黄色变为紫红色,同时做空白试验。
NaCl含量(X)按下式计算:(X)NaCl=c×(V-V0)×0.0584425×10/1000×1000+K式中:c—硝酸汞标准溶液之物质质量浓度, mol/LV—硝酸汞标准溶液用量,mLV0—空白试验硝酸汞标准溶液用量,mL0.05844—与100mL硝酸汞标准溶液{c〔Hg(NO3)2〕=1.0000m ol/L}相当的以克表示的氯化钠之质量K—氯化钠浓度的温度较正值3(见表1)。
氯化钠的含量测定(精)

氯化钠的含量测定
一、实验说明
利用氯化钠与硝酸银反应生成的氯化银胶态沉淀的吸附作用,以荧光黄为指示剂,进行测定。
每1 mL硝酸银滴定液(0.1 mol·L-1)相当于5.844 mg的NaCl。
《中国兽药典》规定,按干燥品计算,含NaCl不得少于99.5%。
通过本实验的训练,熟练掌握滴定操作技术,加深对吸附指示剂的变色原理的理解。
二、仪器与试剂
(1)仪器
电子天平,棕色酸式滴定管(50 mL),量筒(50 mL、10 mL),锥形瓶(250 mL)。
(2)试剂
氯化钠,2%糊精溶液,硝酸银滴定液(0.1 mol·L-1),荧光黄指示液。
三、测定方法
取本品约0.12 g,精密称定,加水50 mL溶解后,加2%糊精溶液5 mL与荧光黄指示液5~8滴,用硝酸银滴定液(0.1 mol·L-1)滴定,即得。
四、数据记录与报告
样品名称样品批号
天平型号仪器编号
检验依据:
滴定液名称:滴定液浓度:
测定次数 1 2 3 供试品质量,g
滴定液初读数,mL
滴定液终读数,mL
滴定液消耗体积,mL
供试品含量,%
含量平均值,%
相对平均偏差,%
含量计算公式:
标准规定:
结果判断:
检验人:复核人:
五、注意事项
自来水中的Cl- 对测定有影响,所用仪器必须用蒸馏水洗涤。
实验五 生理盐水中含氯化钠含量的测定

•
6、意志坚强的人能把世界放在手中像 泥块一 样任意 揉捏。 2020年 12月11 日星期 五上午 1时51 分56秒0 1:51:56 20.12.1 1
•
7、最具挑战性的挑战莫过于提升自我 。。20 20年12 月上午 1时51 分20.12. 1101:5 1December 11, 2020
洗瓶;玻璃棒;滴管;吸耳球;分析天平
三、试剂及仪器
NaCl 基准试剂 (M=58.44g/mol) 0.1mol/L AgNO3 标准滴定溶液 K2CrO4溶液:50g/L。 20 g/L 糊精溶液 2 g/L 荧光黄指示剂
四、实验步骤
1. 0.1mol/L AgNO3溶液的标定
准确称取0.08g~0.12g的氯化钠基准试剂
SP前:Ag CL AgCL (白色) Ksp 1.8 1010
SP:2Ag
CrO 2 4
Ag CrO 24
(砖红色) Ksp
1.2 1012
黄色
砖红色
指示剂的用量 一般为 5×10-3mol·L-1 溶液的酸度 中性或弱碱性 pH范围为6.5~10.5
二、实验原理
生理盐水测定原理——法扬司法
实验五 生理盐水中含氯化钠含量的测定
生理盐水中含氯化钠含量的测定
一、实验目的 二、实验原理 三、试剂及仪器 四、实验步骤 五、注意事项
一、实验目的
➢ 了解生理盐水在医学中的应用; ➢ 掌握用莫尔法及法杨司法测定氯化钠含
量的方法及原理; 掌握铬酸钾及荧光黄指示剂的正确使用。
二、实验原理
标定原理——莫尔法
2020 1:51:56 AM01:51:562020/12/11
• 11、自己要先看得起自己,别人才会看得起你。12/11/
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二十三 生理盐水中氯化钠含量的测定(银量法)
一、实验目的
(1)学习银量法测定氯的原理和方法; (2)掌握莫尔法的实际应用。
二、实验原理
银量法是指以生成难溶银盐(如AgCl 、AgBr 、AgI 和AgSCN )的反应为基础的沉淀滴定法成为银量法。
银量法需要借助指示剂来确定滴定终点。
根据作用指示剂的不同,银量法又分为莫尔法。
佛尔哈德法和法扬司法。
本实验是在中性溶液中以42CrO K 为指示剂(莫尔法),用3AgNO 标准溶液来测定-
Cl 的含量:
↓=+-
+
AgCl Cl Ag (白) ↓=++
42-24CrO Ag CrO Ag (砖红色)
由于AgCl 的溶解度小于4AgCrO ,AgCl 沉淀将首先从溶液中析出。
根据分布沉淀原理进行的计算表明,4AgCrO 开始沉淀时AgCl 已定量沉淀,3AgNO 稍一过量,即与-
24
CrO 离子生成砖红色沉淀,指示终点到达。
实验过程中,应注意以下两点:
(1)应控制好指示剂的用量。
因为42CrO K 用量太大时使终点提前到达导致负误差,而用量太小时终点拖后导致正误差。
(2)应控制好溶液的酸度。
因为
-
24
CrO 离子在水溶液中存在下述平衡,
+-+O H CrO 324⇌O H HCrO 24+-
酸性太强,平衡右移,导致
-
24
CrO 离子浓度下降和终点拖后。
但在碱性太强的溶液中,+
Ag
离子又会生成O Ag 2沉淀:
↓=+-
+
AgOH 2OH 2Ag 2 O H O Ag AgOH 222+↓= 所以莫尔法要求溶液的pH 值在6.5~10.5之间。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂
仪器:烧杯,电子分析天平,容量瓶(100mL ),坩埚,煤气灯,锥形瓶(250mL ),酸式滴定管(50mL ),移液管(25mL )。
试剂:3AgNO (s ,A.R.),NaCl (s ,A.R.),42CrO K (5%)溶液,生理盐水样品。
四、实验步骤
1.0.1mol/L 3AgNO 标准溶液的配制
3AgNO 标准溶液可直接用分析纯的3AgNO 结晶配制,但由于3AgNO 不稳定,见光易分解,故若要精确测定,则要NaCl 基准物来标定。
(1)直接配制
在一小烧杯中精确称量1.7g 左右的3AgNO ,加适量水溶解后,定量转移到100mL 容量瓶中,用水稀释至刻度,摇匀,计算其准确浓度。
(2)间接配制
将NaCl 置于坩埚中,用煤气灯加热至500~600℃干燥后,冷却,放置在干燥器中冷却备用。
用台秤称量1.7g 的3AgNO ,定量转移到100mL 容量瓶中,用水稀释至刻度,摇匀。
标定:准确称取0.15~0.2g 的NaCl 三份,分别置于三个锥形瓶中,各加25mL 水使其溶解。
加1mL 42CrO K 溶液。
在充分摇动下,用3AgNO 溶液滴定至溶液刚出现稳定的砖红色,记录3AgNO 溶液的用量,计算3AgNO 溶液的浓度。
2.测定生理盐水中NaCl 的含量
将生理盐水稀释1倍后,用移液管精确移取已稀释的生理盐水25.00mL 置于锥形瓶中,加入1mL 的42CrO K 指示剂,用标准3AgNO 溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。
平行滴定三次,计算NaCl 的含量。
五、思考题
(1)42CrO K 指示剂浓度的大小对-
Cl 测定有何影响?
(2)滴定液的酸度应控制在什么范围为宜?为什么?若有+
4NH 存在时,对溶液的酸度范围的要求有什么不同?
(3)莫尔法测定酸性氯化物溶液中的氯,事先应采取什么措施?
(4)本实验可不可以用荧光黄代替42CrO K 作指示剂?为什么?
六、实验记录与处理
将实验数据和结果记录在表5.36、表5.37中。
AgNO标准溶液的配制及浓度测定
表5.36
3
表5.37 生理盐水中的含量测定。
