官能团保护
有机合成中的官能团互变与官能团保护

有机合成中的官能团互变与官能团保护官能团互变和官能团保护是有机合成中常用的两种策略,用于在合成过程中对官能团进行转化或保护,以达到所需的目的。
本文将具体介绍官能团互变和官能团保护的原理和应用。
一、官能团互变官能团互变是指将一个官能团转化为另一个官能团,通常通过一系列的反应步骤实现。
这种方法在有机合成中广泛应用,可以有效地构建复杂有机分子。
下面以几种常见的官能团互变反应为例进行介绍。
1. 羰基互变反应羰基互变反应是一种常见的官能团互变方法,通常通过氧化、还原或加成等反应来实现。
例如,醛和酮可以通过还原反应互变,常用的还原剂有金属碱金属催化剂或氧化铝。
此外,也可以通过氧化反应将醇氧化为醛或酮。
2. 环化反应环化反应是官能团互变的重要手段之一,可以将直链分子转化为环状分子。
常见的环化反应有氧化环化和还原环化。
例如,氧化还原反应可以将烯烃转化为环烃,通常采用氢化反应或氧化反应。
3. 置换反应置换反应是官能团互变的一种常见方法,通过官能团之间的取代反应来实现。
例如,烷基取代反应可以将一个烷基官能团替换为另一个烷基官能团,常用的取代试剂有碱金属、烷基卤化物等。
二、官能团保护官能团保护是在有机合成中常用的一种策略,用于保护特定的官能团,以防止其在反应过程中发生不需要的反应。
在合成过程中,有时需要对某些官能团进行保护,以确保其他官能团能够正常进行反应。
下面以几种常见的官能团保护反应为例进行介绍。
1. 羟基保护反应羟基保护反应是一种常见的官能团保护方法,通常通过酯化或硅醚化反应来实现。
酯化反应将羟基转化为酯基,以保护羟基。
硅醚化反应则将羟基转化为硅醚基,以保护羟基。
这些保护基在需要时可以通过去保护反应去除。
2. 氨基保护反应氨基保护反应是一种常见的官能团保护方法,通常通过酰化或巯基化反应来实现。
酰化反应将氨基转化为酰基,以保护氨基。
巯基化反应则将氨基转化为巯基,以保护氨基。
这些保护基在需要时可以通过去保护反应去除。
chapt3-官能团的保护
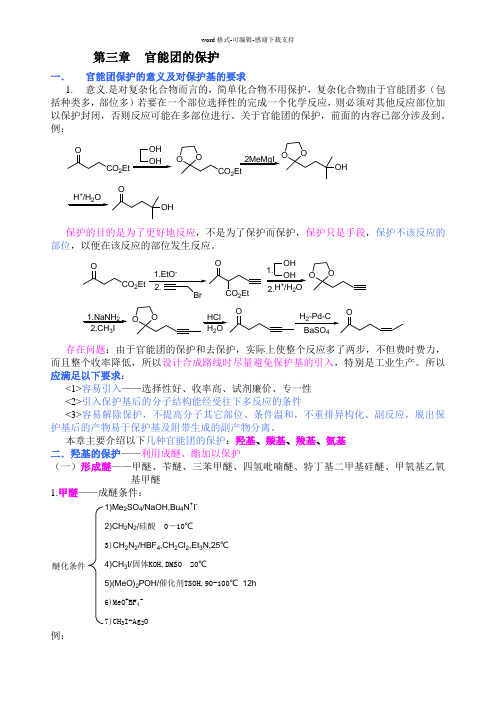
第三章 官能团的保护一. 官能团保护的意义及对保护基的要求1. 意义.是对复杂化合物而言的,简单化合物不用保护,复杂化合物由于官能团多(包括种类多,部位多)若要在一个部位选择性的完成一个化学反应,则必须对其他反应部位加以保护封闭,否则反应可能在多部位进行。
关于官能团的保护,前面的内容已部分涉及到。
例:CO 2EtOOH OHOOCO 2Et2MeMgI OOOH+2OOH保护的目的是为了更好地反应,不是为了保护而保护,保护只是手段,保护不该反应的部位,以便在该反应的部位发生反应。
CO 2EtOOH OH O O+2O-CO 2Et 1.2.1.NaNH 23OOHCl H 2O存在问题:由于官能团的保护和去保护,实际上使整个反应多了两步,不但费时费力,而且整个收率降低,所以设计合成路线时尽量避免保护基的引入,特别是工业生产。
所以应满足以下要求:<1>容易引入——选择性好、收率高、试剂廉价、专一性 <2>引入保护基后的分子结构能经受往下多反应的条件<3>容易解除保护,不提高分子其它部位、条件温和,不重排异构化、副反应,脱出保护基后的产物易于保护基及附带生成的副产物分离。
本章主要介绍以下几种官能团的保护:羟基、羰基、羧基、氨基 二.羟基的保护——利用成醚、酯加以保护(一)形成醚——甲醚、苄醚、三苯甲醚、四氢吡喃醚、特丁基二甲基硅醚、甲氧基乙氧基甲醚1.甲醚——成醚条件:1)Me 2SO 4/NaOH,Bu 4N +I -2)CH 2N 2/硅酸 0-10℃3)CH 2N 2/HBF 4,CH 2Cl 2,Et 3N,25℃4)CH 3I/固体KOH,DMSO 20℃5)(MeO)2POH/催化剂TSOH,90-100℃ 12h 6)MeO +BF 4-7)CH 3I-Ag 2O醚化条件例:OH+Me 2SO 4NaOHMeOSO 3Na+OCH3CH 2N 2+RCH 2OH RO -RCH 2OCH 3R 2CN 2ArOHR 2CHOAr CH2N 2ROHHBF 4ROCH 3+++N 2特别是酚羟基一般用MeO -醚保护,反应容易,解脱也容易,醇羟基形成甲醚较稳定,不易脱掉,故少用,在糖类化合物中羟基的保护勿用形成醚。
有机化学中的官能团保护与反应选择

有机化学中的官能团保护与反应选择在有机化学领域,官能团保护与反应选择是一项关键而重要的技术。
它们在有机合成中发挥着重要的作用,可以实现对特定官能团进行保护,以及控制反应的选择性。
本文将探讨有机化学中的官能团保护与反应选择的原理、方法和应用。
一、官能团保护的原理和方法官能团保护是在有机合成中使用特定的试剂或方法对特定官能团进行保护,以阻止其在反应中发生不需要的转化或损失。
这种保护可以临时地对官能团进行屏蔽,以防止不需要的反应发生。
一旦需要,这些保护官能团可以很容易地被去除,使得官能团再次可用。
常见的官能团保护方法包括酯化、缩醛、缩酮、硅烷保护、硼酸酯保护等。
例如,在酯化反应中,羧酸可以与醇发生酯化反应,形成酯。
这种反应可以通过加入催化剂、调节反应条件和使用适当的反应物比例来控制。
一旦酯形成,官能团保护就实现了。
二、反应选择性的控制在有机合成中,反应选择性是指在具有多个官能团的分子中,选择性地引发或控制特定官能团的反应。
反应选择性的控制对于合成复杂的有机化合物非常重要,可以避免副反应的发生,并帮助提高产率和纯度。
反应选择性的控制可以通过多种方法实现,如调节反应条件、选择适当的催化剂、改变反应物的比例、使用合适的试剂和溶剂等。
以亲核取代反应为例,当分子中存在多个能提供亲核位点的官能团时,可以通过调节反应条件和选择适当的反应物比例,去控制反应的进行。
三、官能团保护与反应选择的应用官能团保护和反应选择在有机合成中有广泛的应用。
其中最具代表性的应用之一是在多步合成中,其中的中间体需要在反应过程中保护起来,以防止意外的转化或副反应的发生。
通过对中间产物进行官能团保护,可以控制整个反应过程,确保预期产物的高产率和选择性。
另一个重要的应用是在天然产物合成中。
天然产物通常具有复杂的结构和多个官能团,官能团保护和反应选择技术可以被用来合成这些天然产物或其类似化合物。
通过选择性地引发或控制特定官能团的反应,可以构建复杂分子骨架,实现对天然产物的全合成。
官能团保护流程

官能团保护流程《官能团保护流程:化学世界里的“小心呵护”在化学这个奇妙又有点让人头疼的世界里,官能团保护流程就像是一场精心策划的保卫战。
你可以把官能团想象成一群性格各异的小怪兽,每个都有自己独特的本领和脾气。
有时候,化学家们就像超级英雄,但无奈这些小怪兽一不小心就会捣乱,所以得小心翼翼地给它们套上“保护罩”。
先说说为什么要搞这个官能团保护吧。
就好比你家里养了一群宠物,你想给其中一只洗澡,但又怕其他的在这个过程中搞破坏。
当我们在有机合成中,想要对一个分子里的某个官能团做点什么的时候,其他的官能团可能会跑来“搅局”。
比如说,你想把某个地方氧化一下,可旁边的羟基就像个调皮的小鬼,可能会抢先一步发生反应。
这时候,就得把羟基这个小调皮保护起来。
那保护的流程呢?首先是选择保护基,这就像是挑护盾一样。
这护盾可得合适才行,要容易加上去,等我们完成了主要的任务后,还能轻轻松松地取下来。
这就好比你给宠物套个项圈,不能太难戴,玩完了也得容易拆。
比如说,用酰氯来保护羟基,就像给羟基穿上了一件特制的衣服。
反应的时候呢,就像它们举办一场神秘的派对。
羟基被保护起来了,就在旁边安静地围观,其他该发生的反应顺利进行。
然而,这个流程也不是一帆风顺的。
就像你好不容易给宠物打扮好了,结果发现这打扮影响它吃饭睡觉了。
在化学里,可能保护基加错了或者反应条件不合适,那就会出现各种乱象。
有时候,这边保护起来了,那边又出新问题了,感觉像是在玩一个永远在补漏洞的游戏。
不过呢,当最后成功地完成了一系列操作,再把保护基去掉的时候,就像是一场精心策划的魔术表演顺利结束。
官能团毫发无损,而我们想要的产物也完美诞生。
这时候就特有成就感,就像你成功照顾好了一群调皮捣蛋却又无比重要的小怪物一样。
官能团保护流程虽然复杂又麻烦,但这也是化学合成中充满智慧和技巧的艺术展现啊。
它就像一场在微观世界里的巧妙博弈,让你在和那些看不见摸不着的小粒子互动的时候充满惊喜和挑战。
有机合成-5官能团的保护

CH2OH CHOCO(CH2)14CH3 CH2OH OCH3 HO HO O O OH OCH3 89% TsOH O O 少量 HCl 蒸镏
CH2OH CHOH CH2OOC(CH2)14CH3
1) mCPBA, 99% 2) (CH3)2CuLi, 乙醚, 94% HO O O
2、形成碳酸环酯
HOH2C
O
O O P OLi OLi OH
HO
二、羰基的保护
CH3OH, H+ R2C O 2 mol/L, H2SO4 O HN H C2H5 O p-TsOH, PhH HOCH2CH2OH 85% O O HS(CH2)3SH, BF3(C2H5)2O R2C O CH3I, H2O, CH3OH R2C S S HN H C2H5 O 1) LiAlH4, THF 2) NaOH aq 3) 1 mol/L HCl O HN H C2H5 R2C OCH3 OCH3
AcO
OAc O Ar, reflux Ph condition
O
H H OAc taxinine (1)
O
AcO
OAc +
AcO
OAc
AcO +
OAc
O H
H OAc
OH HO
N H
H OAc 29-a
OH
N HO
H
H OAc
OH
taxinineA (29)
29-b
Table 2: Selective Hydrolysis of Cinnamoyl Group at C-5 of taxinine (1) yields (%) entry Reagents (equiv) conditions 29 NH2OH. HCl (12) NaOAc (12) H2O 1,4-dioxane NH2OH. HCl (15) NaOAc (15) MeOH 1,4-dioxane NH2OH. HCl (15) NaOAc (10) H2O 1,4-dioxane NH2OH. HCl (10) NaOAc (15) H2O 1,4-dioxane NH2OH. HCl (5) NaOAc (10) EtOH, H2O 1,4-dioxane 70-75 oC, 64 h 29-a 29-b 1
保护官能团的方法

保护官能团的方法嘿,朋友们!今天咱来聊聊保护官能团的那些事儿。
官能团就像是化学世界里的宝贝疙瘩,得好好保护着才行呢!你想想看啊,官能团就好比是一件珍贵的瓷器,稍有不慎就可能磕了碰了。
那怎么保护它们呢?这可得有点小技巧啦。
比如说,有些官能团特别怕水,那咱就得像给宝贝盖被子一样,把它们和水隔开呀。
不然一不小心让水给沾到了,那不就糟糕啦!还有些官能团怕酸怕碱,那咱就得像保护小公主一样,给它们创造一个酸碱适宜的环境,可不能让那些酸碱来捣乱呀。
就好像你有个特别喜欢的玩具,你肯定会小心翼翼地放在安全的地方,不会让别人随便碰到一样。
保护官能团也是这个道理呀。
有时候呢,我们还得给官能团穿上一层“保护衣”。
这层“保护衣”就像是冬天的棉袄,能帮它们抵御外界的各种干扰。
而且这“保护衣”还得选得合适,不能太大也不能太小,得刚刚好才行呢。
再打个比方,官能团就像是你养的小宠物,你得时刻关注着它,给它提供合适的食物、水和住所。
要是你不精心照料,它生病了或者出问题了,那你得多心疼呀!在实验操作中,我们可得加倍小心。
不能像个马大哈似的,随随便便就对待这些官能团。
每一个步骤都要考虑到它们的感受,就像哄小孩子一样,要温柔、细心。
还有啊,不同的官能团保护方法也不一样哦。
这就像是不同性格的人需要不同的对待方式一样。
有的需要特别的关照,有的则稍微注意一下就行。
总之呢,保护官能团可不是一件简单的事儿,但只要我们用心,就一定能把它们保护得好好的。
这样我们才能在化学的世界里畅游无阻,做出更多有趣的实验和发现呀!所以啊,大家可千万不能马虎对待哦,一定要把保护官能团这件大事放在心上!。
有关官能团的保护

有机合成中旳基团保护、导向基(高考必备) (一)基团保护在有机合成中,些不但愿起反映旳官能团,在反映试剂或反映条件旳影响下而产生副反映,这样就不能达到估计旳合成目旳,因此,必须采用对这些基团进行保护,完毕合成后再除去保护基,使其复原。
对保护措施一定要符合下列规定:①只对要保护旳基团发生反映,而对其他基团不反映;②反映较容易进行,精制容易;③保护基易脱除,在除去保护基时,不影响其他基团。
下面只简略简介要保护旳基团旳措施。
1、羟基旳保护在进行氧化反映或某些在碱性条件进行旳反映,往往要对羟基进行保护。
如避免羟基受碱旳影响,可用成醚反映。
避免羟基氧化可用酯化反映。
2、对氨基旳保护氨基是个很活泼旳基团,在进行氧化、烷基化、磺化、硝化、卤化等反映时往往要对氨基进行保护。
(1)乙酰化(2)对NR 2可以加H+ 质子化形成季铵盐,– NH 2也可加H+– OH–CH C 或酸–NH 2-C O-O -C O–成 – NH3而保护。
3、对羰基旳保护羰基,特别是醛基,在进行氧化反映或遇碱时,往往要进行保护。
对羰基旳保护一般采用缩醛或缩酮反映。
4、对羧基旳保护羧基在高温或遇碱性试剂时,有时也需要保护,对羧基旳保护最常用旳是酯化反映。
5、对不饱和碳碳键旳保护碳碳重键易被氧化,对它们旳保护重要要加成使之达到饱和。
(二)导向基在有机合成中,往往要“借”某个基团旳作用使其达到预定旳目旳,预定目旳达到后,再把借来旳基团去掉,恢复本来面貌,这个“借”用基团 我们叫“导向基”。
固然这样旳基团,要符合易“借”和易去掉旳原则,如由苯合成1,3,5 – 三溴苯,在苯旳亲电取代反映中,溴是邻、对位取代基,而1,3,5 – 三溴苯互居间位,显然不是由溴旳–COOH + R –OH H –CHO +2ROH H定位效应能引起旳。
但如苯上有一种强旳邻、对位定位基存在,它旳定位效应比溴旳定位效应强,使溴进入它旳邻、对位,这样溴就会呈间位,而苯环上本来并无此类基团,显然要在合成时一方面引入,完毕任务后,再把它去掉,正好氨基能完毕这样旳任务,由于它是一种强旳邻、对位定位基,它可如下引入:– H → – NO 2 → – NH 2 ,同步氨基也容易去掉:– NH2→ – N 2 → – H 因此,它旳合成路线是:根据导向基团旳目旳不同,可分为下列几种状况:1、致活导向 如果要合成 可以用 但这种措施产率低,由于丙酮两个甲基活性同样,会有副反映发生:但在丙酮旳一种甲基上导入一种致活基团,使两个甲基上旳氢旳活性有明显差别,这可用一种乙酯基(–C OO C2H 5)导入丙酮旳一种甲基上,则这个甲基旳氢有较大旳活性,使这个碳成为苄基溴攻打旳部位,因此,运用乙酰乙酸乙酯而不用丙酮,完毕任务后,把乙酯基OC 6O + C 6BrO C 6C 6Br O COOC C 2H 5O O COOC C6O COOC 1)2)△ C 6O OC6C 6Br碱C 6Br 碱OC 6C 6O水解成羧基,运用β– 酮酸易于脱羧旳特性将导向基去掉,于是得出合成路线为:2、致钝导向活化可以导向,有时致钝也能导向,如合成 氨基是很强旳邻、对位定位基,进行取代反映时容易生成多元取代物:如只在苯胺环上旳氨基旳对位引入一种溴,必须将氨基旳活性减少,这可通过乙酰化反映来达到,同步乙酰氨基是一种邻、对位定位基,而此状况下对位产物是重要产物:3、运用封闭特定位置来导向例如合成 ,用苯胺为起始原料,用混酸硝化,一方面苯胺易被硝酸氧化,另一方面,苯胺与硫酸还会生成硫酸盐,而 是一种H 2Br NH 2+ Br 2NH 2BrBr BrNH 2 BrNHCO BrBr 2H 2ONHCONH 2 NH 2NO–⊕间位定位基,硝化时得到,因此苯胺硝化时,要把苯胺乙酰化后,再硝化。
例谈有机合成中官能团的保护_熊光发

CH |
2OH
CH2OH
OO R—C—R' H2O/H+
O ‖ R—C—R'
O
(2)R—‖C—OC2H5 LiAlH4
H2O RCH2OH+C2H5OH
试以丙烯及其 他 必 要的 有 机试 剂为原 料 合成
CH3COCH2OH,无机试剂任选,写出合成流程图。 解 析:结合 题 给 信息,不 难 设 计出前半 段合成 线
步骤④用丙酮与其他四个羟基反应以保护它们,然后
在步骤⑥中水解脱保护。
第Ⅱ小题中的有机合成则要求学生对上述所用到
的羟基保护方法,在领会的基础上加以运用。
答案:
I.(1)①(A 与 H2 加成得 B)、③(C 分子内 5 号 C
上的羟基与 2 号 C上的碳氧双键发生加成作用得 D:)
21|CCH=O2OH
一线教师在课堂教学中,要做到难点突破和重点 掌握,实现教学的有效性和高效性,有时很需要概览知 识内容的全部,再加以条分缕析和方法指导,彰显知识 构建的逻辑性,既要求得学生当下的发展(解决某个问 题)又要赢得长远发展(遇到新问题能触类旁通)。我 在进行高中化学“有机合成”的教学时,作了些许有关 的尝试。
路:
CH3CH=CH2
Br2
CH3|CH-|CH2 NaOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
官能团保护的意义
有机反应往往会伴有副反应,原因就是
有机反应的复杂性,反应条件、官能团 的相互影响等都会影响反应的进行.在 有些反应中,使某个官能团参加反应时, 可能会有其他的官能团受到影响,这样 就需要对官能团进行保护.
官能团的保护
一、保护基的基本条件 二、羟基保护 三、羰基保护
在一些例子中,最后一条可以放宽,允许保护基 被直接转变为另一种官能团。
二、羟基的保护基团
保护醇类 ROH 的方法一般是制成醚类 (ROR ′ ) 或酯 类(ROCOR′),缩醛或缩酮类。前者对氧化剂或还原剂都有 相当的稳定性。 1
. 醚类衍生物
①形成甲醚类 ROCH3 可以用碱脱去醇ROH质子,再与合成子 +CH3作用,如 使用试剂NaH/Me2SO4。也可先作成银盐 RO-Ag+ 并与碘甲 烷反应,如使用 Ag2O/MeI;但对三级醇不宜使用这一方法 。醇类也可与重氮甲烷CH2N2,在Lewis酸(如BF3·Et2O) 催化下形成甲醚.
以羧基为保护基:
OH CO2/NaHCO3 OH COOH OH Br Br2/AcOH OH COOH H3O OH
+
OH Br
OH
OH
以磺酸基为保护基:
CH3 浓H2SO4 CH3 Cl2,Fe CH3 Cl H3O
+
CH3 Cl
SO3H
SO3H
以硝基为保护基:
C(CH3)3
HNO3 H2SO4
Et2O AgNO3/H2O/EtOH
Ag
KCN/H2O -AgCN
H
格氏反应和有机锂合成中的保护
PhLi+RC CH
RC
CLi
+ C6H6
2.芳烃中C-H键的保护 常用的保护基有间位定位基,如-COOH、-NO2、-SO3H 及邻对位定位基,如-NH2、-X等。 (1)间位定位基 由于羧基、硝基、磺酸基为强吸电 子基,只有当环上有强供电子基时方可使用。
S MeS O TBDMSO
HgCl2-CaCO3
S
MeCN-H2O
S
HO TBDMSO
S
四、 氨基的保护
N-烷基或 N-硅烷基作为保护基
RNH2 K2CO3 H2,AcOH/10%Pd C
+
PhCH2X
RNHCH2Ph
X=Cl,Br
RNH2
Me3SiCl + NEt3(or Pyridine) Aqueous condition
O
3-ClBzOOH (CHCl3) 1h,-10℃ O3/CH2Cl2;1.5h;-78℃ Zn/NaI;2h (NaOAc/AcOH)
cis:trans=1:1
O
RNHSiMe3
芳香胺在进行硝化反应时是采用甲酰基保护,并且在磺 胺合成中用甲酰基有明显的优点,因为它易于引入和 消去。
NH2 NHCHO
HCOOH, 1小 时 373-383K
NH2
NHCHO
NH3H2O(浓 ), 1小 时 , 368-373K
H2NSO2 ClSO2
Boc (叔丁基氧基羰酰基)
1.酸和醇或酚直接酯化法
酸和醇的直接酯化法是最常用的方法,具有原料易得 优点,这是一个可逆反应。 2.酸的衍生物与醇的酯化 酸的衍生物与醇的酯化主要包括醇与酰氯,醇与酸酐, 醇与羧酸盐等的反应,方程式如下:
3.酯交换反应 酯交换反应主要包括酯与醇,酯与酸,酯与酯之间的交换 反应,化学方程式如下:
四、氨基保护
五、羧基保护 六、活泼碳氢键和碳碳键的保护
一、保护基的基本条件
总的说来,保护基应满足下列三点要求:
1. 它容易引入所要保护的分子(温和条件); 2. 它与被保护基形成的结构能够经受住所要发 生的反应的条件; 3. 它可以在不损及分子其余部分的条件下除去 (温和条件);
乙硫醇
O OH OH
浓盐酸
SEt OH OH
3.O,S-缩醛
O,S-缩醛的稳定性介于O,O-缩醛和S,S-缩醛之间,在
酸性水溶液中,它比O,O-缩醛稳定的多;但比S,S-缩 醛活泼的多,水解速度约为S,S-缩醛的104倍。
化合物分子中含有O,S-缩醛和S,S-缩醛,在HgCl2-
CaCO3作用下,O,S-缩醛被选择性的水解。
2.S,S-缩醛
与O,O-缩醛相比,S,S-缩醛更加稳定,形成S,S-缩醛保护也 更加容易,也无需除水,而且时常在有水的条件下反应。 S,S-缩醛在酸性和碱性条件下都是稳定的,保护基团可以满 足更广泛的反应需求。但使用S,S-缩醛保护化合物有三个主 要的缺点: ①大多数硫醇和二硫醇具有难闻的气味 ②水解反应常用到金属盐,也具有相当的毒性和环境问题 ③含硫化合物对Pd和Pt催化剂具有毒化作用,对于催化还原 反应具有相当大的限制,这时候往往需要较大的催化剂用量 和高压条件。 OH OH OH OH SEt
FeCl3
C(CH3)3 C(CH3)3
3.脂肪族中C-H键的保护 脂肪族中C-H键的保护,往往是指保护特定位置C-H键, 如α -取代基的不对称酮,若想使其在有取代基的α 碳上进行烃化反应,就必须将另一个α -位的活泼亚甲 基保护起来,待指定部位的烃化反应完成后再将保护 基除去。
4.碳碳键的保护 过氧化物与碳碳双键形成环氧化物的方法可以保护碳 碳双键免受亲电试剂的进攻。在乙酸溶液中,用锌和 碘化钠处理可以脱去环氧保护基。卤代也可用于保护 碳碳双键,同样用锌去保护。例如 :
OH + ClSO2Ar OSO2Ar
碱的水溶液 或碱的醇溶液
OH
三、羰基的保护
醛、酮的保护基相对较少,常见的有O,O-缩醛和O,S-
缩醛,以及S,S-缩醛 1.O,O-缩醛 质子酸或者Lewis酸都可以催化醛或酮与醇反应生成缩醛。 例如:
O O
O
HO(CH2)3OH P-TsOH
O H H
O H H
O OH
+
六、活泼碳氢键和碳碳键的保护
1.乙炔衍生物活泼氢的保护 常用的炔氢保护基是三烷基硅基(如Me3Si-,Et3Si-)。 三甲基硅烷的引入是通过炔烃转变为Grignard试剂后和 三甲基氯硅烷作用实现的。该保护基对有机金属试剂, 氧化剂稳定,并可用碱或硝酸银除去保护基。例如:
+ Br Li SiMe3
③ 苄基醚(Bn)保护基 苄基醚的稳定性与甲基醚类似,对于多数酸和碱以及氧 化剂都非常稳定,形成保护的反应条件也温和,操作简单, 作为反应物的苄基溴或者苄基氯便宜易得。
CH2Br
R OH
NaOH
R OCH2
苄基醚
H 3 +O
R OH +
CH2OH
H2 Pd
R OH +
CH3
④ 三苯甲基醚 三苯甲基醚在糖、核苷和甘油酯化学中广泛的用来保 护一级羟基,它的最大优点是在多羟基化合物中选择 性的保护伯醇羟基。 制备时,以(单或二取代)三苯基氯甲烷在吡啶中与 醇类作用,而以 4-二甲胺基吡啶(4-dimethyl aminopyridine, DMAP)为催化剂。
ROH + CH2=CH-CH2Br NaOH ROCH2-CH=CH2 KOBu DMSO ROCH=CH-CH3
2 .缩醛和缩酮类衍生物 ① 四氢吡喃醚(THP)保护基 制备时,使用二氢吡喃与醇类在酸催化下进行加成作 用。欲回收恢复到醇类时,则在酸性水溶液中进行水 解,即可脱去保护基团。有机合成中常引用这种保护 基团,其缺点是增加一个不对称碳(缩酮上的碳原 子),使得NMR谱的解析较复杂。
4.其它 酯化方法还包括烯酮与醇的酯化,腈的醇解, 酰胺的醇解,醚与一氧化碳合成酯的反应。如:
羧酸以酯的形式被保护,常常用甲酯或乙酯,然而 为了除去它们需要强酸性或强碱性条件可能是不利方面 。 在这种条件下,叔丁酯(可用温和的酸处理除去) ,苄酯(能经氢解而脱苄基)或 β ,β ,β- 三氯乙酯(去 保护作用可用包括锌引起的消除反应)可能更有用。
O
,TsOH,Pyr RO ROH HOAc,H2O
O
α -卤代酸酯保护基 α -卤代酸酯衍生物如:ClCH2COOR、Cl2CHCOOR、 Cl3CCOOR、F3COOR等,可分别由酰卤、酸酐和具有羟 基的化合物作用来制备。这类保护基在分子中引入了 卤素,使羰基碳原子的亲电性增强,从而易于水解, 利用这一特性进行选择性的解除。其保护基的解除通 常在碱性条件下或胺类化合物中进行。 3.酚羟基的保护 酚的保护基也可分为醚、酯和缩醛三类,例如: ②
H2 Pd H2NCH2CONHCHCO2H H2NCH2CONHCHCO2CH2Ph (90%) CH2Ph CH2Ph
苄基对于温和酸处理是稳定的,它易被氢解除去。
H2NCH2CO2H
PhCH2OCOCl
PhCH2OCONHCH2CO2H
PhCH2CH(NH2)CO2C(CH3)3 [(C2H5O)2P(O)]2O
H2NCH2CONHCHCO2C(CH3)3 CH2Ph (80%) HCl benzene H2NCH2CONHCHCO2H CH2Ph
H2 Pd (60%)
PhCH2OCONHCH2CONHCHCO2C(CH3)3 CH2Ph
叔丁酯对酸敏感
O
+
H3+O
O O
OH
O
+ OH HO
H3+O
O O
CF3COOH
C(CH3)3 Br
Br2,Fe
C(CH3)3
Br
C(CH3)3 Br
i NaNO2+H2SO4 ii H3PO2/H2O
