结构化学基础原子的结构与性质PPT讲稿
合集下载
结构化学第二章

8h2224Z e20rE
精选可编辑ppt
17
球极坐标与笛卡儿坐标的关系
精选可编辑ppt
18
Schrödinger方程在球极坐标中的形式
精选可编辑ppt
19
2. 变数分离法
令 (r,)R( r())(),代入上式 r2si并 2n 乘以
R
s R 2 i r n r 2 R r s i n si n 1 2 2 8 h 2 2( E V ) r 2 s2 i 0 n
这样的原子称为Rydberg原子。在实验室里已造出n 约为105的H原子, n 约为104的Ba原子; 在宇宙中也观察到了n 从301到300之间的跃迁。
毋庸置疑, Rydberg原子是个大胖子。事实上, 它的半径大约相当于基态 原子的十万倍! 这样一个胖原子, 即使受到微弱的电场或磁场作用, 也会显著 变形。
第二章 原子的结构和性质
精选可编辑ppt
1
精选可编辑ppt
2
在本章中,将用Schrödinger方程处理真实的化学物种, 这自然要从最简单的H原子入手。为了更具一般性,也包括 类氢离子,如He+、Li2+等,它们的区别仅在于原子序数Z的 不同。
氢是化学中最简单的物种,也是宇宙中最丰富的元素。 无论在矿石、海洋或生物体内,氢无所不在。
精选可编辑ppt
20
2. 变量分离
设ψ(r,θ,φ)=R(r)Θ(θ)Φ(φ)= R(r) Y (θ,φ). 方程两边同乘以r2/(RΘΦ)
R方程:
Y方程:
Y=ΘΦ.方程两边同乘以 sin2θ/(ΘΦ)并移项
精选可编辑ppt
21
经变数分离得到的三个分别只含,和r变量的方程依次称 为方程、方程和R方程,将方程和方程合并,Y(,) =()(),代表波函数的角度部分。
原子的结构ppt课件

13.关于构成物质的微观粒子,下列说法正确的是( )
D
A. 离子带电,所以不能直接构成物质B. 氯离子的质子数比电子数多1个C. 离子是带电粒子,所有带电粒子一定是离子D. 原子得失电子变成离子,原子核不发生变化
14.下列关于、 两种粒子的判断,正确的是( )
C
①核电荷数相同 ②核外电子数相等比 稳定 ④质量几乎相等⑤质子数相等A. ①③⑤ B. ②④ C. ①③④⑤ D. ①②③④⑤
A
B
C
11.下图形象地表示了氯化钠的形成过程。下列叙述中,不正确的是 ( )
B
A. 钠原子在化学反应中容易失去电子B. 钠原子与钠离子都不显电性C. 氯原子得到1个电子形成氯离子D. 氯化钠由钠离子和氯离子构成
12.某粒子结构示意图如图所示,下列说法错误的是( )
D
A. 若 ,则该粒子是阴离子B. 若 ,则该粒子是原子C. 若 ,则该粒子是阳离子D. 若 ,则该粒子是由一个原子得到2个电子形成的
5、相同的原子层结构化学性质相似相同的原子层结构:
化学性质相似:
电子层数相同,切每层上电子数相等
条件:最外层电子数认为最终的结果是( )A.Na原子与Cl原子都无法构成相对稳定结构B.Na原子与Cl原子都构成了相对稳定结构C.Na原子与Cl原子只有一方构成了相对稳定结构
小练习:试着写出下面的离子示意图代表什么
Al3+
S2-
5、离子符号的意义
Al3+
3Al3+
表示一个铝离子
表示3个铝离子
表示一个铝离子带3个单位正电荷
6、离子也是构成物质的一种粒子
由离子构成的物质,化学性质由离子保存
如:NaCl由Na+和Cl-构成,所以化学性质由 Na+和Cl-保持。
D
A. 离子带电,所以不能直接构成物质B. 氯离子的质子数比电子数多1个C. 离子是带电粒子,所有带电粒子一定是离子D. 原子得失电子变成离子,原子核不发生变化
14.下列关于、 两种粒子的判断,正确的是( )
C
①核电荷数相同 ②核外电子数相等比 稳定 ④质量几乎相等⑤质子数相等A. ①③⑤ B. ②④ C. ①③④⑤ D. ①②③④⑤
A
B
C
11.下图形象地表示了氯化钠的形成过程。下列叙述中,不正确的是 ( )
B
A. 钠原子在化学反应中容易失去电子B. 钠原子与钠离子都不显电性C. 氯原子得到1个电子形成氯离子D. 氯化钠由钠离子和氯离子构成
12.某粒子结构示意图如图所示,下列说法错误的是( )
D
A. 若 ,则该粒子是阴离子B. 若 ,则该粒子是原子C. 若 ,则该粒子是阳离子D. 若 ,则该粒子是由一个原子得到2个电子形成的
5、相同的原子层结构化学性质相似相同的原子层结构:
化学性质相似:
电子层数相同,切每层上电子数相等
条件:最外层电子数认为最终的结果是( )A.Na原子与Cl原子都无法构成相对稳定结构B.Na原子与Cl原子都构成了相对稳定结构C.Na原子与Cl原子只有一方构成了相对稳定结构
小练习:试着写出下面的离子示意图代表什么
Al3+
S2-
5、离子符号的意义
Al3+
3Al3+
表示一个铝离子
表示3个铝离子
表示一个铝离子带3个单位正电荷
6、离子也是构成物质的一种粒子
由离子构成的物质,化学性质由离子保存
如:NaCl由Na+和Cl-构成,所以化学性质由 Na+和Cl-保持。
原子的结构完整版PPT课件

工业领域应用
放射性同位素可用于材料 检测、无损探伤、辐射加 工等。
其他领域应用
放射性同位素还可用于科 学研究、环境保护、农业 生产等领域。
放射性同位素对环境影响及安全防护措施
对环境影响
放射性同位素衰变产生的射线会对环境和生物体造成危害,如污 染空气、水源和土壤等。
安全防护措施
为了保障人类和环境安全,需要采取一系列安全防护措施,如合 理选址、屏蔽防护、废物处理等。
放射性同位素概念及来源
放射性同位素定义
01
具有相同原子序数但质量数不同的同位素,能自发地放出射线
并转变为另一种元素。
放射性同位素来源
02
天然放射性元素和人工合成放射性元素。
放射性同位素衰变类型
03
α衰变、β衰变和γ衰变。
放射性同位素在医学、工业等领域应用
医学领域应用
放射性同位素可用于诊断 和治疗疾病,如放射性碘 治疗甲状腺疾病、PET扫 描等。
过渡元素位于周期表中间部分, 包括3~12列的元素。它们具有 多种氧化态和丰富的化学性质, 是构成众多合金和催化剂的重要
成分。
稀有气体元素
稀有气体元素位于周期表的最右 侧,它们具有稳定的8电子构型 (氦为2电子构型),化学性质 极不活泼,一般不易与其他物质
发生化学反应。
04
化学键与分子间作用 力
化学键类型及特点
分子间作用力影响物质的物理性质
分子间作用力主要影响物质的熔点、沸点、密度、硬度等物理性质。一般来说,分子间作用力越强,物质的熔点 、沸点越高,密度越大,硬度也越大。例如,氢键的存在使得水的熔沸点异常高,范德华力则主要影响由分子构 成的物质的物理性质。
05
原子光谱与能级跃迁
物质结构与性质第一章原子结构与性质 ppt课件

ppt课件
4
二二、、能能层与层能与级能级
1、原子的构成
{ { 原子Leabharlann 原子核 核外电子质子 中子
ppt课件
5
2、能层与能级
(1)能层
在多电子的原子核外电子的能量是不 同的,按电子的能量差异,可以将核 外电子分成不同的能层。
ppt课件
6
核外电子分层排布
依据核外电子的能量不同:
离核远近:近
远
能量高低:低
ppt课件
32
泡利不相容原理
电子排布式 Li: 1s22s1
电子排布图
1s 2s
用一个□表示一个原子轨道,
在□中用“↑”或“↓”表示该轨道
上排入的电子。
ppt课件
33
洪特规则
对于基态原子,电子在能量相同 的轨道上排布时,将尽可能分占不同 的轨道并且自旋方向相同。
C:1s22s22p2
ppt课件
34
子的电子排布式
(1)N
(2)Ne
(3)Ca
5.下列各原子或离子的电子排布式错误的 是( )
A.Al 1s22s22p63s23p1 B.O2- 1s22s22p6 C.Na+ 1s22s22p6 D.Si 1s22s22p2
ppt课件
15
【思考与交流】
1.写出溴和氪的电子排布式,它们的最外 层有几个电子? 2.电子排布式的书写可以简化,如可以把 钠的电子排布式写成 [Ne]3s1 试问:你能 仿照钠原子的简化电子排布式写出第8号元 素氧、第14号元素硅和第26号元素铁的简 化电子排布式吗?
核
7s
7p
7
外
6s
6p
6d
6
原子结构与性质课件

通过α粒子散射实验提出原子的核式 结构模型,即原子中心有一个带正电 的原子核,电子绕核运动。
汤姆生枣糕模型
发现电子并提出类似“枣糕”的原子 模型,即电子像“枣子”一样镶嵌在 原子内部。
原子核与电子云概念
原子核
位于原子中心的带正电的粒子, 由质子和中子构成。质子数决定 元素的种类,中子数影响元素的 同位素。
元素周期表结构与特点
01
02
03
周期
元素周期表有7个横行, 每一横行代表一个周期, 共7个周期。
族
元素周期表有18个纵行, 分为16个族(7个主族、7 个副族、第8族和0族)。
特点
元素周期表反映了元素性 质的周期性变化,即元素 的性质随着原子序数的递 增而呈现周期性的变化。
周期表中元素性质递变规律
晶体中粒子间相互作用力
离子键ห้องสมุดไป่ตู้
正负离子间的静电吸引力。
共价键
原子间通过共用电子对形 成的化学键。
分子间作用力
包括范德华力和氢键,范 德华力是分子间的瞬时偶 极相互作用,氢键是分子 间特殊的相互作用力。
晶体性质如熔点、硬度等比较方法
熔点比较
硬度比较
离子晶体>原子晶体>分子晶体,金属晶体 的熔点差异较大。
元素金属性、非金属 性
同一周期中,从左到右,随着原 子序数的递增,元素的金属性递 减,非金属性递增;同一族中, 由上而下,随着原子序数的递增, 元素的金属性递增,非金属性递 减。
03
化学键与分子间作用力
离子键、共价键和金属键形成条件及特点
01
离子键形成条件
活泼金属与活泼非金属元素之间,通常通过得失电子形成离子键。特点:
水污染与原子结构
课件《原子结构与性质》精品ppt课件_人教版1
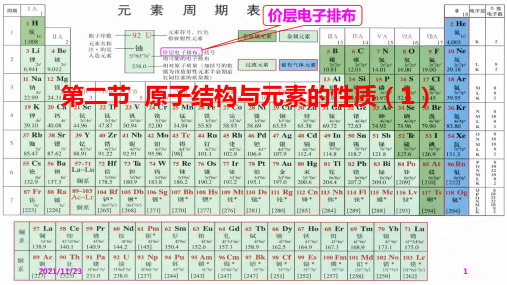
含ⅠA与ⅡA共两族两列; (2)[Ar]3d10 4s1 第7周期:32 种元素
特点:①价电子总数=主族序数(零族除外)
通过元素周期表认识周期表中各区、各周期、各族元素原子核外电子的排布规律。
②以非金属元素为主 小结:(三)原子的电子构型和元素的分区
已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。 (1)观察周期表,我们会发现,每一周期的第一种元素(除第一周期外)是 ________, 最外层电子排布为______,每一周期的最后一种元素都是 ___________ , 这些元素的最外层电子
主族序数=价电子数=最外层电子数=最高正价数
第二节 原子结构与元素的性质(1) 随着核电荷数的递增,电子在能级里的填充顺序遵循构造原理,元素周期系的周期不是单调的,每一周期里元素的数目不总是一样多,而是随着周期序号的递增渐渐增多。
[Ar] 3d10 4s2 4p5
IA和 IIA族元 素。
(n-1)d电子数也基本相同,
最外层电子数基本相同,化学性质相似。 S区元素:最外层构型是ns1和ns2。
渐 减弱 ;碱性逐渐 大多数副族序数=价电子数=(n-1)d+ns的电子数
第5周期:18 种元素 (2)[Ar]3d10 4s1
增强 ;
2021/11/23
6
P13 碱金属 原子序数 周期 基态原子的电子排布式
1s2 He
5s1-2
4d1-95s1-2 4d105s1-2
5s25p1 -5
5s25p6
6 32
6s1-2
4f1-146s2 5d1-106s2
5d106s1-2
6s26p1 -5
6s26p6
2021/11/23
高一化学原子结构课件图文

04 元素周期律与化学键合 性质
元素周期律概述
01
02
03
元素周期律定义
元素的性质随着原子序数 的递增而呈现周期性变化 。
周期表结构
周期表按照原子序数排列 ,具有横行(周期)和纵 列(族)的结构。
周期表分区
根据电子排布的不同,周 期表可分为s、p、d、f等 区。
化学键类型及其特点
离子键
由正负离子通过静电作用形成的 化学键,具有高熔点、高沸点等
个人防护措施
实验人员需佩戴防护服、护目 镜等个人防护装备,减少放射 性物质对身体的伤害。
废弃物处理
对实验过程中产生的放射性废 弃物进行妥善处理,避免对环 境造成污染。
安全标识
在实验室醒目位置设置安全标 识,提醒实验人员注意安全事
项。
06 原子结构在生活和科技 中应用
原子结构在材料科学中应用
01
原子排列与晶体结构
元素周期表简介
元素周期表是按照元素原子的核电荷 数(即质子数)从小到大排列的表格 。
周期表中共有18个纵列,其中8、9 、10三个纵列共同组成一个族,其余 每个纵列为一个族,共有16个族。
周期表中共有7个横行,即7个周期, 每个周期中元素的性质具有相似性。
元素周期表反映了元素性质的周期性 变化,是学习和研究化学的重要工具 。
膜,如防腐、耐磨、导电等。
原子结构在能源领域应用
原子核能
01
利用原子核的裂变或聚变反应,可以释放出巨大的能量,用于
发电、推进等。
太阳能利用
02
太阳能电池板中的光电效应,实质上就是光子与电子的相互作
用,进而产生电流,实现对太阳能的利用。
新能源材料
03
《原子结构》精品教学课件-PPTppt【人教版】

3、按照电子排布,可把周期表的元素划分为5个 区:s区、d区、ds区、p区、f区。划分区的依据 是什么? s区、d区、p区分别有几个纵列?为什 么s区、d区、ds区的元素都是金属?
1
2
3
4s
p
5
d
ds
6
7
f
(二)区的划分
镧系
f
锕系
除ds区外,区的名称来自按构造原理最后填入 电子的能级的符号
s d
ds区:IB、IIB族 ——(n-1)d10ns1~2 最外层电子数皆为1~2个,均为金属元素 。
f区:镧系和锕系——(n-2)f0~14(n-1)d 0~2 ns2 最外层电子数基本相同,化学性质相似。
• 4、为什么副族
元素又称过渡元 1
素?
2
• 5、非金属元素 3
为什么主要集中 4 s
在右上角的三角 5
电负性:利用图、表、数据说明
《原子结构》精品教学课件-PPTppt【 人教版 】优秀 课件( 实用教 材)
《原子结构》精品教学课件-PPTppt【 人教版 】优秀 课件( 实用教 材)
科学探究
1. 下列左图是根据数据制作的第三周期元素的电负 性变化图,请用类似的方法制作IA、VIIA元素的电负 性变化图。
《原子结构》精品教学课件-PPTppt【 人教版 】优秀 课件( 实用教 材)
②电负性相差很大的元素化合通常形成离子键; 电负性相差不大的两种非金属元素化合,通常 形成共价键; 电负性相差越大的共价键,共用电子对偏向电 负性大的原子趋势越大,键的极性越大。
《原子结构》精品教学课件-PPTppt【 人教版 】优秀 课件( 实用教 材)
最大的是稀有气体的元素:He
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 exp[im] 2
1 exp[im] 2
z
r z
y
x
y x
根据态叠加原理,将两个特解组合,仍是系统可取的
状态,因此可以组合得到实数形式的解
m
1 eim
2
1 (cos m i sin m) 2
m
1 eim
2
1 (cos m i sin m) 2
cos m
sin m
1 2
(m
Re 109677cm1
Bohr模型的不足和失败
➢Bohr模型的量子化条件是人为强加的; ➢Bohr模型的电子具有确切的轨道,仍遵循经典力学
规律;
➢Bohr模型中的电子没有表现出几率波的特性; ➢Bohr原子是平面的而非球形的。
i
h2
8 2m
i
2
Vˆ
E
2.1.1 单电子原子的Schrödinger方程
Zr na0
)
2Zr na0
L2l 1 n1
(
2Zr na0
)
(2l 1)
2
(l (l
m m
)!1/ 2 )!
Pl m
(cos )
氢 原 子 的 波 函 数
量子数的物理意义
nlm (r, ,) R(r)( )()
单电子原子的总空间波函数y 取决于三个量子数,一般写成nml ,叫做原子轨道。
sin
(sin
)
1
sin2
2
2
由此可以得到球极坐标系下的Schrödinger方程
h2
2
2
Ze2
40r
(r,
,
)
E
(r,
,
)
完整形式如下
h2
8 2
1 r2
r
r
2
r
1
sin
sin
1 sin 2
2 2
V E
令:(r, ,) R(r)( )()
两边同乘以
结构化学基础原子的结构与性 质课件
卢瑟福的a粒子散射实验和原子的行星模型
阴极射线实验发现电子 (1897年)
汤姆孙的原子模型
1909-1911 年
卢瑟福的行星模型
2
m r
Ze2
4 0 r 2
困难:卢瑟福的原子不能稳定存在, 将会发射出电磁波并崩溃
而且卢瑟福的原子模型不能解释原子光谱
巴耳末公式
• 氢原子光谱(在可见光内)
8ch3
2 0
1 n12
1 n22
对于吸收光谱,n1>n2, 由实验总结得到的里德堡公式为
v%
R
1 n12
1 n22
对比两个公式,可以看到Bohr理论很好地解释了氢原子
吸收光谱,由此可以精确求得Rydberg常数
m me , R 109737cm1 m H , RH 109678cm1
z
r z
y
x
y x
r : [0,∞] : [0,] : [0,2]
按照偏微分关系
x
r
r x
x
x
可以将拉普拉斯算符在球极坐标下表示出来
2
1 r2
rrLeabharlann 2r1r2 sin
sin
1
r 2 sin2
2
2
类似的,还可以得到球极坐标系下其他的算符
Mˆ z
ih
Mˆ 2
h2
1
1 sin
2
2
1 exp[i2] 2
cos 2
1 cos 2
2
2
1 exp[i2] 2
sin 2
1 sin 2
2.1.4 单电子原子的波函数
nlm (r, ,) R(r)( )()
1 exp[im] 2
l
[( 2 )3 na0
(n l 1)! 2n[(n l)!]3
] exp(
r 2 sin2
R(r)( )()
移项整理:
1
d 2
d 2
sin2
R
d dr
r
2
dR dr
sin
d
d
sin
d
d
8 2
h2
r 2 sin2 (E V )
1
d 2
d 2
常数
令:1
d 2
d 2
m2
则:d 2
d 2
m2
0
2.1.3 方程的解
z
d 2
d 2
m2
0
r z
此方程的特解为
定态的条件:电子做圆周运动的角动量是量子化的。
M nh n, 2π
n 1,2,3,...
频率规则:
当电子由能量为En的定态跃迁到能量为Em的定态时,
就会吸收或发射频率为 的光子。
| Em En | E
h
h
Bohr的氢原子模型
电子绕核运动向心力和原子核对其吸引力大小相等方
向相反
m 2
e2
y
x
Aexp[im]
m|m|
exp[im] exp[im( 2 )] exp[im]exp[im2 ]
y x
根据波函数的单值条件,有
() ( 2 )
亦即
exp[im2 ] 1 exp[im2 ] cos m2 i sin m2 1
由此
m 0, 1, 2,L
再根据归一化条件,解得
1885年,巴耳末提出公式
B(
m2 m2 22
)
里德堡公式
m 3, 4,5,...
B 364.56
v%
R
1 n12
1 n22
n 1, 2,3,...且n2 n1 R 109677cm1
原子结构的Bohr(玻尔)理论 1913 年
定态规则: 原子有系列定态,每个定态有一相应的能量E,电子在 这些定态上绕核作圆周运动,处于稳定状态。
单电子原子:H,He+,Li2+ 体系中的两个粒子:
带正电的原子核 带单位负电荷的电子 由此写出体系的Hamiltonian和Schrödinger方程:
Hˆ
h2 2M
2N
h2 2me
e2
Ze2
4 0 r
Hˆ (X ,Y , Z, x, y, z) E ( X ,Y , Z, x, y, z)
原子核和电子动能项合并为: 1 r&2
2
meM
me M
M 1836.1me
0.99946me
(可以近似取 me 此时可以认为质心位于原子核上,原子核近似不动)
在原子核为原点的参考系中,单电子原子的Schrödinger 方程为
h2
8 2
2
Ze2
4 0 r
(x,
y,
z)
E
(x,
y,
z)
2.1.2 变量分离法
为方便解Schrödinger方程,使用球坐标系
r 40r2
电子的能量(不考虑核运动)
E 1 m2 e2 e2
2
40r 80r
角动量的量子化条件
可以求得
M mr nh
r
4 0 n 2 h 2
me2
E me4
8n2 0 h2
根据求得的能级公式,可以知道原子吸收或发射光谱的 波数和频率为
v% v c
En1 En2 hc
me4
m
)
i 2
(m
m
)
1 cos m 1 sin m
由于组合的两个函数是不同本征值(不包括m=0)的本征函数,因此 组合后的实函数解不再是角动量Z方向分量的本征函数。
方程的解
m
复函数解
实函数解
0
0
1 2
0
1 2
1
1
1 exp[i] 2
cos 1
1 cos
1
1
1 exp[i] 2
sin 1
1 exp[im] 2
z
r z
y
x
y x
根据态叠加原理,将两个特解组合,仍是系统可取的
状态,因此可以组合得到实数形式的解
m
1 eim
2
1 (cos m i sin m) 2
m
1 eim
2
1 (cos m i sin m) 2
cos m
sin m
1 2
(m
Re 109677cm1
Bohr模型的不足和失败
➢Bohr模型的量子化条件是人为强加的; ➢Bohr模型的电子具有确切的轨道,仍遵循经典力学
规律;
➢Bohr模型中的电子没有表现出几率波的特性; ➢Bohr原子是平面的而非球形的。
i
h2
8 2m
i
2
Vˆ
E
2.1.1 单电子原子的Schrödinger方程
Zr na0
)
2Zr na0
L2l 1 n1
(
2Zr na0
)
(2l 1)
2
(l (l
m m
)!1/ 2 )!
Pl m
(cos )
氢 原 子 的 波 函 数
量子数的物理意义
nlm (r, ,) R(r)( )()
单电子原子的总空间波函数y 取决于三个量子数,一般写成nml ,叫做原子轨道。
sin
(sin
)
1
sin2
2
2
由此可以得到球极坐标系下的Schrödinger方程
h2
2
2
Ze2
40r
(r,
,
)
E
(r,
,
)
完整形式如下
h2
8 2
1 r2
r
r
2
r
1
sin
sin
1 sin 2
2 2
V E
令:(r, ,) R(r)( )()
两边同乘以
结构化学基础原子的结构与性 质课件
卢瑟福的a粒子散射实验和原子的行星模型
阴极射线实验发现电子 (1897年)
汤姆孙的原子模型
1909-1911 年
卢瑟福的行星模型
2
m r
Ze2
4 0 r 2
困难:卢瑟福的原子不能稳定存在, 将会发射出电磁波并崩溃
而且卢瑟福的原子模型不能解释原子光谱
巴耳末公式
• 氢原子光谱(在可见光内)
8ch3
2 0
1 n12
1 n22
对于吸收光谱,n1>n2, 由实验总结得到的里德堡公式为
v%
R
1 n12
1 n22
对比两个公式,可以看到Bohr理论很好地解释了氢原子
吸收光谱,由此可以精确求得Rydberg常数
m me , R 109737cm1 m H , RH 109678cm1
z
r z
y
x
y x
r : [0,∞] : [0,] : [0,2]
按照偏微分关系
x
r
r x
x
x
可以将拉普拉斯算符在球极坐标下表示出来
2
1 r2
rrLeabharlann 2r1r2 sin
sin
1
r 2 sin2
2
2
类似的,还可以得到球极坐标系下其他的算符
Mˆ z
ih
Mˆ 2
h2
1
1 sin
2
2
1 exp[i2] 2
cos 2
1 cos 2
2
2
1 exp[i2] 2
sin 2
1 sin 2
2.1.4 单电子原子的波函数
nlm (r, ,) R(r)( )()
1 exp[im] 2
l
[( 2 )3 na0
(n l 1)! 2n[(n l)!]3
] exp(
r 2 sin2
R(r)( )()
移项整理:
1
d 2
d 2
sin2
R
d dr
r
2
dR dr
sin
d
d
sin
d
d
8 2
h2
r 2 sin2 (E V )
1
d 2
d 2
常数
令:1
d 2
d 2
m2
则:d 2
d 2
m2
0
2.1.3 方程的解
z
d 2
d 2
m2
0
r z
此方程的特解为
定态的条件:电子做圆周运动的角动量是量子化的。
M nh n, 2π
n 1,2,3,...
频率规则:
当电子由能量为En的定态跃迁到能量为Em的定态时,
就会吸收或发射频率为 的光子。
| Em En | E
h
h
Bohr的氢原子模型
电子绕核运动向心力和原子核对其吸引力大小相等方
向相反
m 2
e2
y
x
Aexp[im]
m|m|
exp[im] exp[im( 2 )] exp[im]exp[im2 ]
y x
根据波函数的单值条件,有
() ( 2 )
亦即
exp[im2 ] 1 exp[im2 ] cos m2 i sin m2 1
由此
m 0, 1, 2,L
再根据归一化条件,解得
1885年,巴耳末提出公式
B(
m2 m2 22
)
里德堡公式
m 3, 4,5,...
B 364.56
v%
R
1 n12
1 n22
n 1, 2,3,...且n2 n1 R 109677cm1
原子结构的Bohr(玻尔)理论 1913 年
定态规则: 原子有系列定态,每个定态有一相应的能量E,电子在 这些定态上绕核作圆周运动,处于稳定状态。
单电子原子:H,He+,Li2+ 体系中的两个粒子:
带正电的原子核 带单位负电荷的电子 由此写出体系的Hamiltonian和Schrödinger方程:
Hˆ
h2 2M
2N
h2 2me
e2
Ze2
4 0 r
Hˆ (X ,Y , Z, x, y, z) E ( X ,Y , Z, x, y, z)
原子核和电子动能项合并为: 1 r&2
2
meM
me M
M 1836.1me
0.99946me
(可以近似取 me 此时可以认为质心位于原子核上,原子核近似不动)
在原子核为原点的参考系中,单电子原子的Schrödinger 方程为
h2
8 2
2
Ze2
4 0 r
(x,
y,
z)
E
(x,
y,
z)
2.1.2 变量分离法
为方便解Schrödinger方程,使用球坐标系
r 40r2
电子的能量(不考虑核运动)
E 1 m2 e2 e2
2
40r 80r
角动量的量子化条件
可以求得
M mr nh
r
4 0 n 2 h 2
me2
E me4
8n2 0 h2
根据求得的能级公式,可以知道原子吸收或发射光谱的 波数和频率为
v% v c
En1 En2 hc
me4
m
)
i 2
(m
m
)
1 cos m 1 sin m
由于组合的两个函数是不同本征值(不包括m=0)的本征函数,因此 组合后的实函数解不再是角动量Z方向分量的本征函数。
方程的解
m
复函数解
实函数解
0
0
1 2
0
1 2
1
1
1 exp[i] 2
cos 1
1 cos
1
1
1 exp[i] 2
sin 1
