氧化还原反应-复习PPT课件
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应复习-完整版课件

若有3molHCl被氧化,则有多少摩尔氧化 剂参加反应?
练原1全习.反后:现应得已有,到知45反9C0.7l应02gm在C完Ll7溶2全0,℃液后将的.测其N得通aO溶入H液水到中溶足N液量a中C7l0O,℃与能的N同NaCa时lOO发H3的水生物溶两质液个的中自量,身之反氧比应化为完还4: ((12))写计出算C完l2全在反70应℃后的生Na成OH物水N溶aC液lO中3的符物合质上的述量条浓件度的.总反应方程式。
• (2018.4)27.(6分)某同学用含结晶水的正盐X(四种短 周期元素组成的纯净物)进行了如下实验:
• 实验中观测到:混合气甲呈无色并被蒸馏水全部吸收; 固体乙为纯净物;在步骤③中,取溶液丙1/10,恰好中 和需消耗0.00200 mol NaOH;另取一定量的溶液丙,加 入少量K2FeO4固体,产生黄绿色气体。(且将被还原为 +3价) • 请回答: • (2) 溶液丙与K2FeO4固体反应的化学方程式是________。
• A.Cl2→Cl• B.I-→I2 • C.SO2→SO32• D.CuO→Cu
问B题r23+:2KI已=2知KB反r+应I2,:试Cl比2+2较KBKrB=r2、KCKlI+、BKrC2;l的还原性强弱?
若将少量氯水加入KBr、KI的混合溶液中 ,会如何反应? 问题4:实验室也可用反应: KClO3+6HCl=KCl+3Cl2↑+3H2O制取Cl2,用双线 桥表示该反应的电子转移方向与数目?
氯气及氧化还原反应复习
判断:下列有关Cl2的叙述是否正确,错误的请改正。 1、新制氯水可使蓝色石蕊试纸先变红后褪色 ,可知氯气 有漂白性。
2、工业上用Cl2和石灰水为原料制造漂白粉。 3、Cl2可与Fe反应生成FeCl2,故不能用铁罐存放液氯 。 4、工业上常用MnO 2和稀盐酸共热来制取氯气 。 5、漂白粉在空气中易失效,应密封保存。
练原1全习.反后:现应得已有,到知45反9C0.7l应02gm在C完Ll7溶2全0,℃液后将的.测其N得通aO溶入H液水到中溶足N液量a中C7l0O,℃与能的N同NaCa时lOO发H3的水生物溶两质液个的中自量,身之反氧比应化为完还4: ((12))写计出算C完l2全在反70应℃后的生Na成OH物水N溶aC液lO中3的符物合质上的述量条浓件度的.总反应方程式。
• (2018.4)27.(6分)某同学用含结晶水的正盐X(四种短 周期元素组成的纯净物)进行了如下实验:
• 实验中观测到:混合气甲呈无色并被蒸馏水全部吸收; 固体乙为纯净物;在步骤③中,取溶液丙1/10,恰好中 和需消耗0.00200 mol NaOH;另取一定量的溶液丙,加 入少量K2FeO4固体,产生黄绿色气体。(且将被还原为 +3价) • 请回答: • (2) 溶液丙与K2FeO4固体反应的化学方程式是________。
• A.Cl2→Cl• B.I-→I2 • C.SO2→SO32• D.CuO→Cu
问B题r23+:2KI已=2知KB反r+应I2,:试Cl比2+2较KBKrB=r2、KCKlI+、BKrC2;l的还原性强弱?
若将少量氯水加入KBr、KI的混合溶液中 ,会如何反应? 问题4:实验室也可用反应: KClO3+6HCl=KCl+3Cl2↑+3H2O制取Cl2,用双线 桥表示该反应的电子转移方向与数目?
氯气及氧化还原反应复习
判断:下列有关Cl2的叙述是否正确,错误的请改正。 1、新制氯水可使蓝色石蕊试纸先变红后褪色 ,可知氯气 有漂白性。
2、工业上用Cl2和石灰水为原料制造漂白粉。 3、Cl2可与Fe反应生成FeCl2,故不能用铁罐存放液氯 。 4、工业上常用MnO 2和稀盐酸共热来制取氯气 。 5、漂白粉在空气中易失效,应密封保存。
《氧化还原反应》PPT课件

氧化性: MnO4-> MnO2 > Cl2 > Br2 > Fe3+ > I2
第4讲 氧化还原反应方程式的 配平
氧化性、还原性强弱比较规律:
(一)根据方程式判断氧化还原性强弱
对于任何氧化还原反应,都满足下列规律:
失电子、化合价升高、被氧化,发生氧化反应
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
A
B
b
a
得电子、化合价降低、被还原,发生还原反应
氧化性:A >a(氧化产物) 还原性:B > b(还原产物)
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > (2H)温2S度O越4(高稀),氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
例题: 1.判断下列反应能否发生?若能发生写出离子反 应方程式,并比较氧化性强弱。
⑴所有的置换反应都是 氧化还原反应
⑵所有的复分解反应都 是非氧化还原反应
⑶有单质参加的化合反 应一定是氧化还原反应
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
⑷有单质生成的分解反 应一定是氧化还原反应
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是
(1)H2是氧化产物
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
第4讲 氧化还原反应方程式的 配平
氧化性、还原性强弱比较规律:
(一)根据方程式判断氧化还原性强弱
对于任何氧化还原反应,都满足下列规律:
失电子、化合价升高、被氧化,发生氧化反应
氧化剂 + 还原剂 = 氧化剂的还原产物 + 还原剂的氧化产物
A
B
b
a
得电子、化合价降低、被还原,发生还原反应
氧化性:A >a(氧化产物) 还原性:B > b(还原产物)
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > (2H)温2S度O越4(高稀),氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
例题: 1.判断下列反应能否发生?若能发生写出离子反 应方程式,并比较氧化性强弱。
⑴所有的置换反应都是 氧化还原反应
⑵所有的复分解反应都 是非氧化还原反应
⑶有单质参加的化合反 应一定是氧化还原反应
分解反应 化合反应
氧化还原反应 置换反应
复分解反应
⑷有单质生成的分解反 应一定是氧化还原反应
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑
的反应中,下列叙述正确的是
(1)H2是氧化产物
生成 原 产
原 具有 性
原应
物
性质 反应物 特征 实质 过程 反应 产物 性质
(同时存在)
(总数相等)(同时进行同时消失)(同时生成)
氧化还原反应ppt课件

请找出下列反应的氧化剂、氧化产物、还原剂、还原产物
Fe2O3 + 3CO
高温
=
2Fe + 3CO2
2KMnO4 Δ= K2MnO4+MnO2+O2 ↑
SO2 + 2H2S = 3S↓+2H2O
1.3 氧化还原反应
第二课时
4、氧化还原反应的本质
点燃
2Na + Cl2 = 2NaCl 化合价发生改变的原因:电子得失
部分非金属单质
含有高价态元素的
氧
化合物
化 某些金属活动性较
剂 弱的元素对应的高
价态离子
过氧化物
O2、Cl2等 浓硫酸、HNO3、KMnO4、MnO2、
KClO3、K2Cr2O7等
Fe3+、Ag+、Pb4+、Cu2+等
Na2O2、H2O2等
4、氧化性 还原性
还原剂具有还原性(降低其他物质元素的化合价)
化合价升高,失电子,被氧化
化合价降低,得电子,被还原
氧化剂:所含元素的化合价降低, 即得到电子(或电子对偏向)的反应物。
还原剂:所含元素的化合价升高, 即ห้องสมุดไป่ตู้去电子(或电子对偏离)的反应物。
记忆口诀
升失氧,降得还,要说剂,恰相反 还原剂: 化合价升高,失去电子,发生氧化反应,被氧化,生成氧化产物 氧化剂: 化合价降低,得到电子,发生还原反应,被还原,生成还原产物
2.单线桥法(不同元素,失电子物质指向得电子物质)
2×3e-
0 +3
0 +3
①必须箭头(失电子物质元素)指向箭尾(得电子物质对应元素) ②单线桥上不须注明“得到”或“失去”,仅注明电子转移数目
B (大本 P27 第 4 题)下列反应中,电子转移的方向和数目正确的是( )
氧化还原反应ppt课件

化合价降低,得电子,被还原
化合价升高,失电子,被氧化
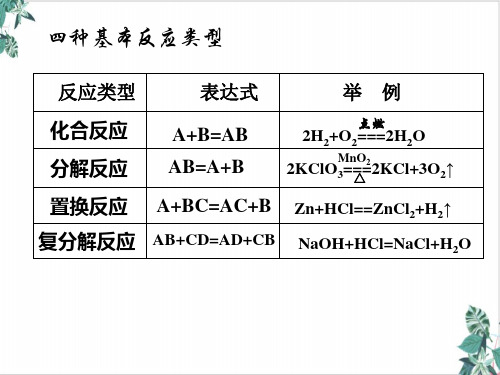
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应ppt课件

化合价降低,被还原,发生还原反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
氧化还原反应PPT课件

第二章 化学反应及其变化
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
活泼的金属单 质
M(金属)
活泼的非金属
H2
单质
C
氧化物
CO SO2
元素处于低价 态时的化合物
酸
H2S HI
盐
SO32-
Fe2+
2021
对应氧化产物
Mn+
H2O CO或CO2
CO2 SO3或SO42-
S
I2
SO42-
Fe3+
7
三、氧化还原的计算:得失电子守恒。
硫代硫酸钠可作为脱氯剂,已
知25.0ml,0.100 mol/L Na2S2O3
链接高考
(2009· 上海高考)某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一 种未知物质X. (1)已知KBrO3在反应中得到电子,则该反应的还原剂 是__________. (2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X, 则X的化学式为__. (3)根据上述反应可推知________. a.氧化性:KBrO3>H3AsO4 c.还原性:AsH3>X b.氧化性:H3AsO4>KBrO3 d.还原性:X>AsH3 (4)将氧化剂和还原剂的化学式及其配平后的化学计量数 填入下列方框中,并标出电子转移的方向和数目(用单线 桥法)
③Cl2的氧化性比ClO-的氧化性
④Cl2 是
产物。
反应, ,
2021
4
一、概念间的关系
氧化剂→____→____→____ →______→____
↑↑↑↑
↑↑
反应物—性质—本质 — 特征 —反应 — 生成物
↓↓↓↓
↓↓
还原剂→____→_____→____ →______→______
二、常见的氧化剂、还原剂
知识应用
氧化反应
原电池
还原反应
知识应用
(2011上海高考)雄黄(As4S4)和雌黄 (As2S3)是提取砷的主要矿物原料,二者在 自然界中共生。根据题意完成下列填空:
(3)As2S3和HNO3有如下反应:
As2S3 + 10H+ + 10NO3-===2H3AsO4 + 3S
+10NO2↑+ 2H2O。若生成2mol H3AsO4,则
步骤一、根据价态变化找出反应物,推出生成物
反应物:K2Cr2O7+ C2H5OH+ H2SO4 氧化产物、还原产物:CH3COOH 和Cr2(SO4)3 步骤二、请写出未配平的方程式: 步骤三、根据得失电子守恒进行配平。
2K2Cr2O7+3C2H5OH+8H2SO4= 2K2SO4+2Cr2(SO4)3+3CH3COOH +11H2O
1.常见的氧化剂
物质类型
举例
对应还原产物
活泼的非金属 单质
元素处于高价 态的化合物
过氧化物
X2(卤素)
O2
氧化物 MnO2
含氧酸
浓硫酸 硝酸
盐
KMnO4
Fe3+
Na2O2、202H1 2O2
X- O2-或OH-
Mn2+
SO2或S
NO或NO2 Mn2+
Fe2+或Fe
H2O
6
2.常见的还原剂
物质类型
举例
溶液恰好把224 ml(标准状况下) Cl2
转化为Cl-,则S2O32-将转化成
A. S2-
B. S
C. SO32-有K2Cr2O7的 硅胶颗粒的装置吹气,通过某些现象,即可 证明司机是酒后驾车。
Cr2O72-橙红色 Cr3+蓝绿色
四、陌生方程式书写、配平方法
2021
2
资料 检 索
主要成分 各种无机酸 和有机酸、 缓蚀剂、增 稠剂、表面 活性剂、香 精等。
主要成分 NaClO、NaCl。 无色或淡黄色 液体,有效氯 含量5.5~ 6.5%
2021
3
“洁厕灵”遇到“84消毒液”
ClO-+Cl-+2H+ =Cl2↑+H2O
①体现氧化性的离子
,
②由Cl- 转变为Cl2发生了
反应中转移电子的物质的量为
。若将该
反应设计成一原电池,则NO2应该在 “正极”或“负极”)附近逸出。
(填
2021
13
化学课
某日上化学课 ,老师宣布下节课要小 考。小宇紧张地立即举手问老师会不会考得 很难,老师只说了一句:十分简单。乐得大 家拍手叫好,可是考完后每个人都考得惨不 忍睹,怎么会简单呢?于是小宇又问了老 师 ,只听老师说:我可没说错哦,十分简 单,剩下九十分很难 !
2021
1
氧化还原反应 复习
义乌中学——朱秀丹
